颈动脉不稳定斑块与狭窄在缺血性脑卒中发病机制中的作用
袁 薇,付娜娜,石正洪
我国脑卒中的发病率为250/10 万,仅次于西伯利亚地区(300/10 万),居世界第2 位,且发病率逐年上升,已经成为危害我国居民健康的严重疾病。根据2008 年公布的第3 次全国死因调查结果显示,脑血管病已成为我国居民的首位死因。动脉粥样硬化是导致缺血性卒中的重要病因,其与卒中发生的相关性研究虽较多,但研究方法不一。以往研究多采用超声对颈动脉进行评价,而近些年来强调CTA对颈动脉斑块或狭窄的诊断价值[1]。本文就采用CTA 对患者颈动脉进行评价,回顾性分析缺血性卒中患者和非缺血性卒中患者颈动脉CTA 的情况,探讨CTA 颈动脉粥样硬化斑块的部位、性质、狭窄程度在缺血性卒中发生中的作用。
1 材料与方法
1.1 一般资料 实验组选择2011 年01 月01日~2013 年02 月01 日在兰州大学第二医院神经内科治疗的缺血性脑卒中住院患者(缺血性卒中组)。纳入标准:(1)根据全国第四届脑血管病会议修订的脑梗死诊断标准;(2)CT 或MRI 影像学诊断为缺血性脑卒中;(3)经颈动脉CTA 检查。排除标准为:(1)肝肾功能不全,对造影剂过敏,不能接受CTA 检查;(2)慢性感染性疾病、肿瘤、免疫性疾病等;(3)资料不全者。对照组为同期在神经内科科住院的非缺血性卒中患者,均经头部CT 或MR 检查排除脑梗死。一般资料采集,包括高血压、糖尿病、脂代谢紊乱、心脏病、卒中或短暂性脑缺血发作(TIA)等病史。
1.2 颈动脉CTA 检查 首先对被检查者进行碘对比剂试验,以确保患者对对比剂不过敏。经肱经脉注入造影剂,患者均采用德国Siemens 公司Somatom Plus 4CT 机进行常规颅脑扫描,采集并处理图像,由两位以上不同资历医师阅片,统计颈动脉斑块部位及性质、颈动脉管腔狭窄情况。颈动脉狭窄判定标准:按照北美症状性颈动脉内膜剥脱实验(the North American Symptomatic Carotid)的标准,轻度:10%~29%;中度:30%~69%;重度:70%~100%。
1.3 统计学方法 应用SPSS 19.0 进行统计分析。计量资料用±s 表示,组间比较采用两独立样本比较的t 检验,计数资料用%表示,组间比较采用两样本率的比较,χ2检验;P<0.05 定义为有统计学意义。
2 结果
2.1 一般资料比较 共纳入80 例患者。缺血性卒中组37 例,男32 例(86.5%),女5 例(13.5%),年龄34~78 岁,平均61±11.0 岁;非缺血性卒中组43 例,男30 例(69.8%),女13 例(30.2%),年龄39~83 岁,平均57±11.1 岁。两组患者在年龄、性别、高血压、糖尿病、脂代谢紊乱、房颤、卒中史等基本情况分布无差别(P>0.05)(见表1)。
2.2 颈动脉CTA 情况 缺血性卒中组共检出斑块(不稳定斑块、稳定斑块)104 个,是非缺血性卒中组(不稳定斑块、稳定斑块)的4 倍。两组检出的不稳定斑块比例差异具有显著性意义(χ2=10.72;P=0.001);且缺血性卒中组不稳定斑块较稳定斑块检出率高,差异具有统计学意义(χ2=20.94;P<0.001);而非缺血性卒中组检出的斑块主要为稳定斑块,显著高于不稳定斑块(χ2=8.00;P=0.004)。缺血性卒中组与非缺血性卒中组颈动脉轻、中、重度狭窄程度上均有显著性差异(P<0.05);缺血性卒中组重度狭窄比率较非缺血性卒中组明显高,差异有统计学意义(χ2=7.42;P<0.01)。两组斑块在分布部位上无差异,均以颈内动脉起始处最多见占67.3%,其次是颈内动脉虹吸部占18.3%,再次是颈总动脉占14.4%(见表2)。
2.3 logistic 回归分析 以缺血性卒中为应变量,颈动脉的斑块部位、斑块性质、狭窄程度为自变量,进行回归分析,采用向后法:颈动脉狭窄程度优势比最大(OR=10.939;P=0.001);其次是不稳定斑块(OR=5.077;P=0.028);其他因素均被排除。采取同样方法仅对轻度、中度狭窄患者进行分析,不稳定斑块优势比最大(OR=11.840;P<0.001);其次是颈动脉狭窄程度(OR=4.709;P=0.014)。

表1 缺血性卒中组和非缺血性卒中组基本资料对比
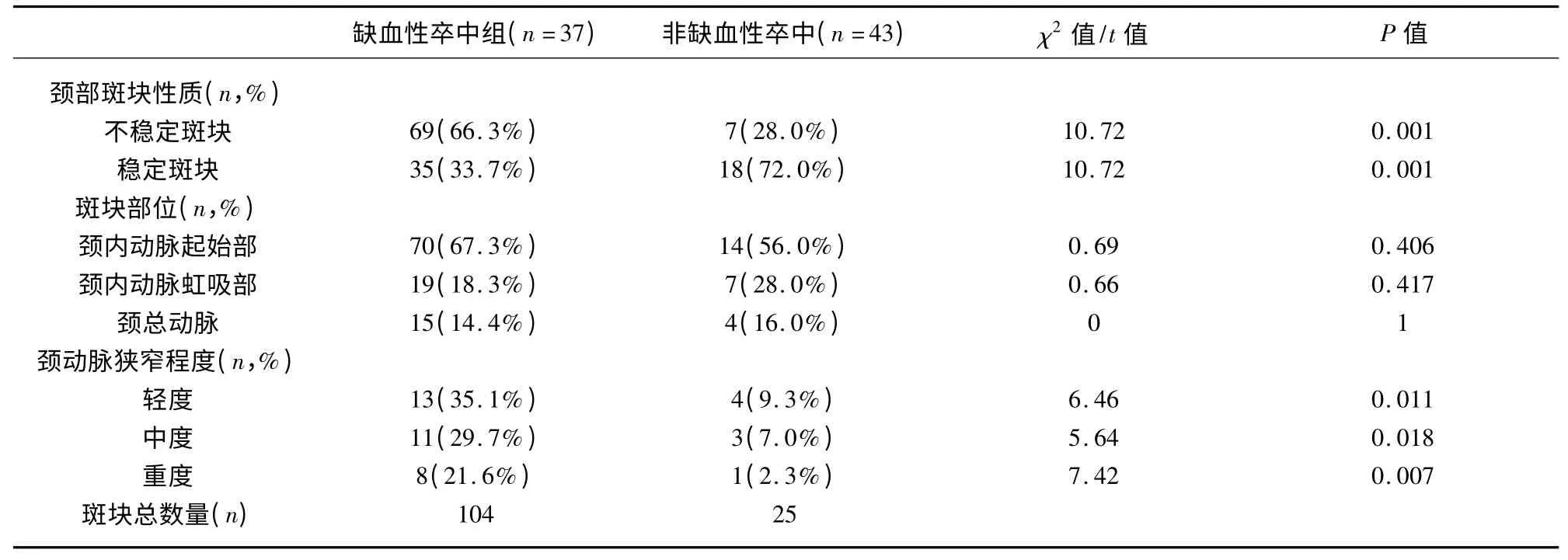
表2 缺血性卒中组和非缺血性卒中组颈动脉CTA 特点
3 讨论
中国人缺血性卒中占全部卒中的2/3,大动脉粥样硬化性卒中占全部缺血性卒中的40%[2],导致缺血性卒中的危险因素有:吸烟、饮酒、高血压、脂代谢紊乱、糖尿病、动脉粥样硬化等。颅内外动脉粥样硬化狭窄是全球范围内脑卒中的重要病因,在中国和亚洲人群中更为突出[3],而颈动脉粥样斑块疾病导致了约为30% 的缺血性卒中[4]。Fisher 等人认为[5],不稳定斑块破裂是导致非腔隙性脑梗死的最重要原因。在本研究中,缺血性卒中组斑块的总检出率是非缺血性卒中组的4 倍余,不稳定性斑块的数量约为非缺血性卒中组的10 倍。两组患者不稳定性斑块的比率有显著性差异(χ2=10.72;P=0.001),这与国内有关报道的结果相一致[6]。我们通过回归分析也发现,对于轻、中度狭窄的患者来说,颈动脉不稳定斑块的优势比最大(OR=11.840;P<0.001),是缺血性卒中最重要的危险因素。这说明,对于颈动脉轻度、中度狭窄的患者来说,不稳定斑块才是导致缺血性卒中的最重要原因,而非颈动脉狭窄。
国外相关研究显示[4],狭窄面积<70%(轻、中度狭窄)的患者发生卒中的风险很小,1.3%~3.3%/年。两组患者颈动脉的狭窄程度之间也存在明显差异,尤其是重度狭窄的比例,缺血性卒中组较非缺血性卒中组有显著性差异(χ2=7.42;P<0.01)。相反,两组轻、中度狭窄的患者并未有如此大的差异。过去认为缺血性卒中与颈动脉粥样硬化性狭窄有关,颈动脉内膜剥脱术可降低严重颈动脉狭窄(狭窄面积>70%)患者随访期间脑梗死发生率和死亡率[7],但随着时间的进展,行颈动脉内膜剥脱术的有症状颈动脉狭窄患者的卒中和死亡风险反而增加了[8]。因此,对于狭窄面积<70%的患者来说,斑块的性质比管腔的狭窄程度更有重要,稳定斑块、防止不稳定斑块破裂比单纯实施颈动脉内膜剥脱术更有意义。但对于重度狭窄患者来说情况就没有这么简单了。无症状性颈内动脉闭塞患者年卒中率仅为2%~3%,这些患者中95% 以上不会发生卒中。Hennerici 等发现在无症状性患者中TIA 和卒中的发生频率随颈内动脉狭窄的等级的增加而增加。北美症状性颈动脉内膜切除术试验和欧洲颈动脉外科手术试验发现卒中风险与短暂性单眼黑蒙、短暂性半球缺血发作及小卒中患者颈内动脉狭窄的严重程度密切相关。[9]我们通过回归分析发现,对于重度狭窄的患者,颈动脉狭窄程度、不稳定斑块均是缺血性卒中的重要危险因素(OR 分别是=10.939,5.077;P=0.001,0.028),而来自颈动脉狭窄程度方面的风险更高。
本研究中两组斑块部位无差异(P>0.05),且均以颈内动脉起始处最多见占67.3%,但以往研究报道斑块主要位于颈总动脉分叉处。这可能与评价技术有关,以往研究多采用超声对颈动脉进行评价,而本研究采用颈动脉CT 血管造影的方法。CTA 与传统的DSA 相比,CTA 诊断狭窄面积>50%的灵敏度是96.6%,特异度是99.4%,真阳性率是99.6%,CTA 与DSA 的一致性是96%[10],在这些方面超声是不能相比的。CTA 可以将心脏、颈部、颅内血管同时进行评估,通过三维重建技术,清楚地显示斑块的性质、大小、部位,而不是仅限于血管分叉处。[11]
综上所述,颈动脉斑块的性质及颈动脉的狭窄程度均是导致缺血性卒中发生的重要原因;对与狭窄面积<70%(轻、中度狭窄)的患者来说,不稳定斑块是导致缺血性卒中的最重要原因;但对于重度狭窄患者来说,两者均是缺血性卒中的重要原因。但由于本研究的样本含量有限,结果的论证还有待多中心、大样本的进一步研究。
[1]Eesa M,Hill MD,Al-Khathaami A,et al.Role of CT Angiographic Plaque Morphologic Characteristics in Addition to Stenosis in Predicting the Symptomatic Side in Carotid Artery Disease[J].AJNR Am J Neuroradiol,2010,31(7):1254-1260.
[2]周 衡,王拥军,王素香,等.急性缺血性脑卒中的TOAST 亚型分析[J].中华内科杂志,2004,43(7):495-498.
[3]董 强,黄家星,黄一宁,等.症状性动脉粥样硬化性颅内动脉狭窄中国专家共识[J].中国神经精神疾病杂志,2012,38(3):129-145.
[4]Magge R,Lau BC,Soares BP,et al.Clinical risk factors and CT imaging features of carotid atherosclerotic plaques as predictors of new incident carotid ischemic stroke:a retrospective cohort study[J].AJNR Am J Neuroradiol,2012,34(2):402-409.
[5]Fisher M,Paganini-Hill A,Martin A,et al.Carotid plaque pathology:thrombosis,ulceration,and stroke pathogenesis[J].Stroke,2005,36(2):253-257.
[6]董智强,陈 旭,苏敬敬,等.颈动脉粥样硬化及斑块的性质、部位与缺血性卒中的关系:回顾性病例对照研究[J].国际脑血管杂志,2011,19(3):199-203.
[7]McKinsey JF.Symptomatic carotid stenosis:endarterectomy,stenting,or best medical management[J].Semin Vasc Surg,2008,21(2):108-114.
[8]Rerkasem K,Rothwell PM.Temporal trends in the risks of stroke and death due to endarterectomy for symptomatic carotid stenosis:an updated systematic review[J].Eur J Vasc Endovasc Surg,2009,37(5):504-511.
[9]宋 扬,高 山.低灌注和栓塞的共同作用在缺血性卒中中扮演的角色[J].中国卒中杂志,2006,1(4):305-308.
[10]Duffis EJ,Jethwa P,Gupta G,et al.Accuracy of computed tomographic angiography compared to digital subtraction angiographyin the diagnosis of intracranial stenosis and its impact on clinical decisionmaking[J].J Stroke Cerebrovasc Dis,2013,22(7):1013-1017.
[11]Enterline DS,Kapoor G.A practical approach to CT angiography of the neck and brain[J].Tech Vasc Interv Radiol,2006,9(4):192-204.

