TaqMan探针双重荧光PCR法检测副溶血性弧菌
许龙岩,袁慕云,曹际娟,凌 莉
(1.广东出入境检验检疫局,广东 广州 510623;2.辽宁出入境检验检疫局,辽宁 大连 116001)
TaqMan探针双重荧光PCR法检测副溶血性弧菌
许龙岩1,袁慕云1,曹际娟2,凌 莉1
(1.广东出入境检验检疫局,广东 广州 510623;2.辽宁出入境检验检疫局,辽宁 大连 116001)
目的:建立同时检测副溶血性弧菌(VP)和其毒力基因的方法。方法:根据VP的toxR基因和tdh基因,分别设计引物和探针,建立基于TaqMan探针双重荧光聚合酶链式反应扩增体系,进行特异性、敏感性实验,并用建立的方法检测从广东地区和辽宁地区进出口食品中分离的VP菌株的毒力基因分布情况。结果:VP标准菌株和3株从食物中毒病人中分离株均出现toxR基因和tdh基因扩增曲线,而31株包括溶藻弧菌、单增李斯特菌等弧菌属和肠杆菌科的菌株扩增结果呈阴性;敏感性实验结果表明,VP浓度与Ct值有很好的反向的线性关系,toxR和tdh线性方程的R2分别为0.999、0.997,最低检测浓度达到3.6×102CFU/mL ;检测食品中分离的37株VP只出现toxR基因扩增曲线,未见tdh基因扩增曲线,表明37株VP分离株均未带tdh毒力基因。结论:建立的方法特异性好、灵敏度高,可用于食品中VP的特异性及毒力基因检测。
副溶血性弧菌;toxR基因;tdh基因;TaqMan探针;双重荧光聚合酶链式反应;检测;食品
副溶血弧菌(Vibrio parahaemolyticus,VP)是一种重要的食源性病原菌,其引发的食源性疾病暴发是当前面临的公共卫生问题之一[1]。临床上分离的VP绝大多数可在一种特殊的血琼脂培养基上产生β型溶血,称为神奈川现象(kanagawa phenomenon,KP),KP是鉴定致病性和非致病性VP菌株的一项重要指标,日本学者认为VP的KP现象与肠道致病性有着密切的关系。β型溶血反应是由VP产生的耐热的直接溶血毒素(TDH)所造成,它由tdh基因编码,是副溶血性弧菌致病的主要毒力因子[2-3]。检测tdh基因对判断VP有无致病性非常实用,但tdh基因家族广泛存在于人类致病性弧菌中,如大多数霍利斯弧菌,某些拟态弧菌等,因此,仅用tdh检测VP存在一定的局限性[4-6]。以tlh为靶基因也可能出现同样的情况,Robert-Pillot[7]、杨梅[8]等的研究发现,溶藻弧菌和副溶血性弧菌的同源性达60%~70%,靶定tlh基因的引物不能用于两者的鉴别。Croci等[9]评估了不同靶基因的副溶血性弧菌的聚合酶链式反应(polymerase chain reaction,PCR)法,指出toxR作为靶基因的PCR具有最高的准确性,该基因可作为VP分子鉴别的参考方法。本研究以VP的toxR基因和tdh基因为目的基因,分别设计引物和探针,以期建立基于TaqMan探针的双重荧光PCR法同时检测VP和其毒力基因的方法,并分析VP菌株毒力基因tdh的携带情况。AB063113)和tdh基因序列(序列号:BA000032)中的保守区域,用Oligo 5.0软件设计引物和TaqMan探针,委托宝生物工程(大连)有限公司合成。荧光PCR引物、探针和普通PCR引物序列见表1。

表1 荧光PCR引物、TTaaqqMan探针和普通PCR引物序列Table1 Fluorescence PCR primers,TTaaqqMan probes and one common PCR primer sequence
1 材料与方法
1.1 材料与试剂
用于本研究的VP菌株共41株,其中标准菌株1株,编号为ATCC 33847,VP食物中毒患者分离株3株,编号分别为VP1、VP2、VP3,广东地区进出口食品中分离的VP 21株,编号为GD1~GD21,辽宁地区进出口食品中分离的VP 16株,编号为LN1~LN16;非VP弧菌属菌株19株,其中标准菌株4株,分别为溶藻弧菌CGMCC 1.1833、海蛹弧菌CGMCC 1.1623、弗氏弧菌CGMCC 1.1613、最小弧菌CGMCC 1.1969,15株水产品中的分离株,分别为溶藻弧菌3株、创伤弧菌2株、霍利斯弧菌3株、最小弧菌3株、霍乱弧菌2株、塔式弧菌2株;肠杆菌科菌株12株,分别为单增李斯特菌ATCC 19115、金黄色葡萄球菌ATCC 6538、阪崎肠杆菌ATCC 29544、大肠杆菌ATCC 25922、沙门氏菌CMCC 50071、鲍氏志贺氏菌CMCC 51582、宋内氏志贺氏菌CMCC 51334、痢疾志贺氏菌NICPBP 51252、福氏志贺氏菌NICPBP 51571、小肠结肠炎耶尔森氏菌CMCC 52221、假结核耶尔森氏菌CMCC 53510、肺炎克雷伯氏菌CMCC 46102。上述菌株来自中国普通微生物菌种保藏管理中心、中国科学院南海水产研究所、辽宁出入境检验检疫局技术中心和广东出入境检验检疫局技术中心。所有菌株均经VITEK2和API试剂条进行确证。
Buffer、dNTP、ROX、Taq酶、琼脂糖、PCR分子质量标记(50~500bp) 宝生物工程(大连)有限公司;碱性蛋白胨水 北京陆桥有限公司。
1.2 仪器与设备
7900实时荧光PCR仪 美国ABI公司;核酸提取仪日本PSS公司。
1.3 方法
1.3.1 引物和探针设计
根据GenBank公布的VP toxR基因(序列号:
1.3.2 模板DNA的制备
所有菌株均用3%氯化钠碱性蛋白栋水37℃培养10h,取1mL菌悬液,12000r/min离心5min去上清液,用1mL去离子水漂浮沉淀,12000r/min离心3min去上清液,重复2次,最后加200μL去离子水在核酸提取仪上提取DNA,用于荧光PCR扩增。
1.3.3 PCR扩增体系及反应参数
1.3.3.1 双重荧光PCR扩增体系
反应体系共30μL:模板DNA 2μL、TaqMan缓冲液5μL、5mmol/L MgCl24μL、2.5mmol/L dNTPs 2μL、20μmol/L TaqMan探针各1μL(共2μL)、20μmol/L引物各1μL(共4μL)、UNG酶(0.55U)0.2μL、Taq聚合酶3μL、去离子水7.8μL。荧光PCR反应参数为95℃ 30s、93℃ 5s、60℃ 30s,40个循环。
1.3.3.2 普通双重PCR扩增体系和反应条件
反应体系共50μL:10×PCR Buffer(含Mg2+)5μL、dNTPs 4μL (每种dNTP的终浓度均为0.2mmol/L)、引物各2μL(共8μL,每种引物终浓度为0.2μmol/L),模板DNA 2μL、Taq酶0.25μL、去离子水30.75μL。
PCR循环参数为95℃、30s,94℃、30s、55℃、30s、72℃、1min,30个循环,72℃延伸10min,取PCR产物及核酸分子质量参照物,在2%琼脂糖凝胶上进行电泳分析。
1.3.4 特异性实验
VP标准菌株1株、40株VP分离株,VP1~VP3、GD1~GD21、LN1~LN16,31株溶藻弧菌、单增李斯特菌等弧菌属和肠杆菌科的菌株,提取DNA后按双重荧光PCR反应体系进行荧光PCR扩增。
1.3.5 双重荧光PCR敏感性实验及标准曲线
经平板菌落计数原始浓度为3.6×107CFU/mL的VPATCC 33847培养液进行10倍梯度稀释,从每个稀释度中取1mL培养液提取DNA,按照双重荧光PCR反应体系进行敏感性实验。在荧光PCR仪上选择标准品模式,仪器自动绘制标准曲线。
1.3.6 普通双重PCR
用VP标准菌株1株,VP1~VP3为模版,以toxR和tdh为目的基因,按照普通双重PCR扩增体系进行PCR扩增,扩增产物用2%琼脂糖凝胶电泳检测。
1.3.7 PCR结果判断
1.3.7.1 荧光PCR结果判定
荧光PCR检测扩增曲线指数期明显,Ct值小于35可直接判定为阳性。Ct值在35~37之间判断为可疑,需要加大模板量进行重复实验,若扩增曲线指数期明显判定为阳性,否则为阴性。
1.3.7.2 普通PCR结果判定
有符合预期长度且电泳条带明显者判定为阳性,不符合预期长度或者条带不明显者判定为阴性。
1.3.8 VP模拟样品检测
用均质带分别称取25g对虾、带鱼、三文鱼、鱿鱼,分别加入1mL已调好浓度的3.6×102CFU/mL VP ATCC 33847菌悬液,每份样品加入225mL碱性蛋白冻水,用拍打器拍打2min,37℃培养10h。从样品液面分别吸取1mL增菌液提取DNA,按照VP荧光PCR反应体系和反应参数进行荧光PCR扩增。另一部分按照GB 4789.7—2008《食品卫生微生物学检验:副溶血性弧菌检验》进行检测。
2 结果与分析
2.1 VP双重荧光PCR特异性实验
以VP的toxR基因与tdh基因为目的基因,按VP双重荧光PCR反应体系进行PCR扩增,不同探针颜色在仪器上可以选择,选择FAM探针会出现该探针标记的曲线,选择all时会出现所有探针的曲线。VP ATCC 33847、VP1、VP2、VP3,4株菌株分别扩增出指数期明显的toxR与tdh基因扩增曲线,而溶藻弧菌、单增李斯特菌等31株菌株扩增结果呈阴性(图1)。常规双重PCR结果,VPATCC 33847、VP1、VP2、VP3均出现与预期相符的扩增片段(图2),表明上述4株VP均有toxR和tdh目的基因,结果与荧光PCR结果相同。广东地区分离的21株VP和辽宁地区分离的16株VP荧光PCR结果中,只有toxR扩增曲线指数期明显,Ct值在10~20之间,而tdh扩增结果呈阴性,提示广东地区和辽宁地区食品中分离的37株VP均未携带tdh基因(图3、4)。
2.2 VP敏感性实验
VP菌液浓度与toxR、tdh两个基因Ct值之间有较好的线性关系(图5),toxR和tdh的R2分别为0.999、0.997,菌液浓度y(CFU/mL)与Ct值x之间的反向线性关系表达式分别为y=-4.04x+44.04、y=-4.01x+43.67。
2.3 模拟样品检测
模拟样品荧光PCR检测结果,4份样品均出现toxR与tdh扩增曲线,按照GB 4789.7—2008的4份样品也分别分离鉴定出VP,结果与荧光PCR方法一致。
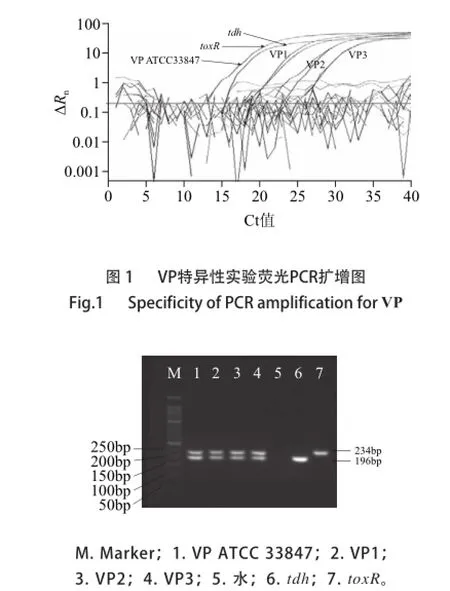
图2 VP普通双重PCR电泳图Fig.2 Electrophoresis of duplex PCR products from VP

图3 广东地区21株VP分离株荧光PCR扩增图Fig.3 PCR amplification of 21 wild VP strains from Guangdong area
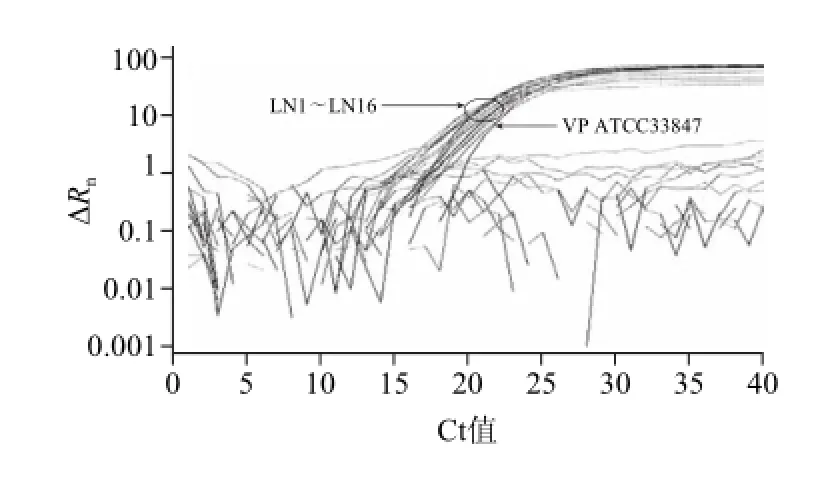
图4 辽宁地区16株VP分离株荧光PCR扩增图Fig.4 PCR amplification of 16 wild VP strains from Liaoning area
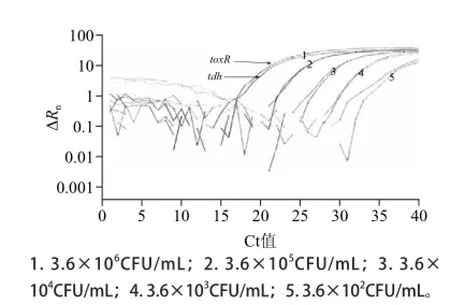
图5 VP双重荧光PCR敏感性实验扩增图Fig.5 Sensitivity of duaplex PCR amplification for VP
3 讨 论
副溶血弧菌是一种引起食源性疾病的重要病原,在近年来沿海地区的食物中毒病例中,该菌已成为首要病原[10-11]。副溶血性弧菌的致病机理复杂且多样化,不含毒力因子的菌株不一定致病,而传统的培养鉴定法短时间内无法确定该菌的毒力强弱,还需继续增加其他特殊的生化等鉴定实验,这无疑使鉴定周期更加漫长[12]。因此,研究一种快速检测VP的同时也能获得其毒力基因分布等多重信息的检测方法具有重要意义。本研究以toxR基因和毒性基因tdh基因为目的基因,分别设计引物和TaqMan探针,反复优化反应体系建立基于TaqMan探针的双重荧光PCR检测VP同时检测其毒力基因的方法。用toxR基因扩增特异性检测VP,tdh基因扩增检测VP是否携带tdh基因,在一次扩增反应不仅能特异性检测VP,而且可从基因水平判断其致病性及毒力强弱,达到简便、快速、准确可靠的目的。
多重荧光PCR是单重荧光PCR技术基础上发展的技术,需在反应体系中添加多对引物和探针,而且要优化引物浓度、模板浓度、退火温度、延伸时间、循环次数等诸多复杂因素。其中,引物和探针设计是一个关键环节,如能在引物设计这一关键环节避免非特异扩增反应的发生,就有可能显著提高实验效率[13-15]。本研究在设计引物和TaqMan探针时,为了引物和探针的特异性以及两对引物和探针之间互不干扰,用NCBI上的BLAST功能反复比对、筛选设计的引物和探针,通过DNAStar软件分析确认两对引物、探针之间不形成二聚体,而且尽量使两对引物之间和两个TaqMan探针之间的Tm值尽量接近(表1),以上措施保证了扩增产物的特异性及同时扩增目的片段。值得一提的是,相同浓度的荧光PCR反应体系中,VP ATCC 33847、VP1、VP2、VP3,4株菌株tdh的扩增曲线均滞后于toxR出现,即tdh的Ct值始终大于toxR的Ct值,在VP基因组中toxR基因的拷贝数是否高于tdh的拷贝数有待进一步研究。37株VP分离株检测结果表明,所有菌株只扩增出toxR基因,而tdh基因扩增结果呈阴性,表明广东地区和辽宁地区进出口食品中VP分离株未携带tdh基因。日本学者研究来自海产品及海水的VPtdh基因的携带率仅1%[16],ISO/TS 21872-1—2007中也提示环境中分离的VP tdh携带率在1%左右[17]。本研究VP分离株tdh携带率为0%,结果低于上述统计结果,这可能与本研究用VP菌株来源和分离年代不同、菌株数量较少等原因有关。
副溶血性弧菌是好氧菌,样品在增菌液中培养时,离液面越近越混浊,大多数情况下还形成菌膜。因此,取增菌液提取DNA时,尽量取增菌液的表面,可增加VP的菌量又可以稀释样品中对荧光PCR产生干扰的成分,提高扩增反应的灵敏度[18]。本研究模拟样品检测结果,荧光PCR方法与传统检测方法一致,但在检测周期上传统方法需要培养、划线分离、生化鉴定、神奈川试验等,需要4~5d,而荧光PCR方法,增菌10h、核酸提取和荧光PCR反应3~4h,整个实验可在13~14h完成,简便快捷。
[1] 朱雪兰, 陈艳. 副溶血性弧菌溶血素基因及其检测的研究进展[J].国外医学: 卫生学分册, 2007, 34(4): 233-237.
[2] 叶盛, 樊学军, 裴晓方, 等. TaqMan实时荧光PCR快速检测副溶血性弧菌[J]. 现代预防医学, 2008, 35(22): 4444-4449.
[3] BAIRD D D, NEWBOLD R. Prenatal diethylstilbestrol (DES) exposure is associated with uterine leiomyoma development[J]. Reprod-Toxicol, 2005, 20(1): 81-84.
[4] ALAM M J, TOMOCHIKA K, MIYOSHI S, et al. Environmental investigation of potentially pathogenic Vibrio parahaemolyticus in the Seto-Is-landsea, Japan[J]. FEMS Microbiolet, 2002, 208(1): 83-87.
[5] PALMER J R, WISE L A, HATCH E E, et al. Prenatal diethylstilbestrol exposure and risk of breast cancer[J]. Cancer Epidemiol Biomarkers Prev, 2006, 15(8): 1509-1514.
[6] 覃倚莹, 吴晖, 肖性龙, 等. toxR基因作为荧光定量PCR靶基因设计TaqMan探针快速检测副溶血弧菌[J]. 生物工程学报, 2008, 24(10): 1837-1842.
[7] ROBERT-PILLOT A, GUENOLE A, FOURNIER J M. Usefulness of R72H PCR assay for differentiation between Vibrio parahaemolyticus and Vibrio alginolyticus species: validation by DNA-DNA hybridization[J]. FEMS Microbiol Lett, 2002, 215(1): 1-61.
[8] 杨梅, 蒋立新, 邓凯杰, 等. 副溶血性弧菌的污染状况和分子检测方法研究进展[J]. 职业与健康, 2010, 26(3): 333-335.
[9] CROCI L, SUFFREDINI E, COZZI L, et al. Evaluation of different polymerase chain reaction methods for the identification of Vibrio parahaemolyticus strains isolated by culturalmethods[J]. JAOAC Int, 2007, 90(6): 1588-1597.
[10] JOSEPH S W, COLWELL R R, KAPER J B, et al. Vibrio parahaemolyticus and related Hallophilic vibrios[J]. Crit Rev Microbiol, 1982, 10(1): 77-124.
[11] 程苏云, 罗芸, 叶菊莲, 等. 副溶血性弧菌快速检测方法研究[J]. 疾病监测, 2007, 22(9): 642-645.
[12] 李庆山. 副溶血性弧菌所致食物中毒的研究进展[J]. 中国卫生检验杂志, 2009, 19(2): 461-463.
[13] 王稳, 屈武斌, 申志勇, 等. 利用MPprimer设计引物并优化扩增条件以提高多重PCR效率的实验研究[J]. 生物化学与生物物理进展, 2010, 37(3): 342-346.
[14] 石晓路, 扈庆华, 张佳峰, 等. 多重实时PCR快速同时检测沙门菌和志贺菌[J]. 中华流行病学杂志, 2006, 27(12): 1053-1056.
[15] 徐德顺, 韩建康, 吴晓芳, 等. 多重荧光逆转录PCR同时检测肠道病毒71型和柯萨奇病毒A16型[J]. 中国预防医学杂志, 2010, 11(9): 878-881.
[16] COOK D W, BOWERS J C, DEPAOLA A, et al. Density of total and pathogenic Vibrio parahaemolyticus in Atlantic and Gulf Coast molluscan shellfish at harvest[J]. J Food Prot, 2002, 65(12): 1873-1880.
[17] ISO/TS 21872-1-2007 Microbiology of food and animal feeding stuffs-Horizontal method for the detection of potentially enteropathogenic Vibrio spp. Part 1: Detection of Vibrio parahaemolyticus and Vibrio cholera[S].
[18] 许龙岩, 周宏斌, 高东微, 等. MPCR检测食品中霍乱弧菌和副溶血性弧菌的研究[J]. 卫生研究, 2005, 34(1): 115-118.
Detection of Vibrio parahaemolyticus Using Duplex Fluorescence Real-Time PCR with TaqMan Probe
XU Long-yan1,YUAN Mu-yun1,CAO Ji-juan2,LING Li1
(1. Guangdong Entry-Exit Inspection and Quarantine Bureau, Guangzhou 510623, China;2. Liaoning Entry-Exit Inspection and Quarantine Bureau, Dalian 116001, China)
Objective: To establish a specific method for the detection of Vibrio parahaemolyticus (VP) and its virulence gene. Methods: Based on the sequences of toxR (transmembrane transcription activator) and tdh (thermostable direct hemolysin) genes from VP, specific primers and TaqMan probes were designed and a duplex fluorenscencet real-time PCR amplification system was established. The specificity and sensitivity of this method were evaluated. Moreover, the distribution of virulence gene in import and export foods from Guangdong and Liaoning provinces was investigated by this method. Results: The specificity tests showed that both toxR and tdh genes were amplified through the DNAs of standard strain, ATCC33847, and 3 wild strains isolated from food-poisoning patients. However, no specific amplification curves were observed for 31 other strains tested, including Vibrio alginolyticus and L. monocytogenes both from the genus Vibrio and Enterobacteriaceae. The sensitivity results demonstrated an inverse linear relationship between VP concentration and Ct values. The linear coefficients (R2) for toxR and tdh were 0.999 and 0.997 with an identical LOD of 3.6 × 102CFU/mL, respectively. Furthermore, the detection results revealed that toxR gene of all 37 foodborne VP wild strains in this study were positive for toxR gene, but all of them were negative for tdh gene, indicating that the genomes of 37 wild strains contained toxR gene, but did not contain tdh virulence gene. Conclusion: A rapid, sensitive and specific method suitable for the simultaneous detection of species and virulences specific genes of VP in foods has been established in this study.
Vibrio parahaemolyticus;toxR gene;tdh gene;TaqMan based probe;duplex fluorescence real-time PCR;detection
Q939.93
A
1002-6630(2013)18-0263-04
10.7506/spkx1002-6630-201318054
2012-10-15
许龙岩(1970—),男,高级工程师,硕士,研究方向为食品微生物分子检测。E-mail:xlyooo@sohu.com

