GFP标记Lewis肺癌细胞3LL颈内动脉注射建立脑转移癌动物模型的可行性研究*
徐 磊,周 伟,刘 科
(重庆市急救医疗中心神经外科 400014)
肺癌是当今世界上对人类健康和生命威胁最大的恶性疾病之一,肺癌脑转移(lung cancer brain metastasis)是肺癌患者主要的死亡原因,也是肺癌治疗失败的常见原因之一,肺癌脑转移的主要途径是通过血运转移。血运性脑转移癌的发病率较高、临床预后极差,影响因素错综复杂。本研究使用稳定转染表达绿色荧光蛋白(green fluorescent protein,GFP)的Lewis肺癌细胞系3LL通过颈内动脉注射入C57BL/6小鼠脑部,建立血运性脑转移癌模型,观察肺癌脑转移的生物学特性。
1 材料与方法
1.1 材料
1.1.1 动物 C57BL/6小鼠16只,雌雄各8只,4月龄,雄性体质量(35±1)g,雌性体质量(30±1)g,购自上海斯莱克实验动物有限责任公司。
1.1.2 细胞株 Lewis lung cancer cell line 3LL细胞购自A-merican Type of Cell Culture (ATCC,Cat.CRL1642),与C57BL/6小鼠有相同遗传背景。
1.1.3 试剂 pGPU6-GFP-Neo siRNA质粒来自GenePharma。Lippo2000来自Invitrogen。高糖DMEM培养基购自Sigma公司、胎牛血清(FBS)购自杭州四季青生物工程公司;一抗羊多聚抗中间丝蛋白(glial fibrillary acidic protein,GFAP)来自Santa Cruz,二抗HRP多聚抗羊来自Sigma-Aldrich。牛血清清蛋白来自盐城赛宝生物科技有限公司。DAB来自DAKO公司。
1.1.4 特殊手术器械 BD Micro-Fine 31Gx5mm胰岛素注射针头。自制注射器。Hugo Sachs Elektronik微血管夹(Micro Vascular Clips)购自东乐自然基因生命科学公司。
1.1.5 设备 奥林巴斯BX41光学显微镜。
1.2 方法
1.2.1 GFP转染建立稳定转染的细胞系 使用Invitrogen公司Lippo2000标准程序将pGPU6-GFP-Neo siRNA vector转染进Lewis肺癌细胞系3LL,用1 000μg/mL G418筛选1周后,改用500μg/mL浓度维持筛选压力,生长至6个10cm培养皿细胞满90%时用流式细胞仪筛选出GFP表达强阳性的10%细胞,如此筛选重复3次,建立100%GFP强阳性的稳定转染细胞系。为了保证尽可能多的细胞基因型存在,避免单克隆株筛选法筛选到不具备致病力的细胞,不采用挑选单克隆株的办法。如图1。

图1 100%稳定转染GFP的Lewis肺癌3LL细胞系(×200)
1.2.2 颈内动脉注射Lewis 3LL肺癌细胞建立肺癌脑转移动物模型及分组 采用的颈内动脉注射法系Schackert和Fidl改良法[1],C57BL/6小鼠腹腔注射氯胺酮(5mg/kg)/甲苯噻嗪(50mg/kg)的混合物以麻醉,麻醉后放置在解剖显微镜下的塑料板上。用橡皮筋放置在门齿之间固定小鼠头部。颈部备皮、消毒后。做2cm长正中切口,暴露气管,分离胸锁乳突肌及肩胛舌骨肌暴露颈动脉鞘,游离颈动脉,近心端和远心端各放置1枚微血管夹。闭合近心端微血管夹,用BD 31G针头轻轻挑破颈动脉,插入自制注射器至颈内动脉。将100 000细胞/20μL Lewis 3LL肺癌细胞缓慢注入20μL,再缓慢追加20 μL PBS。穿刺点远端上微血管夹,取出注射器,10-0强生公司prolene缝线缝合血管穿刺口,取出微血管夹,轻压颈动脉穿刺点1~3min以止血,缝合皮肤。术毕使用荧光影像系统检测带绿色荧光蛋白的3LL细胞注射入脑成功。麻醉复苏后次日,从存活的15只小鼠中随机选择雌雄各6只,用荧光影像系统检测后随机按雌雄各分为2组,每组3只:雄性2组编号分别为M1、M2,雌性2组编号分别为F1、F2。
1.2.3 记录 接种完成后,每天早、晚2次观察手术部位有无感染,每日称量小鼠体质量并记录,绘制曲线,观察小鼠有无毛发混乱、弓背、行走不稳等症状出现,选用全身严重衰竭、行走不稳、呼吸短促、体质量下降30%以上作为处死标准。记录小鼠处死时间。
1.2.4 收集脑组织和病理染色
1.2.4.1 小鼠多聚甲醛灌注固定 小鼠腹腔注射氯胺酮(50 mg/kg)/甲苯噻嗪(5mg/kg)的混合物深度麻醉平稳后,在解剖显微镜下剪开胸腔,暴露心脏。吊瓶里装入预冷PBS,将输液套筒针刺入左心室(心尖处),打开输液开关,快速灌注。同时在右心房剪一小口,使血液和灌洗液可以排出。灌入约50 mL生理盐水后,观察从右心房流出的液体已经变成无色透明,说明血液已经冲洗干净。换1个装有过滤后预冷过的4%多聚甲醛的吊瓶继续输液。当多聚甲醛输入体内时,小鼠会剧烈抽搐。待抽搐停止后,再持续输注4%多聚甲醛5min(每只小鼠量共约100mL),多聚甲醛即可将小鼠体内各脏器充分固定,牵拉四肢有僵硬感。此时已经固定完毕,可以取出脑组织。
1.2.4.2 病理和免疫组织化学染色鉴定 收集脑组织,更换4%多聚甲醛3次并用70%乙醇溶液漂洗3次后,脱水、固定、包埋、切片、烘干。染色时二甲苯脱蜡后梯度乙醇水化。(1)直接H&E染色封片;(2)浸泡在枸橼酸抗原修复液中加热做抗原修复,PBS漂洗后1%过氧化氢-50%甲醇溶液封闭内源性过氧化物酶,PBS漂洗后5%牛血清清蛋白溶液封闭20min,加1∶500稀释的一抗羊多聚抗GFAP 4℃孵育过夜,PBS漂洗后加1∶200稀释的二抗HRP抗羊孵育30min,PBS漂洗后镜下观察控制DAB染色时间,及时PBS漂洗,漂洗终止染色,H&E染色封片。
1.3 统计学处理 采用SPSS12.0统计学软件进行统计学分析。各实验均重复3次,计量数据用±s表示,多组间的比较采用单因素χ2分析,组间数据比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 体质量观察 见表1。

表1 颈内动脉注射GFP(+)3LL细胞后C57BL/6小鼠体质量观察(g)
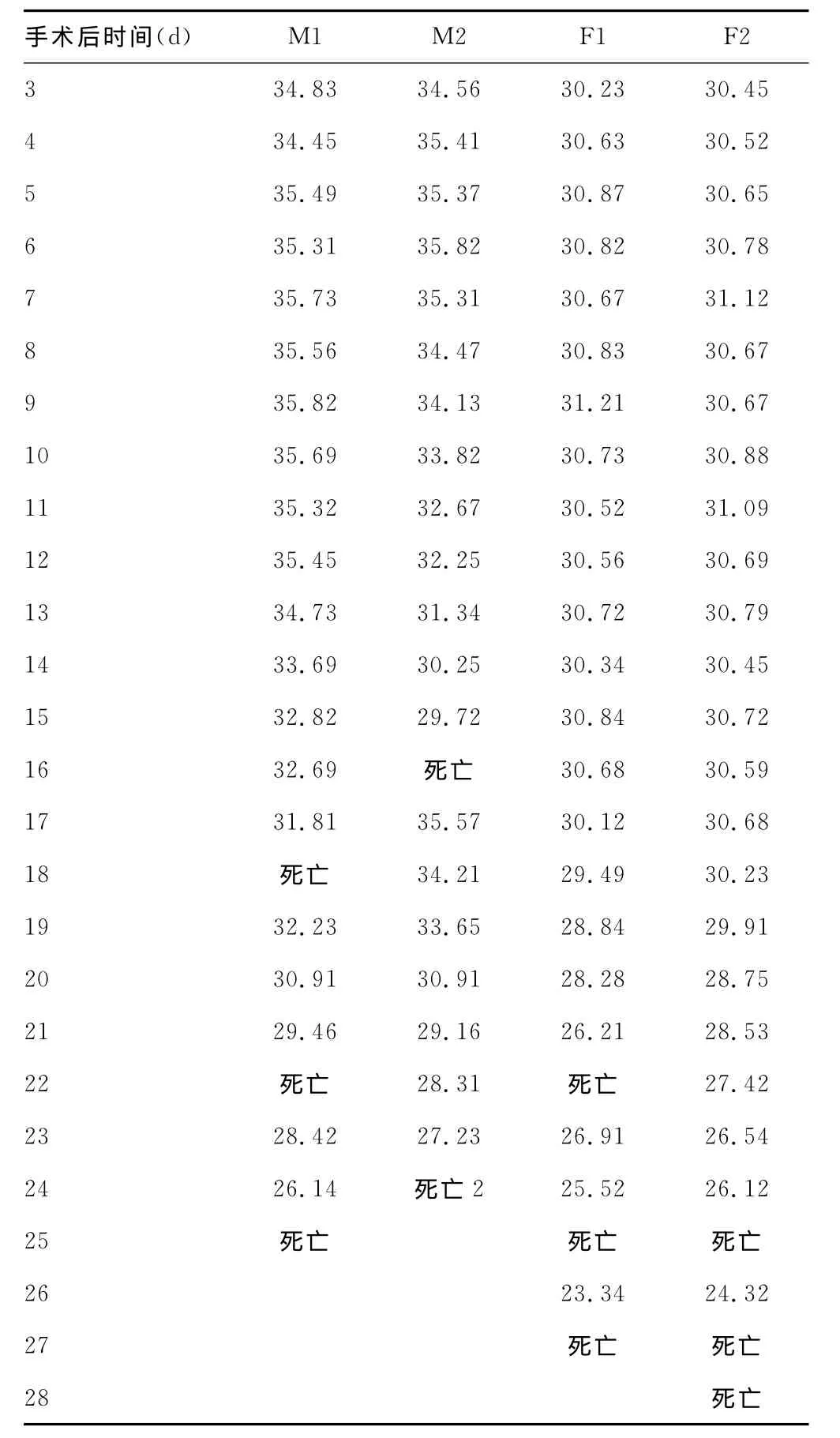
续表1 颈内动脉注射GFP(+)3LL细胞后C57BL/6小鼠体质量观察(g)
2.2 存活时间 见表2、图2。
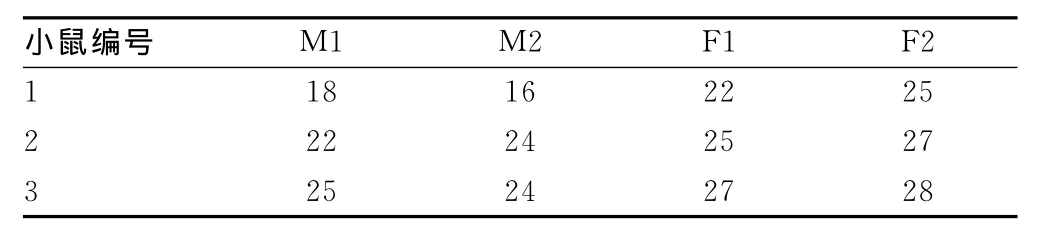
表2 颈内动脉注射GFP(+)3LL细胞后小鼠生存时间(d)

图2 颈内动脉注射3LL细胞后小鼠生存时间
2.3 脑组织荧光显微镜观察 见图3。

图3 稳定转染后GFP(+)的3LL细胞注射3周后鼠脑(×20)
2.4 病理染色 见图4~5。
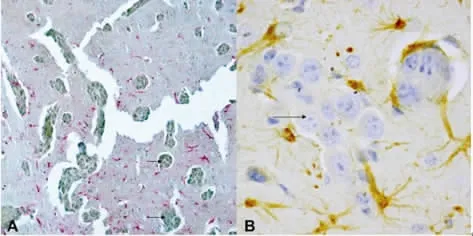
图4 颈内动脉注射3周后脑内多发转移性肿瘤
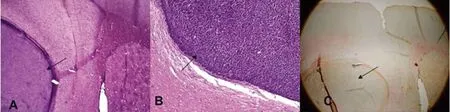
图5 颈内动脉注射4周后脑内融合的转移性肿瘤
3 讨 论
3.1 肺癌脑转移是最常见的颅内转移的恶性肿瘤,患者的中位生存时间仅为2~3个月,即使积极手术切除、放疗、化疗,也仅仅只能延长它的中位生存期至6~8个月[2]。肺癌脑转移是临床上肺癌患者病情发展或晚期的表现,是肺癌患者死亡的主要原因,也是治疗肺癌失败的常见原因之一,无论是否手术切除原发病灶,有50%~60%的肺癌患者最终会发生脑转移[3]。随着CT、MRI、PET、SPECT等各种影像学检查手段的不断进步[4],肺癌脑转移的早期检出率大大提高,手术疗效得到判断[5-6],患者的预后得到改善,生存时间得到延长。但由于患者往往伴有因脑转移灶占位以及瘤周脑组织水肿严重导致高颅压所引起的剧烈头痛、呕吐、肢体偏瘫、语言功能障碍、智力智能减退等神经功能障碍症状,生活质量极差。
3.2 肺癌脑转移的机制目前尚不明确,目前公认的肺癌脑转移的主要途径是通过血运。肺癌细胞生长快速、癌细胞之间缝隙连接松散使细胞容易脱落,癌细胞易脱落后移行进入肺组织丰富的血管中,随血液经肺静脉进入体循环,随颈动脉或椎-基底动脉上行到达脑组织后停留、聚集、黏附在终末血管床,增殖、脑血管内皮包裹生长、跨内皮迁移穿透血脑屏障(bloodbrain barrier,BBB)[7],形成转移灶。要研究“转移”,最可行的方法就是体外肿瘤细胞培养加体内实验——建立肿瘤转移的实验动物模型。目前,建立脑转移癌动物模型的方法主要有4种:(1)脑内局部原位注射;(2)皮下注射;(3)尾静脉注射;(4)颈内动脉注射。其中脑内原位注射建模成功率高,但一般只有单发肿瘤,且不能模拟肿瘤细胞自血管内生长移行透过血脑屏障的过程;皮下注射一般只产生局部肿块,仅少数发生远处转移,往往需要在实验动物体内反复传代才可能有很低的概率诱发脑转移;尾静脉注射后发生脑以外的肺部、骨等其他部位转移的概率高,建立脑转移癌模型的成功率低。本研究体内实验中系使用100%稳定转染GFP的Lewis 3LL肺癌细胞细胞经颈内动脉注射直接入脑建立小鼠脑转移癌模型的方法。收集的注射3周以后脑组织标本在荧光显微镜下观察有绿色荧光蛋白的富集区域,证实有稳定转染GFP的Lewis 3LL肺癌细胞增殖、生长形成肿瘤。免疫组织化学染色见细胞核膜增厚,核大小、形状、染色不一,核分裂像增多,核仁肥大数目增多,有双核、多核、巨核及奇异形核,核内染色加深,染色质呈粗颗粒状,分布不均匀,为恶性肿瘤的病理组织学特征。病灶周围有激活的反应性星型胶质细胞增生,符合脑内恶性肿瘤的生物学特性——就像一个永不愈合的伤口,起到与创伤性损伤类似的作用,导致反应性星型胶质细胞的增生[8-11],而与此同时反应性星型胶质细胞又反过来保护肿瘤细胞继续生长[12-13]。证明这一模型能真实地模拟肺癌血运型转移的过程和结果。
本实验中采用的颈内动脉注射法直接模拟癌细胞在脑部的终末毛细血管床内聚集、黏附、侵袭穿透血脑屏障、增殖和在脑血管内皮包裹之下生长、跨内皮迁移穿透BBB形成转移灶,长出新生微血管的真实过程。颈内动脉注射显微手术技术简单、手术技巧要求低,成功率高,本例手术存活率93.75%。使用的Lewis肺癌细胞与C57BL/6小鼠具有相同遗传背景,建模成功率高,手术成功的小鼠术后100%发生脑转移癌。未作特殊药物处理的自然病程的小鼠中位数生存时间仅为24.5d,实验周期短,节约资金和人力成本。是一种经济有效的建立脑转移癌动物模型的方法。
3.3 颈内动脉注射手术技巧。术中钝性分离胸锁乳突肌及肩胛舌骨肌以暴露颈动脉鞘,暴露困难时可剪断肩胛舌骨肌。解剖游离出颈动脉时注意不要过度牵拉或损伤迷走神经以及颈动脉鞘下方的颈交感干。上微血管夹时避开颈动脉分叉处、迷走神经以及颈交感干。手术中小鼠死亡1只,手术死亡率为6.25%。考虑系牵拉迷走神经导致心跳呼吸骤停,注射成功后10-0强生公司prolene缝线缝合血管穿刺口,轻压颈动脉穿刺点1~3min均即可以可靠止血。
[1]Schackert G,Fidler IJ.Development of in vivo models for studies of brain metastasis[J].Int J Cancer,1988,41(5):589-594.
[2]Kaal EC,Niël CG,Vecht CJ,et al.Therapeutic management of brain metastasis[J].Lancet Neurol,2005,4(2):289-298.
[3]Santarelli JG,Sarkissian V,Hou LC,et al.Molecular events of brain metastasis[J].Neurosurg Focus,2007,22(3):352-354.
[4]Hoshikawa H,Kishino T,Mori T,et al.The value of 18FFLT PET for detecting second primary cancers and distant metastases in head and neck cancer patients[J].Clin Nucl Med,2013,28(1):68-71.
[5]Yi CA,Lee KS,Lee HY,et al.Coregistered whole body magnetic resonance imaging-positron emission tomography(MRI-PET)versus PET-computed tomography plus brain MRI in staging resectable lung cancer:Comparisons of clinical effectiveness in a randomized trial[J].Cancer,2013,10(2):235-237.
[6]Schackert G.Surgery of brain metastases-pro and contra[J].Onkologie,2002,25(5):480-481.
[7]Wilhelm I,Molnár J,Fazakas C,et al.Role of the bloodbrain barrier in the formation of brain metastases[J].Int J Mol Sci,2013,14(1):138-141.
[8]Escalone Zapata J.Astrocytes in brain tumours,Differentiation or trapping?[J].Histol Histopathol,1994,9(2):325-328.
[9]Zhang M,Olsson Y.Reactions of astrocytes and microglial cells around hematogenousmetastases of the human brain.Expression of endothelin-like immunoreactivity in reactive astrocytes and activation of microglial cells[J].J Neurol Sci,1995,134(1):26-32.
[10]Escartin C,Bonvento G.Targeted activation of astrocytes:a potential neuroprotective strategy[J].Mol Neurobiol,2008,38(3):231-241.
[11]Ridet JL,Malhotra SK,PrivatA.Reactive astrocytes:cellular and molecular cues to biological function[J].Trends Neurosci,1997,20(5):570-577.
[12]Kim SJ,Kim JS,Park ES,et al.Astrocytes upregulate survival genes in tumor cells and induce protection from chemotherapy[J].Neoplasia,2011,13(3):286-298.
[13]Lin Q,Balasubramanian K,Fan D,et al.Reactive astrocytes protect melanoma cells from chemotherapy by sequestering intracellular calcium through gap junction communication channels[J].Neoplasia,2010,12(9):748-754.
- 重庆医学的其它文章
- 乌司他丁对机械通气患者红细胞免疫功能保护效果的临床分析*

