G蛋白偶联受体激酶4突变A142V基因对大鼠血管平滑肌细胞AT1受体的影响*
邓 昆,刘 莉,陈彩宇,陈 垦,王 微,周永巧,何多芬,曾春雨△
(1.第三军医大学大坪医院野战外科研究所心血管内科/重庆心血管病研究所,重庆400042;2.77263部队医院,云南大理671000)
原发性高血压(esesntalihypertension,EH)是冠心病、糖尿病肾病以及脑梗死等的重要危险因素。EH的发生和遗传因素密切相关,与EH基因连锁的G蛋白偶联受体激酶4(GRK4)也因此受到越来越多的关注。GRK4是GRKs的一种,在GRKs的几个亚型中,只有GRK4的改变先于高血压的发生而发生[1-2],其变异体A142V和EH的发生密切相关[3]。肾素血管紧张素(RAS)系统激活参与动脉粥样硬化的形成,血管紧张素Ⅱ(AngⅡ)是整个RAS系统最重要的因子之一,血管紧张素Ⅱ1型(AT1)受体是AngⅡ的主要作用受体,其介导的血管平滑肌细胞(VMSCs)增殖是动脉粥样硬化、术后血管再狭窄共同的病理基础[4]。既往的研究发现转染GRK4γA142V基因的小鼠GRK4升高的同时血压明显升高[1],Yatabe等[5]发现在肾脏组织 AT1受体伴随 GRK4的改变而发生改变,本实验室以往研究发现人和大鼠的血管上有GRK4的表达,作者推测血管组织GRK4对AT1受体也有重要的调控作用。因此,本研究以转染hGRK4γWT和hGRK4γA142V的A10细胞为研究对象,检测这两种细胞中AT1受体的改变和细胞增殖的变化,以探索hGRK4γA142V如何影响RAS系统而引起VSMCs异常增殖导致EH的发生。
1 材料与方法
1.1 材料 大鼠胸主动脉平滑肌细胞株(A10),hGRK4γWT和hGRK4γA142V质粒由美国马里兰大学Dr Pedro A Jose实验室惠赠,DMEM高糖型培养基,FBS胎牛血清购自美国GIBCO公司;AngⅡ购自美国Sigma公司;GRK4活性测定试剂盒购自上海杰美公司;兔抗AT1R、兔抗β-actin一抗购自美国Santa Cruz公司;磷酸化苏氨酸抗体购自美国cell signaling technology公司;[3H]胸腺嘧啶试剂盒购自北京原子能研究所。
1.2 方法
1.2.1 慢病毒载体的构建、病毒的生产包装及转染 将hGRK4γWT质粒、hGRK4γA142V质粒和绿色荧光蛋白(EGFP)基因克隆至慢病毒表达载体,利用lipofectamineTM2000脂质体转染试剂将慢病毒包装质粒混合物与包含hGRK4γWT、hGRK4γA142V的表达载体共转染至病毒生产细胞系293TN,48h后收集上清液,使用0.45μm滤膜过滤上清液,由此包装、生产出携带GRK4γWT、GRK4γA142V基因的重组慢病毒 (Lv-GRK4γWT-EGFP 和 Lv-GRK4γA142V-EGFP),收集上清液,以MOI值为10感染A10细胞。
1.2.2 荧光共聚焦显微镜下观察EGFP表达 hGRK4γWT和hGRK4γA142V细胞均匀接种于6孔培养板中(内置盖玻片),置37℃5%CO2培养箱中培养至第3天,4%多聚甲醛固定30min,PBS洗涤3次,取细胞爬片置荧光共聚焦显微镜下观察。
1.2.3 免疫印迹检测AT1受体 常规方法提取细胞总蛋白,采用考马斯亮蓝法测定蛋白质浓度。将50μg变性好的蛋白进行SDS-PAGE电泳,利用半干转移法将蛋白转移至硝酸纤维素膜,封闭1h,与GRK4抗体,AT1受体抗体(1∶400)4℃孵育过夜,TBST洗涤3次×10min,羊抗兔IgG(1∶5 000)室温孵育1h,TBST洗涤3次×10min,利用增敏化学发光法,经X线片曝光、显影、定影。结果经光密度面积分析,与内参照β-actin产物条带的比值作为相对浓度。
1.2.4 分光光度法检测GRK4活性 提取细胞总蛋白,采用考马斯亮蓝法测定蛋白浓度。65μL缓冲液,10μL酶促液,10 μL反应液,10μL底物液于30℃培养箱里静置3min,加入50 μg蛋白,阴性对照加入5μL阴性液作为背景对照,用分光光度法测定,以每微克总蛋白中GRK4每分钟NADH转化为NAD的量表示。
1.2.5 [3H]胸腺嘧啶的掺入试验将hGRK4γWT 和hGRK4γA142V细胞制成单细胞悬液,计数后将细胞浓度调整为3×104个/mL,按1mL/孔接种于24孔培养板,置37℃、5%CO2培养箱中培养48h,然后换等量的无血清培养液培养2h,然后向每孔中加入[3H]胸腺嘧啶0.3mCi继续培养6h,吸去含游离[3H]胸腺嘧啶的培养液,用0.25%胰酶消化细胞,真空抽滤法将细胞收集于玻璃纤维滤膜,依次用PBS、10%三氯乙酸及无水乙醇冲洗,抽干后于80℃、30min烤干,置液闪杯中,加入5mL液体闪烁液,静置平衡过夜,在液闪仪上计数每分钟的值,以3×104细胞表示[3H]胸腺嘧啶的掺入率[4,6]。
1.3 统计学处理 采用SPSS15.0软件分析。计量资料以±s表示,两组间采用t检验,两组以上的比较采用ANOVA法进行统计分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 hGRK4γWT和hGRK4γA142V转基因细胞的建立及蛋白鉴定 构建了野生型GRK4wild-IRES2-EGFP表达载体和突变体GRK4A142V-IRES2-EGFP表达载体,慢病毒以MOI值为10感染A10细胞。荧光显微镜下观察,两种细胞均可见90%细胞细胞质内表达EGFP,呈绿色荧光,提示病毒成功转染细胞,携带基因的蛋白表达。见图1。
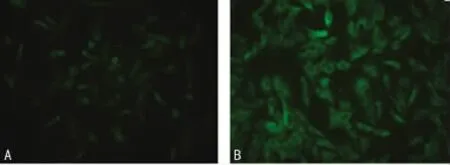
图1 荧光显微镜下观察转染细胞的绿色荧光(×200)
2.2 hGRK4γA142V转基因细胞GRK4活性的改变 结果显示,hGRK4γA142V细胞的GRK4酶活性显著升高。见图2。
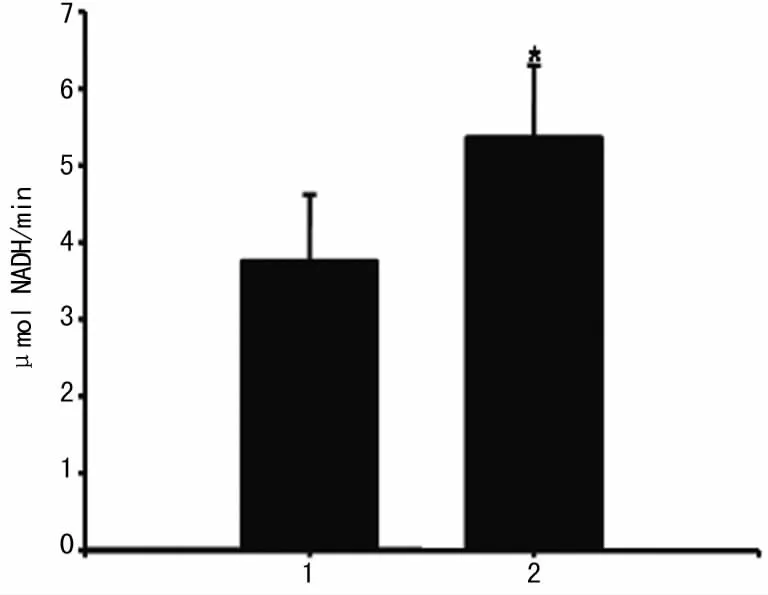
图2 hGRK4γA142V转染A10细胞GRK4活性的改变
2.3 hGRK4γA142V转基因细胞AT1受体的改变 免疫印迹显示A10细胞转染hGRK4γA142V基因后,AT1受体表达显著升高。见图3。

图3 hGRK4γA142V转染A10细胞AT1受体表达的改变
2.4 hGRK4γA142V转基因细胞GRK4和AT1受体共连接的改变 免疫沉淀显示,GRK4和AT1受体间存在共连接作用,hGRK4γA142V转基因细胞GRK4和AT1受体的共连接作用明显减弱,这种共连接的改变可能参与了GRK4对AT1受体的调节作用。见图4。
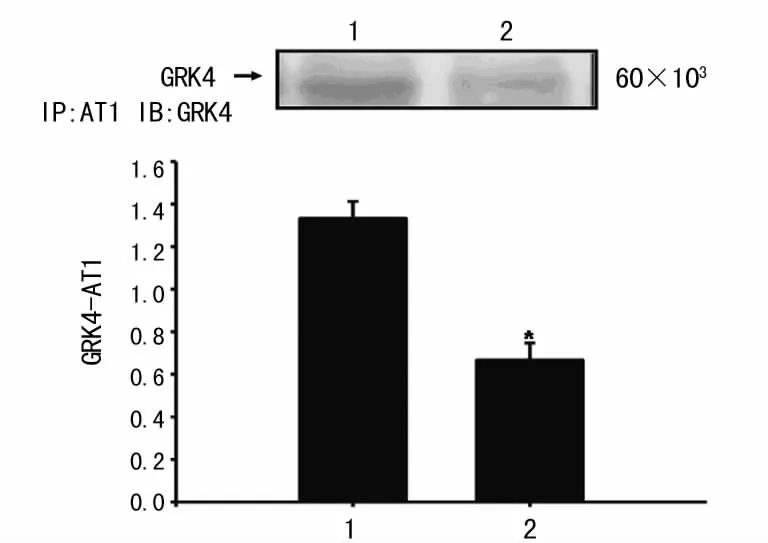
图4 hGRK4γA142V转基因细胞GRK4和AT1共连接的改变
2.5 AngⅡ刺激转染hGRK4γA142V转基因细胞增殖效应的改变 采用[3H]胸腺嘧啶掺入法测定细胞增殖,结果显示AngⅡ刺激hGRK4γA142V细胞引起细胞增殖幅度明显高于刺激hGRK4γWT细胞,见图5。
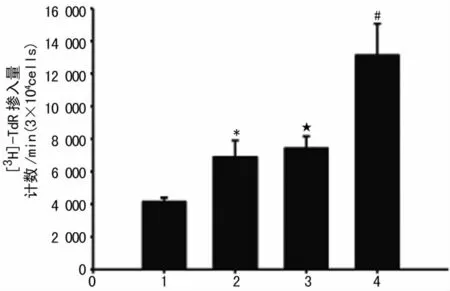
图5 AngⅡ刺激hGRK4γA142V转基因细胞引起增殖效应改变
3 讨 论
RAS在调节血管张力及钠水平衡方面发挥了重要作用。AngⅡ作为RAS系统中最主要的生物活性物质,其和AT1受体结合后介导了细胞增殖、肾近曲小管细胞尿钠转运,与AT2受体结合则发挥相反的作用。高血压状态下AT1受体的功能增加,其发生的原因目前尚不明了。GRKs是一种丝氨酸/苏氨酸激酶,共7个亚型,其主要生理功能是磷酸化GPCR,使GPCR介导的信号通路失敏,在这7个亚型中只有GRK4的改变先于高血压的发生。GRK4基因所在的染色体部位(4p16.3)与EH的发生关系密切,其基因变异体也和EH的发生密切相关[6]。人的 GRK4有α、β、γ、δ4种异构体,γ异构体的3个突变位点A142V、A486V、R65L可以引起GRK4活性升高和EH密切相关,所以γ亚基成为本研究关注的焦点[7]。Jose等[8]发现在3个突变体中只有A142V转基因小鼠在正常盐饮食的情况下可以发生高血压,他们还发现在携带A142V突变基因的日本高血压患者中,服用血管紧张素受体阻断剂(ARB),血压出现显著性降低,A142V转基因小鼠服用ARB后血压恢复正常。这提示GRK4γA142V突变引起的血压升高和RAS系统及AT1受体有密切联系。
既往研究发现人的GRK4存在于睾丸、肾脏和脑组织中[9],而本实验室首次发现VSMCs中有GRK4表达。在肾脏组织GRK4和AT1受体有密切关系,那么在血管组织中,GRK4是否也调节AT1受体的表达及其介导的平滑肌细胞增殖。本研究转染hGRK4γA142V到 A10细胞中,观察到GRK4活性显著升高,这种现象证实hGRK4γA142V可以使GRK4的活性增强。AT1受体作为GPCRs的一种,Zheng等[10]发现hGRK4γA142V转基因小鼠肾脏AT1受体表达升高,在血管中,GRK4是否具有相同的效应,本研究结果显示hGRK4γA142V细胞中AT1受体的表达显著升高。推测这种活性的增强引起的AT1受体表达的改变参与了高血压的发生、发展。作者还发现转染hGRK4γA142V可导致GRK4和AT1受体的共连接降低,推测GRK4和AT1受体的共连接程度减少导致GRK4和AT1受体偶联减少,而这种偶联的减少可能与AT1受体磷酸化的改变相关。
据以往报道,AT1受体具有自发活性,当AngⅡ刺激时AT1受体的活性明显增强[11-12],在血管中AT1受体介导的VSMCs的异常增殖是血管壁增厚和硬化的主要病理、生理基础[13]。本研究结果显示,AngⅡ刺激后转染hGRK4γA142V细胞的增殖效应明显高于转染hGRK4γWT细胞,在没有AngⅡ刺激的状态下转染hGRK4γA142V细胞的增殖效应仍然明显高于转染hGRK4γWT细胞。
综上所述,hGRK4γA142V通过影响的VSMCs AT1受体表达,从而影响AT1受体介导的VSMCs增殖,在心血管系统疾病的病理、生理过程中具有重要意义。
[1]Zeng C,Eisner GM,Felder RA,et al.Dopamine receptor and hypertension[J].Curr Med Chem Cardiovasc Hematol Agents,2005,3(1):69-77.
[2]Metaye T,Gibelin H,Perdris R,et al.Pathophysiological roles of G-protein-coupled receptor kinases[J].Cell Signalling,2005,17(8):917-928.
[3]Zeng CY,Wang Z,Yang ZW,et al.G protein kinase 4gamma A142Voverexpression induced hypertension by downregulating D1receptors in transgenic mice[J].Zhonghua Xin Xue Guan Bing Za Zhi,2006,34(5):411-414.
[4]Nishimura J,Bi D,Kanaide H.Dependence of proliferating differentiated vascular smooth muscle contraction on Rho-Rho kinase system[J].Trends Cardiovasc Med,2006,16(4):124-128.
[5]Yatabe J,Sanada H,Midorikawa S,et al.Effects of decreased renal cortical expression of G protein-coupled receptor kinase 4and angiotensin type 1receptors in rats[J].Hypertens Res,2008,31(7):1455-1464.
[6]Zeng C,Sanada H,Watanabe H,et al.Functional genomics of the dopaminergic system in hypertension[J].Physiol Genomics,2004,19(3):233-246.
[7]Premont RT,Macrae AD,Aparicio SA,et al.The GRK4 subfamily of G protein coupled receptor kinases:alternative splicing,gene organization and sequence conservation[J].J Biol Chem,1999,274(784):29381-29389.
[8]Jose PA,Soares-da-Silva P,Eisner GM,et al.Dopamine and G protein-coupled receptor kinase 4in the kidney:role in blood pressure regulation[J].Biochim Biophys Acta,2010,1802(12):1259-1267.
[9]Premont RT,Macrae AD,Stoffel RH,et al.Characterization of the G protein-coupled receptor kinase GRK4.Identification of four splice variants[J].J Biol Chem,1996,271(11):6403-6410.
[10]Zheng W,Ines A,Laureano DA,et al.The elevated blood pressure of human GRK4γA142Vtransgenic mice is not associated with increased ROS production[J].Am J Physiol Heart Circ Physiol,2007,292(5):H2083-H2092.
[11]Kai H,Griendling KK,Lassègue B,et al.Agonist-induced phosphorylation of the vascular type 1angiotensinⅡreceptor[J].Hypertension,1994,24(4):523-527.
[12]Miura S,Saku K,Karnik SS.Molecular analysis of the structure and function of the angiotensinⅡtype 1receptor[J].Hypertens Res,2003,26(12):937-943.
[13]Takemoto M,Egashira K.Vascular remodeling and angiotensin Ⅱ[J].Nihon Rinsho,1999,57(5):1158-1163.
