肝内周围型胆管细胞癌的CT及MRI诊断价值
雷友华,肖智博
(1.重庆市开县人民医院放射科 405400;2.重庆医科大学附属第一医院放射科 400016)
肝内周围型胆管细胞癌(intrahepatic peripheral cholangiocarcinoma,IHPCC)是指起源于Ⅱ级以上肝内胆管至赫令氏管的胆管上皮癌,属于原发性肝癌的一种少见组织学类型,恶性度高,起病隐匿,临床表现无特异性,临床误诊率较高,早期诊断和手术切除病灶对提高IHPCC患者的生存率至关重要。关于IHPCC的CT、MRI诊断研究文献报道也较多,但关于二者在诊断IHPCC的对比研究报道甚少。本文回顾性分析24例IHPCC患者的CT、MRI影像资料,旨在探讨多排螺旋CT及高场MRI对IHPCC的诊断和鉴别诊断价值及二者在诊断中的优势。
1 资料与方法
1.1 一般资料 收集2008年5月至2011年6月在重庆医科大学附属第一医院经手术或穿刺活检病理检查证实的IHPCC患者24例,其中男14例,女10例,年龄28~76岁,平均58.8岁。临床表现:右上腹胀痛13例,黄疸6例,畏寒发热3例,2例体检发现。既往有乙型肝炎病史2例,肝内胆管结石病史5例,胆管手术病史2例。实验室检查:甲胎蛋白检查阳性1例,糖类蛋白-199升高者3例。
1.2 方法
1.2.1 采用GE LightSpeed 64排螺旋CT机,全视野轴位螺旋式扫描。被检查者空腹,扫描前口服清水500~800mL;扫描范围自膈顶以上2cm至肾脏下缘,扫描层厚5mm,层间距5mm,重建层厚0.625mm。扫描条件为电压120Kv,电流340Am。平扫后肘前静脉注入60~80mL非离子造影剂优维显370,速率4mL/s;生理盐水40~80mL,速率4mL/s。应用Smart prep扫描方式,监测腹腔干发出水平腹主动脉,在腹主动脉阈值达到150Hu启动动脉期扫描,18s后启动门静脉期扫描,肝静脉期与门静脉期扫描时间间隔为60s,必要时180s后加扫延迟期。
1.2.2 采用GE Signa HD 3.0TMR系统,8通道相控阵体线圈。轴位T2WI采用呼吸触发快速自旋回波序列(fast spin echo,FSE),抑脂序列,层厚6~8mm,层间距1~2mm,TR/TE=6 600/86ms,NEX=2;冠位T2WI采用单次激发快速自旋回波序列(single-shot fast spin-echo,SS-FSE),TR/TE=2 080/70ms,NEX=0.54;轴位T1WI采用快速扰相梯度回波序列(fast spoiled gradient echo sequence,FSPGR)同/反相位,TR/TE=160~190ms,翻转角80,层厚5~6mm,层间距1 mm,NEX=0.69。扩散加权成像(diffusion-weighted imaging,DWI)采用回波平面(spin-echo echo planar imaging,SE-EPI)序列,扩散敏感系数b值为(0,800)s/mm2,TR/TE=5 700/61.9 ms;NEX=8,层厚5mm,层间距1mm。增强扫描对比剂为Gd-DTPA,注射剂量15mL,流速2mL/s,扫描序列选用肝脏容积加速采集(volume acceleration,LAVA)技术,以轴位为主,门静脉期后加扫冠状位。动脉期、门静脉期延迟扫描时间分别为20~25、60~70、180~300s。
1.3 图像分析及数据测量 扫描数据分别传送各自后处理工作站。(1)观测病灶部位、大小、形态、伴随征象,与周围组织血管关系;平扫及增强扫描密度/信号及其变化特征。(2)CT后处理工作站行多平面重建(multi-planar reformation,MPR)从不同角度显示肿瘤及其与周围组织血管之间关系。MRI后处理工作站主要测量病变区和正常肝实质区表观弥散系数(apparent diffusion coefficient,ADC):利用 ADW4.2图像处理工作站,选择同样大小感兴趣区(region of interest,ROI),将ROI置于病灶实质部分,于3个连续层面各取一个ROI,记录ADC值,取其平均值。再以同样大小ROI在上述三个同层面测量正常肝实质ADC值,取其平均值。
1.4 统计学处理 应用SPSS13.0统计学软件进行数据分析,计量资料以±s表示,计数资料采用t检验,检验水准ɑ=0.05。以P<0.05为差异有统计学意义。
2 结 果
22例为单发,2例多发,各见1子灶。病灶位于肝左叶16例,肝右叶5例,跨叶生长3例,瘤体直径2.2~10.6cm,边界不清。15例病灶呈类圆形,其中7例伴浅分叶,余9例呈不规则形。门静脉受侵8例,其中2例门静脉癌栓形成,肝门区淋巴结肿大4例。肝内胆管扩张6例,肝内胆管结石4例,肝叶萎缩4例,局部肝轮廓凹陷3例。
24例病灶CT平扫均为低密度,边界不清晰。增强扫描动脉期:2例呈不均匀明显强化,4例未见强化,周边轻度不完全强化7例,边缘呈连续薄环状强化11例,6例中央呈网格状或结节状强化;门静脉期:环形强化18例,呈渐进性填充中度强化,6例呈不均匀轻-中度强化;延迟期:病灶强化不均匀,16例持续强化高于肝实质,8例强化程度低于肝实质,13例病灶中心填充强化呈片状、网格状及结节状,11例中心未强化(图1)。其中,18例MRI检查病例,12例病灶T2WI呈不均匀稍高信号,周围稍高、中央等低、边缘模糊,6例呈高信号;T1WI均呈不均匀低信号。12例病灶动脉期呈厚环、薄环或花边状轻中度强化,6例中心可见网格状强化,5例病灶周围肝实质内出现淡雾状强化;门静脉期及延迟期强化范围均向中心扩展,平扫T2WI中心所见低信号区均出现不同程度强化,12例中心区呈网格状或结节状延迟强化,6例中心未见强化(图2)。
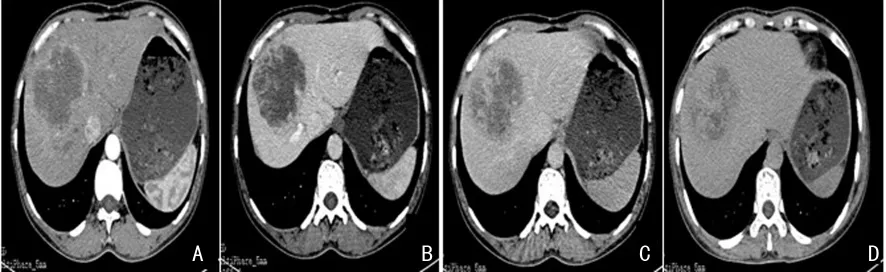
图1 IHPCC患者肝右前叶GE LightSpeed 64排螺旋CT扫描图像
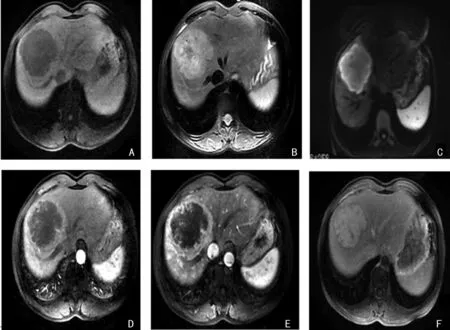
图2 IHPCC患者肝右前叶MRI扫描图像
DWI各例均呈不均匀高或稍高信号,14例中心见低信号区。测得病变区 ADC值:(1.36±0.11)×10-3mm2/s,正常肝实质 ADC值(1.22±0.14)×10-3mm2/s;t=0.89,P>0.05,差异无统计学意义。
3 讨 论
IHPCC的发病机制尚不完全清楚,目前多数学者认为与长期的肝内胆管结石合并感染、硬化性胆管炎、华支睾吸虫感染、先天性胆管囊肿等有关。本组4例合并胆管结石。IHPCC的生长方式有3种类型:肿块型、浸润狭窄型和腔内型,临床上以肿块型最常见。
3.1 CT和MRI平扫特征 多层螺旋CT扫描已经广泛用于肝脏疾病检查[1],IHPCC在CT上多表现为类圆形实性或囊实性无包膜团块,呈等或略低密度,边界不清,边缘不规则,肿瘤浸润性生长,内部大量纤维组织存在,致肝叶萎缩,肝内胆管扩张、结石,肿瘤位于肝缘牵拉回致肝被膜回缩凹陷,局部肝脏萎缩等。MRI平扫T2WI比T1WI更容易发现病灶,T2WI在检出肝内小卫星灶方面优于CT增强扫描[2-3]。IHPCC在T2WI边界较清晰,周边部多呈高或稍高信号,中心可见局灶性片状、条状或星芒状低信号区,提示中心富含纤维组织,反映了胆管癌的组织学特点,具有一定特征性[4-5]。当病灶内出现坏死灶或黏液湖时,则在T1WI呈明显低信号,T2WI呈明显高信号,可以此鉴别,本组12例可见此典型征象。MRI平扫综合运用多序列多种加权成像方法能清晰显示肿瘤边界,反映出肿瘤内部组织构成,较CT平扫具有明显优势。CT平扫在显示肝内胆管结石方面较MRI直观。
3.2 CT和MRI增强特征及病理学基础 IHPCC组织成分的比例和分布的差异性决定了增强表现的复杂多样性,其CT与MRI增强表现基本相同,动脉期周边部出现环状、花边状强化,中心无强化或出现网格状、索条状或羽毛状强化,门静脉期强化范围向中心扩展,延迟期中心呈渐进性填充式强化,周边强化减低[6]。肿瘤的外周主要由大量成活的肿瘤细胞和少量纤维组织构成,其血供相对较丰富,故增强扫描时可出现早期强化。纤维组织是延迟强化的病理基础,肿瘤内富含较多纤维组织,而对比剂在纤维组织内弥散缓慢,故增强扫描出现中心延迟强化,本组6例动脉期病灶内部网格状、索条状或羽毛状强化,病理基础为胆管细胞癌呈浸润性生长,瘤灶内肿瘤血管为肿瘤组织所浸润或包埋,造影剂进入所致[7-8]。IHPCC属于少血供肿瘤,当瘤体较大时,中心容易出现坏死,动脉期及延迟期均无强化[9]。本组2例行CT扫描时动脉期病灶整体明显异常强化,而门静脉期呈低密度,类似肝细胞肝癌的“快进快出”改变,可能是由于病变发生早,血供相对丰富,主要由肿瘤细胞及增生血管组成所致。MRI软组织分辨率更高,对组织及血流信号高度敏感,增强扫描呈连续动态扫描,其增强图像反映的强化细节较CT更多。CT增强扫描速度快,不同增强时期之间存在间隔,不是完整意义上的连续动态扫描,其组织强化的敏感性较MRI弱,但是其强大的后处理功能及薄层重建较高的密度分辨率足以精确反映肿瘤的生物组织学特征。
3.3 DWI及ADC值的诊断价值 DWI是近年被广泛应用的一种新成像序列,能从分子水平提供组织的代谢信息,ADC值是反映病变组织水分子扩散的量化指标,受多种因素影响,其中b值是最重要的成像参数,本研究参考文献[10-11],选用b值为(0,800)s/mm2,既能减少血流灌注和 T2穿透效应的影响,又能保证DWI图的信噪比。李莉等[12]研究认为,胆管癌、肝细胞癌及转移瘤的DWI信号衰减低于正常肝实质呈高信号。本组各例病灶周边部实性部分在DWI均呈不均匀高或稍高信号,中心区可见等、低信号。同时肿大淋巴结在DWI正常组织抑制背景下显示十分清晰直观。目前,有关于胆管癌及其他肝良、恶性病变ADC值界限问题的研究报道,结论不一,多数文献报道肝恶性肿瘤的ADC值低于良性病变[12-13]。本组ADC值高于正常肝实质(P>0.05),与张雪辉等[14]的研究结论相符,推测可能与肿瘤组织的高代谢状态及肿瘤血管的高通透性有关。
综上所述,IHPCC由于病灶内各种成分的比例和分布不同,CT和MRI表现不同,其动态增强方式精确反映肿瘤组织学构成,CT具有强大的后处理功能、薄层重建高密度分辨及对钙化的敏感性,二者结合,取决于病灶内各种成分,尤其是肿瘤细胞与纤维组织的比例和分布。当肝内肿瘤出现上述特征性的动态强化表现及伴随征象,高度提示IHPCC的诊断。CT及MRI检查各有优势,MRI常规检查结合DWI功能成像能够大大提高IHPCC的检出率和诊断符合率,对临床治疗具有重要价值。
[1]马秀华,吕富荣,薛鹏,等.多层螺旋CT动态增强扫描对不典型肝脓肿的诊断价值[J].重庆医学,2011,40(20):2223-2226.
[2]Aljiffry M,Walsh MJ,Molinari M.Advances in diagnosis,treatment and palliation of cholangiocarcinoma:1990-2009[J].World Gastroenterol,2009,15(34):4240-4262.
[3]Chung YE,Kim MJ,Park YN,et al.Varying appeararances of cholangiocareinoma radiologic-pathoogic correation[J].Radiology,2009,29(3):683-700.
[4]李绍林,张雪林,陈燕萍,等.肝内周围型胆管细胞癌CT和MRI诊断及病理基础研究[J].中华放射学杂志,2004,38(10):1072-1074.
[5]Li SQ,Liang LJ,Hua YP,et al.Long-term outcome and prognostic factors of intrahepatic cholangiocarcinoma[J].Chin Med J(Engl),2009,122(19):2286-2291.
[6]Maetani Y,Itoh K,Watanabe C,et al.MR imaging of intrahepatic cholangiocarcinoma with pathologic correlation[J].AJR Am J Roentgenol,2001,176(6):1499-507.
[7]王于臻,赵庆花,戚春厚.肝内周围型胆管细胞癌的CT表现与病理学基础相关性分析[J].中国中西医结合影像学杂志,2009,7(2):32-34.
[8]梅毅军,丁庆国.原发性肝内周围型胆管细胞癌MRI诊断[J].实用放射学杂志,2008,24(3):330-332.
[9]彭可雨,梁汉欢,邹亚毅.MRI动态增强对肿块型肝内周围型胆管细胞癌的诊断价值[J].中国CT与 MRI杂志,2010,35(8):34-36.
[10]于德新,马祥兴,张晓明.不同b值和测量位置的DWI参数鉴别诊断肝脏良、恶性占位性病变[J].中国医学影像技术,2009,25(5):830-832.
[11]Demir OI,Obuz F,Saol O,et al.Contribution of diffusionweighted MRI to the differential diagnosis of hepatic masses[J].DiagnInterv Radial,2007,13(2):81-86.
[12]李莉,任转琴,陈涛,等.磁共振扩散加权成像在胆管癌诊断中的价值研究[J].中国医学影像学杂志,2011,19(1):76-80.
[13]王化,王霄英,黄勇,等.磁共振扩散加权与T2加权成像对肝局灶性病变检出的比较研究[J].实用放射学杂志,2008,24(11):1487-1491.
[14]张雪辉,梁碧玲,赵继泉,等.肝常见病变弥散系数的初步研究[J].中国医学影像技术,2004,20(1):26-28.

