血栓调节蛋白水平和剂量体积参数与急性放射性肺炎的相关性*
赵艳海,张 纯,邓雪英,成奇峰,陈昱明,吴伟艺,孙彦秋,黄军荣,刘惠珠
(广东省东莞市人民医院放射治疗科 523000)
接受肺部放射治疗的肺癌患者,日后会发生不同程度的肺放射损伤,它实质上是靶细胞受到射线照射后产生的炎性细胞因子和组织细胞相互作用的生物学过程。照射体积、射线剂量、分割剂量等是外在因素,属于放射物理因素。靶细胞和一系列炎性细胞因子相互作用是放射损伤的内在因素,属于放射生物因素。这些因素影响着放射损伤的严重程度。本研究在常规分割3维适形放射治疗(3dimensional conformal radiation therapy,3DCRT)条件下,探索放射物理因素和微血管内皮细胞损伤后导致的血栓调节蛋白(thrombomodulin,TM)变化与急性放射性肺炎(acute radiation pneumonitis,ARP)的相关性,现报道如下。
1 资料与方法
1.1 一般资料 2007年7月至2012年8月在本科室进行3DCRT的肺癌患者54例,其中男48例,女6例。中位年龄54岁(39~80岁)。其中鳞癌30例、腺癌14例、不典型类癌1例、肉瘤样癌伴腺癌成分1例、细支气管肺泡癌2例、小细胞肺癌(small cell lung cancer,SCLC)6例(均为局限期);48例非小细胞肺癌(non-small cell lung cancer,NSCLC)中,中央型36例、周围型12例;临床Ⅰ期2例、Ⅱ期10例、Ⅲ期36例;16例有肺叶切除手术史。20例患者同步放化疗,34例序贯化放疗,化疗多给予2~4周期含铂的方案。
1.2 方法
1.2.1 放射治疗 采用西门子双排CT模拟定位,瓦里安21EX直线加速器放射治疗,给予患者6MV射线常规分割3DCRT,放疗剂量中位值61Gy(50~70Gy);95%计划靶区(planning target volume,PTV)剂量52~70Gy。物理学指标包括平均肺受量(mean lung dose,MLD)和Vx(指照射总剂量高于x Gy的肺体积占全肺总体积的百分数)都来自剂量体积直方图(dose-volume histogram,DVH),V5中位数为48%(25%~75%),V10为33%(16%~55%),V20为21%(9%~29%),V30为13%(4%~22%),V40为5%(1%~15%),MLD为10Gy(5~15Gy)。入院后常规病史采集、体格检查和辅助检查,放疗前及放疗30Gy时,采患者晨起空腹静脉血,离心出血清,用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定血清TM水平。
1.2.2 观察指标 放疗前参照CTCAE v3.0标准对患者呼吸道症状进行评级,放疗开始至结束后3月内,每周复评。诊断ARP时必须排除肺内感染及肺内病变进展,相关症状分级至少较疗前增加1级。观察终点为大于或等于2级ARP。评价TM 水平、V5、V10、V20、V30、V40、总剂量、MLD、年龄、吸烟史、血红蛋白含量、胸部手术、同步化疗等指标与ARP发生率的关系
1.3 统计学处理 采用SPSS13.00软件,计量资料以±s表示,均数比较采用t检验和方差分析,ARP发生率的比较采用χ2检验和Fisher′s精确概率法,以P<0.05为差异有统计学意义。
2 结 果
2.1 临床因素与ARP发生的关系 20例患者(37%)发生了2级以上ARP,其中8例3级,12例2级。ARP的发生率,在年龄小于60组、吸烟组、同步放化疗组高于年龄60岁以上组、无吸烟组和序贯化放疗组。患者放疗前血红蛋白含量高低、性别、有无接受胸部手术与ARP的发生率无统计学意义(P>0.05)。见表1。ARP发生率,在48例NSCLC和6例SCLC中分别是38%(18/48)vs.33%(2/6)(P=0.842);在42例中央型肺癌和12例周围型肺癌中分别是33%(12/42)vs.50%(6/12)(P=0.292)。

表1 临床因素与ARP发生率的关系
2.2 物理学参数与ARP发生的关系 在V5≥50%、V20≥25%、V30≥13%、MLD≥10Gy组ARP发生率明显升高。见表2。ARP组和未发生 ARP组之间,V5、V10、V20、V30、MLD大小差异有统计学意义(P<0.05)。V40和总剂量大小在两组间差异无统计学意义(P>0.05)。见表3。
2.3 TM水平与ARP发生的关系 放疗30Gy时TM水平比基础水平降低组,ARP发生率(50%)明显高与较基础水平增高组(12%)。
2.4 ARP级别与剂量体积参数的关系 MLD、V5、V10在0~1与2级ARP之间和0~1与3级ARP之间差异有统计学意义(P<0.05);在2与3级ARP之间差异无统计学意义(P>0.05)。V20在0~1与3级ARP之间差异有统计学意义(P<0.05);在0~1与2级ARP之间差异无统计学意义(P>0.05);2级与3级之间差异无统计学意义(P>0.05)。V30在0~1与3级ARP之间和2级与3级ARP之间差异有统计学意义(P<0.05);在0~1级与2级之间差异无统计学意义(P>0.05),见表4。
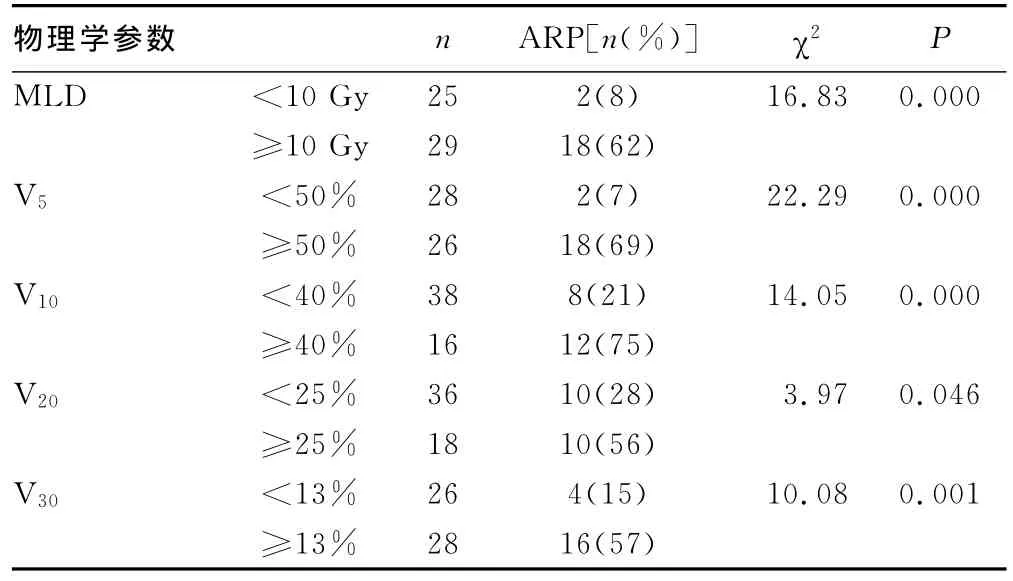
表2 物理学参数与ARP发生率的关系

表3 发生ARP与未发生ARP患者的物理学参数水平
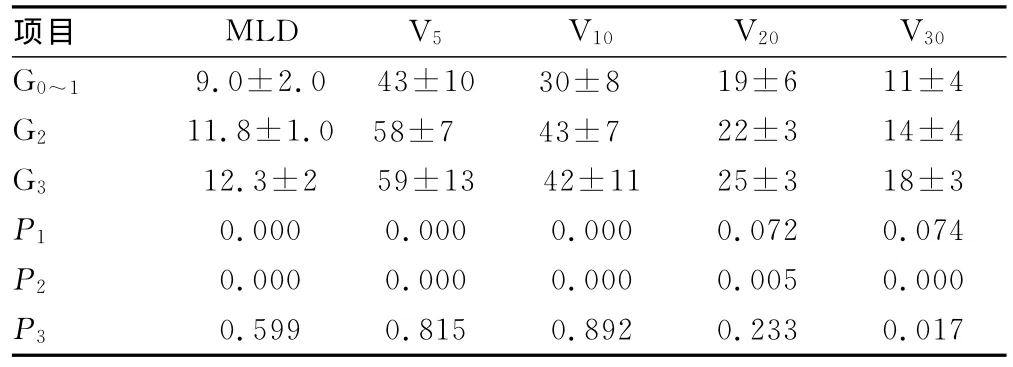
表4 物理学参数与ARP级别的关系
3 讨 论
胸部疾病进行放射治疗时,一定体积的肺组织接受一定剂量的电离辐射会引起不同程度的放射性肺损伤,包括早期的ARP和晚期的放射性肺纤维化(radiation pulmonary fibrosis,RPF)。一般来说RPF由ARP发展而来,ARP发生的越早、越重,RPF发生的相应越早、越重[1]。
放射总剂量、分割剂量和照射体积等因素影响着肺损伤的发生,以照射剂量和照射体积最主要[2]。研究证实DVH参数与肺放射损伤密切相关,包括:V20、V30、MLD、正常组织并发症概率[3-9]。Wang等[10]报道 V30<22%组和 MLD≤16Gy组放射性肺炎的发生率是10%;V30≥22%组和 MLD>16Gy组,肺炎的发生率升至36%;V5≤42%和>42Gy时,放射性肺炎的发生率分别是3%和38%。Kim等[11]认为,MLD、V20和V30不超过16Gy、25%和18%时,出现2级以上ARP的概率明显下降。随着研究的扩展,V5的重要性逐渐受到重视[10,12]。
本次研究显示,ARP组 MLD、V5、V10、V20和 V30明显高于无ARP组,ARP发生率在 MLD<10Gy、V5<50%、V10<40%、V30<13%时明显减低,这同之前的研究结果相符。将ARP分成0~1级组、2级组和3级组,3个级别相互比较剂量体积参数的大小,发现 MLD、V5、V10、V20和 V30在0~1级组与3级组差异均有统计学意义(P<0.05),只有V30在2级与3级之间的差异有统计学意义,这可能提示V30在预测3级ARP方面更有优势。随着分子生物学研究的深入,目前认为放射性肺损伤是一个由多细胞参与、多种细胞因子调控的生物学过程。肺Ⅱ型细胞和肺毛细血管、微血管的内皮细胞作为最主要的靶细胞,受到射线照射后会释放促炎性细胞因子,多种细胞和细胞因子相互作用,始动和维持了放射性肺损伤。
TM由巨核细胞和内皮细胞合成,广泛分布于血管内皮细胞表面。TM是重要的血管内凝血抑制因子,凝血酶与它结合后凝血活性下降,反之,TM的降低会导致微血管处于高凝状态。邱峻等[13]通过检测鼠受照射肺组织中的TM变化,推测内皮细胞的放射损伤导致的持续高凝状态,在肺放射损伤中起着基础性作用。Martin等[14]发现,直肠癌放射治疗早期即能明显引起肠道微血管内皮细胞TM含量下降并持续到慢性损伤阶段。因为发生放射损伤的机制相似,所以作者推测这种情况存在于其他器官的放射性损伤。Wang等[15]报道放疗后微血管内皮细胞TM含量下降。一项包含17例肺癌患者的前瞻性研究,测量3DCRT前、中、后血清TM含量发现,在ARP发生患者中,放疗后1周TM明显下降,作者认为TM是一个早期预测ARP的指标[16]。本研究发现,放射30Gy时TM较基础水平降低组,ARP发生率明显高于放疗后TM水平增加组,这与上述研究结果一致。
总之,本研究证实 MLD、V5、V10、V20和 V30与 ARP之间有相关性,放疗后血清TM水平的下降会加重放射性肺损伤。在放疗期间检测血清TM水平,对及时调整放疗计划有重要的临床意义。不同剂量体积参数的阈值、其他反映内皮细胞等靶细胞损伤的指标需要进一步研究。
[1]Chen YY,Williams J.Radiation penumonitis and early circulatory cytokine markers[J].Seminars in Radiation Oncology,2002,12(Suppl 1):26-33.
[2]王明臣,刘洪明,刘杰,等.放射性肺炎影响因素的多元回归分析[J].中华放射肿瘤学杂志,2003,12(增刊):49-51.
[3]Graham MV,Purdy JA,Emami B,et al.Clinical dose-volume histogramanalysis for pneumonitis after 3Dtreatment for non-small cell lung cancer[J].Int J Radiat Oncol Biol Phys,1999,45(2):323-329.
[4]Claude L,Perol D,Ginestet C,et al.A prospective study on radiation pneumonitis following conformal radiation therapy in non-small-cell lung cancer:clinical and dosimetric factors analysis[J].Radiother Oncol,2004,71(2):175-181.
[5]Hernando ML,Marks LB,Benel GC,et al.Radiation-induced toxicity:a dose-volume histogram analysis in 201 patients with lung cancer [J].Int J Radiat Oncol Biol Phys,2001,47(3):650-659.
[6]Michael F,Alex T,Richard F,et al.Dose-volume histogram analysis as predictor of radiation pneumonitis in primary lung cancer patients treated with radiotherapy[J].Int J Radiat Oncol Biol Phys,2005,51(5):1355-1363.
[7]Kim TH,Ho KH,Pyo HR,et al.Dose-volumetric parameters for predicting severe radiation pneumonitis after threedimensional conformal radiation therapy for lung cancer[J].Radiation Oncology,2005,235(1):208-215.
[8]王澜,吕冬婕,韩春,等.胸部肿瘤同期放化疗患者肺功能及剂量学参数对急性放射性肺炎的预测价值[J].中华放射肿瘤学杂志,2011,20(1):40-43.
[9]Ramella S,Trodella L,Mineo TC,et al.Adding ipsilateral V20and V30to conventional dosimetric constraints predicts radiation pneumonitis in stage IIIA-B NSCLC treated with combined-modality therapy[J].Int J Radiat Oncol Biol Phys,2010,56(1):110-115.
[10]Wang S,Liao Z,Wei X,et al.Analysis of clinical and dosimetric factors associated with treatment-related pneumonitis(TRP)in patients with non-small-cell lung cancer(NSCLC)treated with concurrent chemotherapy and three-dimensional conformal radiotherapy(3D-CRT)[J].Int J Radiat Oncol Biol Phys,2006,52(5):1399-1407.
[11]Kim MY,Lee J,Ha B,et al.Factors predicting radiation pneumonitis in locally advanced non-small cell lung cancer[J].Radiat Oncol J,2011,29(3):181-190.
[12]Miles EF,Larrier NA,Kelsey CR,et al.Intensity-Modulated radiotherapy for resected mesothelioma:the Duke experience[J].Int J Radiat Oncol Biol Phys,2008,54(4):1143-1150.
[13]邱俊,李坚何,天楚,等.TM、PAI-1在放射性肺损伤中的表达及意义[J].实用医学杂志,2011,27(6):973-975.
[14]Martin C,Hauer J,Louis M,et al.Radiation injury and the protein C pathway[J].Crit Care Med,2004,32(5):325-330.
[15]Wang J,Zheng H,Ou X,et al.Deficiency of microvascular thrombomodulin and upregulation of protease-activated receptor 1in irradiated rat intestine:Possible link between endothelial dysfunction and chronic radiation fibrosis[J].Am J Pathol,2002,160(6):2063-2072.
[16]Hauer-Jensen M,Kong FM,Fink LM,et al.Circulating thrombomodulin during radiation therapy of lung cancer[J].Radiat Oncol Investig,1999,7(4):238-242.

