静脉注射左西孟旦对脓毒症休克患者心肌抑制影响的临床疗效*
孟繁甦,岑英文,郭应军,黄小洵,周丹丹
(广东省中山市中医院重症医学科 528400)
脓毒症休克是危重症患者死亡的重要原因,其中大部分是死因为难治性低血压和心血管瘫痪。左西孟旦是一种新型钙增敏剂,已有动物研究发现左西孟旦能改善脓毒症休克的心肌抑制。本研究旨在通过监测药物治疗前后血流动力学改变,分析左西孟旦对脓毒症休克患者心肌抑制的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2011年8月至2012年8月本院重症医学科的脓毒症休克患者共20例,按照1∶1分配原则接受左西孟旦和多巴酚丁胺治疗,若家属不同意采用左西孟旦药物治疗,则顺延下1位患者。入选标准:(1)年龄18~75岁,无性别限制;(2)明确诊断为脓毒症休克,经过液体复苏并使用去甲肾上腺素提高平均动脉压大于75mm Hg;(3)均需要有创机械通气治疗;(4)用药后观察1周;其中,脓毒症诊断参照2008年国际脓毒症指南标准[1]。排除标准:(1)严重低血压及心律失常;(2)肝、肾功能不全;(3)妊娠及哺乳期妇女;(4)预期不能完成研究者。
1.2 研究方法 试验组:初始量左西孟旦(5%葡萄糖45mL加左西孟旦12.5mg),负荷量为12mL/h,注射时间为10 min。对照组采用多巴酚丁胺5μg·min-1·kg-1,连续24h用药,最大使用量不超过40μg·min-1·kg-1。所有入选病例均采用PICCO或者Swan-Ganz漂浮导管监测血流动力学并记录入组时及入组后7d内的心脏指数(CI)、血压(BP)、中心静脉压(CVP)、血管外肺水指数(EVLW)或者肺毛细血管嵌入压(PCWP)变化。入组时、入组后第3天、第8天早晨7:00抽取外周静脉血行肌钙蛋白、脑钠肽、降钙素原(PCT)及C反应蛋白(CRP)检测。记录入组时、入组后第3天、第8天APACHEⅡ评分。记录每日生命体征,每天升压药物(去甲肾上腺素)用量、出入量、ICU内全因病死率。研究中若出现严重低血压或者严重心律失常则立即停止试验。
表1 两组患者治疗前后一般情况比较(±s,n=20)

表1 两组患者治疗前后一般情况比较(±s,n=20)
#:P<0.05,与同组入组时比较;*:P<0.05,与对照组第8天比较。
组别 时间 APACHEⅡ PCT(pg/mL) BNP(ng/L) 肌钙蛋白(ng/L) ICU住院时间(d) ICU病死率(%)试验组 入组时 19.7±4.9 11.5±4.8 412.5±54.7 2.4±1.1 14.3±6.1 30第8天 14.8±3.4#* 4.9±3.1#* 291.5±81.5#* 1.1±0.9#*对照组 入组时 19.1±5.1 13.2±5.3 442.5±61.0 2.5±1.3 14.5±6.2 40第8天 16.6±7.2# 8.3±4.9#354.9±66.5 2.2±1.3
表2 两组患者治疗前后血流动力学指标比较(±s,n=20)
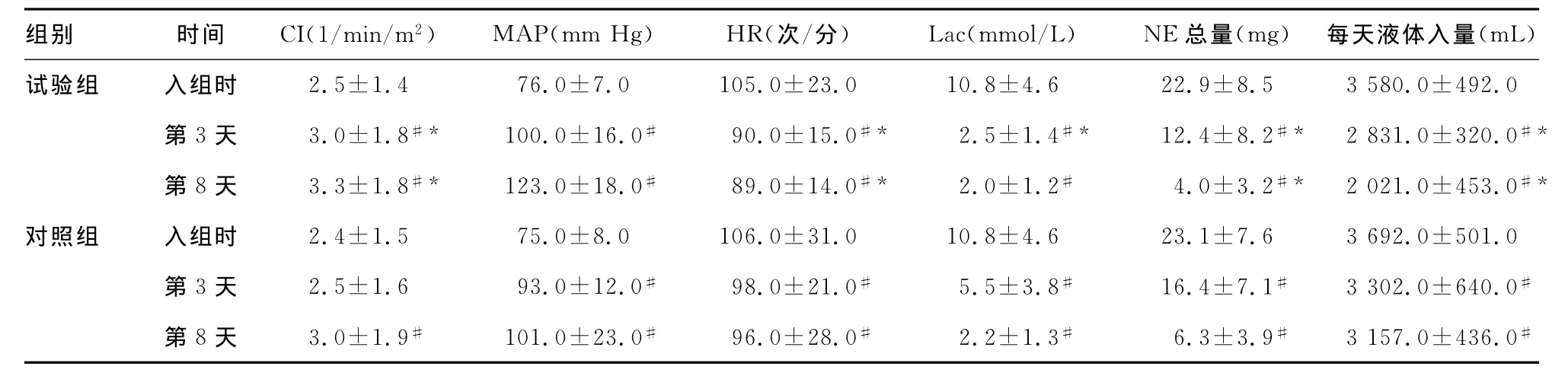
表2 两组患者治疗前后血流动力学指标比较(±s,n=20)
#:P<0.05,与同组入组时比较;*:P<0.05,与对照组的同一时间点比较。
组别 时间 CI(1/min/m2) MAP(mm Hg) HR(次/分) Lac(mmol/L) NE总量(mg) 每天液体入量(mL)试验组 入组时 2.5±1.4 76.0±7.0 105.0±23.0 10.8±4.6 22.9±8.5 3 580.0±492.0第3天 3.0±1.8#* 100.0±16.0# 90.0±15.0#* 2.5±1.4#* 12.4±8.2#* 2 831.0±320.0#*第8天 3.3±1.8#* 123.0±18.0# 89.0±14.0#* 2.0±1.2# 4.0±3.2#* 2 021.0±453.0#*对照组 入组时 2.4±1.5 75.0±8.0 106.0±31.0 10.8±4.6 23.1±7.6 3 692.0±501.0第3天 2.5±1.6 93.0±12.0# 98.0±21.0# 5.5±3.8# 16.4±7.1# 3 302.0±640.0#第8天 3.0±1.9# 101.0±23.0# 96.0±28.0# 2.2±1.3# 6.3±3.9# 3 157.0±436.0#
1.3 统计学处理 采用SPSS15.0软件包进行分析处理。计量资料采用±s表示,组间比较采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者治疗前后一般情况比较 比较两组患者入组时及入组后第8天情况,见表1。两组患者入组时APACHEⅡ、PCT含量、脑钠肽及血肌钙蛋白含量比较,差异均无统计学意义(P>0.05),具有可比性。经过治疗后,第8天时患者APACHEⅡ均明显下降,且试验组减低优于对照组(P<0.05)。另外,经过治疗后第8天PCT、BNP和肌钙蛋白含量均明显下降,且试验组下降程度优于对照组(P<0.05)。两组患者的ICU住院时间及病死率差异无统计学意义(P>0.05)。
2.2 两组患者治疗前后血流动力学指标比较 两组患者治疗前后血流动力学指标比较,见表2。经过治疗后,试验组CI在第3天开始有明显改善(P<0.05),而对照组在第3天升高不明显(P>0.05),第8天时CI与入组时比较,明显升高(P<0.05)。MAP和HR两项指标经过治疗后明显改善,且与对照组同一时间点比较,试验组改善明显(P<0.05)。治疗后各组的乳酸含量明显下降(P<0.05),与对照组第3天比较,试验组乳酸含量下降明显(P<0.05)。经过治疗后试验组去甲肾上腺素用量明显下降(P<0.05),且与对照组第3、8天比较,同一时间点试验组用量明显减少(P<0.05)。各组的液体入量有减少趋势,且与入组时比较,差异具有统计学意义(P<0.05),对照组在第3、8天液体入量仍明显多于试验组(P<0.05)。
3 讨 论
脓毒症及脓毒症性休克已经是一个日益严重的临床问题,是重症监护病房的最常见死亡原因。脓毒症休克时患者主要表现为容量试验后持续低血压状态或血乳酸浓度大于或等于4mmol/L,临床上需要尽快进行液体复苏,当出现严重低血压则需要使用血管活性药物来维持血压[1]。有研究报道,严重脓毒症每年的发病率逐渐上升,每10万人就有132人发生严重脓毒症,脓毒症发病率已经由百万之0.5增加至百万分之七,病死率接近30%~50%[2-3]。美国每年严重脓毒症病例约750 000例,大约有215 000例死亡,病死率接近30%,其中,大部分是死因为难治性低血压和心血管瘫痪[4]。
心脏是脓毒症对机体损害的重要靶器官之一,在病情演变及疾病预后上非常关键。已有临床研究证实,脓毒症早期就已存在心肌的器质性损伤,发生率很高,这些患者易伴发低血压、心力衰竭和心律失常[5-6]。Andrew研究结果显示隐匿性心肌损伤在脓毒症患者中发生率大约为25%。另有研究结果发现超过50%的脓毒症休克和严重脓毒症患者会发生左心收缩功能障碍[7-8]。当机体发生持续且难以纠正的脓毒症休克则多存在心肌损伤,而且多数伴有血清标志物肌钙蛋白I升高。机体一旦发生脓毒症心肌抑制病死率明显升高。如何改善脓毒症休克时心肌抑制是目前研究的重点内容。
左西孟旦为一种新型钙增敏剂类,作为正性肌力药物用于急性心脏代偿失调的心力衰竭患者的短期治疗。左西孟旦选择性与心肌肌钙蛋白C的N-末端结合,稳定心肌钙键,增强心脏肌钙蛋白C(心脏肌原纤维细丝)对离子的敏感性,增强心肌收缩力,该药物具有独特的双重作用模式,能增加心脏输出,并同时增加ATP敏感性K通过扩展血管,改善心肌舒张功能和增加冠脉血流,改善心脏泵功能的同时也能改善舒张功能。已有动物研究发现左西孟旦能改善脓毒症休克的心肌抑制,欧洲国家已经开始使用左西孟旦治疗脓毒症休克心肌抑制,但是到目前为止,关于该药物循证医学证据还不足[9-10]。本研究是通过联合脓毒症休克患者的血流动力学及检测血清学标志物探讨左西孟旦针对脓毒症休克时心肌抑制方面的影响。
本研究结果显示,治疗后第3天试验组患者CI有明显改善,而对照组在第3天时CI改善不明显。同时,试验组去甲肾上腺素用量明显减少,且与对照组第3、8天比较,试验组用量明显少于对照组。而各组血乳酸含量下降明显,与对照组比较,试验组乳酸含量下降明显。经过治疗后各组液体入量有减少趋势,但对照组在第3、8天液体入量仍明显多于试验组。各组的APACHEⅡ评分均明显下降,同时试验组评分明显下降优于对照组,提示试验组病情改善明显,这与血流动力学监测的结果一致。另外,本研究结果尽管试验组的APACHEⅡ及血流动力学指标有改善,但二者入住ICU时间差异无统计学意义,这也与该类患者需要加强监护、适当缩紧转出指征有关。另外,两组病死率差异无统计学意义,可能与该研究样本量小有关,需要进一步扩大样本量。
[1]Dellinger RP,Levy MM,Carlet JM,et al.Surviving sepsis campaign:international guidelines for manegement of severe sepsis and septic shock[J].Crit Care Med,2008,36(1):296-327.
[2]Dombrovskiy VY,Martin AA,Sunderram J,et al.Rapid increase in hospitalization and mortality rates for severe sepsis in the United States:a trend analysis from 1993to 2003[J].Crit Care Med,2007,35(4):1244-1250.
[3]Artigas A,Niederman MS,Torres A,et al.What is next in sepsis:current trials in sepsis[J].Expert Rev Anti Infect Ther,2012,10(8):859-862.
[4]Toussaint S,Gerlach H.Immunoglobulins in adult sepsis and septic shock[J].Curr Infect Dis Rep,2012,14(5):522-529.
[5]Pulido JN,Afessa B,Masaki M,et al.Clinical spectrum,frequency,and significance of myocardial dysfunction in severe sepsis and septic shock[J].Mayo Clin Proc,2012,87(7):620-628.
[6]Puskarich MA.Emergency management of severe sepsis and septic shock[J].Curr Opin Crit Care,2012,18(4):295-300.
[7]Wacharasint P,Nakada TA,Boyd JH,et al.Normal-range blood lactate concentration in septic shock is prognostic and predictive[J].Shock,2012,38(1):4-10.
[8]Regueira T,Djafarzadeh S,Brandt S,et al.Oxygen transport and mitochondrial function in porcine septic shock,cardiogenic shock,and hypoxaemia[J].Acta Anaesthesiol Scand,2012,56(7):846-859.
[9]Yilmaz MB,Mebazaa A.In vivo and in vitro evidence for pleiotropic effects of levosimendan in the intensive care setting[J].Crit Care,2011,15(4):182-186.
[10]Papoff P,Caresta E,Versacci P,et al.Beneficial effects of levosimendan in infants with sepsis-associated cardiac dysfunction:report of 2cases[J].Pediatr Emerg Care,2012,28(10):1062-1065.

