与水稻品种特异性、一致性、稳定性(DUS)测试性状相关联的分子标记分析
王艳平, 李华勇, 沈 奇, 张继红, 王 平, 吴 燕
(江苏省农业科学院粮食作物研究所,江苏 南京210014)
植物新品种权作为一种知识产权的保护在中国乃至世界的发展极为迅速,因此,建立完善、先进、可行的植物DUS(植物新品种特异性、一致性和稳定性)测试体系十分必要。水稻是中国最主要的粮食作物之一。水稻生产在国民经济中占有重要地位,使得中国的水稻育种发展极快,每年申请品种权的数量迅猛增加。如何保护新品种的知识产权,对于中国水稻育种的健康、持续发展具有重要的现实意义。DUS 测试是新品种授权、判断品种真实性的重要依据,也是植物品种权侵权等案件判定的重要技术手段[1]。在品种授权、市场准入和品种鉴定等方面起着不可替代的作用,是现代种植业健康发展的重要技术保障。申请品种的特异性(Distinctness)、一致性(Uniformity)和稳定性(Stability)(简称DUS)是国际植物新品种保护联盟(UPOV)规定的授权条件之一。因此要做到品种权审查和授权的客观、公正和准确,对申请品种的DUS 测试就显得十分重要。
DUS 测试是一个复杂的技术检测过程,它不仅要判定品种的特异性,而且还要判定该品种是否具有稳定性、一致性。目前,中国及国际上通行的新品种DUS 测试标准主要是建立在部分生物学性状(包括农艺性状、品质性状和抗逆性状等)的田间测定基础上的,在DUS 测试上包括了50 个以上的性状和系列标准比较品种。如水稻DUS 测试必需检测的性状共有52 个。这些性状分成3 种性状类型:质量性状、假质量性状和数量性状。在对测试品种与标准品种、近似品种的外观和农艺性状、经济性状的田间测定和比较分析时,鉴定结果容易受环境因素的影响,如在不同测试地点、不同测试时期某些性状(如有关颜色的性状)会表现不稳定;在测试过程中也经常出现因不同测试人员对同一作物同一性状的认识存在偏差,导致某些性状代码判定结果不一致的问题。同时根据田间测定分析判定品种的特异性、一致性和稳定性工作量十分巨大,也会导致测试工作的误差加大。因此,探索更加稳定、可靠、简便,并有较高区分能力的鉴定技术对水稻新品种权保护和遗传资源登记工作尤其重要。
DNA 分子标记的快速发展,为品种的准确鉴定及DUS 测试提供了新的有力手段。随着水稻基因图谱、基因组测试的完成,越来越多的控制生物学性状的基因被定位,并得到了与其连锁的分子标记,如与红色种皮基因Rc 连锁的标记RID14[2]、紫色种皮基因Pb 连锁的标记CAPSRa[3]、与水稻半矮秆基因Sd-1 连锁的标记RG220、RG109[4]、与长穂颈基因eui 连锁的标记RM3673、RM0012[5]、与披叶基因dl(t)连锁的标记RM1324[6]、与粒长基因GL3 连锁标记PSM379、RM16[7]等等。诸如此类的性状在水稻DUS 测试指南中占很大比重。使用与这些性状基因紧密连锁的DNA 标记,有助于在DUS 测试中快速筛选近似品种和测试性状代码的判定,从而提高水稻DUS 测试的准确性和测试的效率。
关联分析方法在水稻、大豆、小麦等作物的农艺性状研究中已得到较多应用[8-12]。Yan 等[13]利用美国农业部水稻核心种质的90 份材料与109 个DNA 标记对柱头和穗部性状进行了关联分析。Huang 等[14]通过测序517 个水稻地方品种,分析了近360 万个SNP(single nucleotide polymorphisms)标记与14 个农艺性状之间的关联。近年来,作物新品种保护日益受到重视,但到目前为止对水稻新品种保护的DUS 测试中很多性状尚未进行标记的关联分析研究。本试验用45 份材料构成的品种群体对38 个DUS 测试性状与45 个分子标记进行关联分析,旨在发掘与水稻DUS 测试性状相关联的分子标记,为水稻新品种测试提供辅助技术手段。
1 材料与方法
1.1 材料
供试材料45 份,由农业部植物新品种保护办公室提供,为用于水稻DUS 测试的标准品种,品种名称及编号见表1。
1.2 方法
1.2.1 农艺性状鉴定 45 个水稻品种2011 年正季种植在江苏省农业科学院溧水植物科学基地。5月6 日播种,6 月7 日单株移栽。每个品种均种植4行,每行12 株,株行距20 cm×20 cm,2 次重复。常规田间管理。按照《植物新品种特异性、一致性和稳定性测试指南—水稻》(GB/T 19557.7,2010 年报批稿)调查45 个品种的38 个性状。目测性状(VG/VS)按照测试指南判定性状代码,代码最小值为1,最大值为9,性状“穗:芒颜色(初期)”最大值为10;测量性状(MS)调查20 个个体,数据处理在Excel 2003 程序中进行。

表1 供试材料Table 1 List of cultivars used in this study
1.2.2 基因组DNA 的提取 基因组DNA 提取采用改进的SDS 方法:取水稻幼苗叶片0.5 g,剪碎,放入2 ml 离心管中,往离心管中加入液氮,放入研磨仪,磨成粉状后立即加入65 ℃预热的DNA 提取液800 μl 左右,剧烈摇动混匀,并在65 ℃水浴中保温30 ~50 min,保温期间摇动几次。冷却至室温后加入等体积三氯甲烷/异戊醇(24∶ 1),颠倒混匀,室温下静置5 ~10 min,使水相和有机相分层。12 000 g 离心10 min。移取上清液至另一2 ml 离心管中,加入约1.5 倍体积的预冷乙醇,轻缓颠倒混匀,经12 000 g 离心3 min 至分相,弃上清液。用70%乙醇溶液洗涤2 遍,自然条件下干燥后,加入200 μl 1 ×TE 缓冲液溶解沉淀。用琼脂糖凝胶电泳检测DNA 浓度和质量,将DNA 稀释到20 ng/μl。置于-20 ℃中保存备用。
1.2.3 引物 查阅文献,选择与部分农艺性状连锁的21 个分子标记和用于水稻品种DNA 鉴定的24个SSR 标记(表2),用于45 个水稻品种的标记基因型鉴定。引物由上海英骏生物技术有限公司合成。
1.2.4 PCR 扩增及扩增产物的检测 PCR 扩增反应在SENSQUEST labcycler PCR 仪上进行。反应总体积为10 μl,包括DNA 模板(20 ng/μl)1 μl,Super TaqMix 5 μl,正反向引物(10 μmol/L)各1 μl,双蒸水补足10 μl。PCR 反应程序为94 ℃预变性5 min,35 个循环(94 ℃30 s,55 ℃30 s,72 ℃30 s),72 ℃延伸10 min。扩增产物在8%非变性聚丙烯酰胺凝胶上80 V 恒电压上电泳分离,用硝 酸银法染色,拍照。
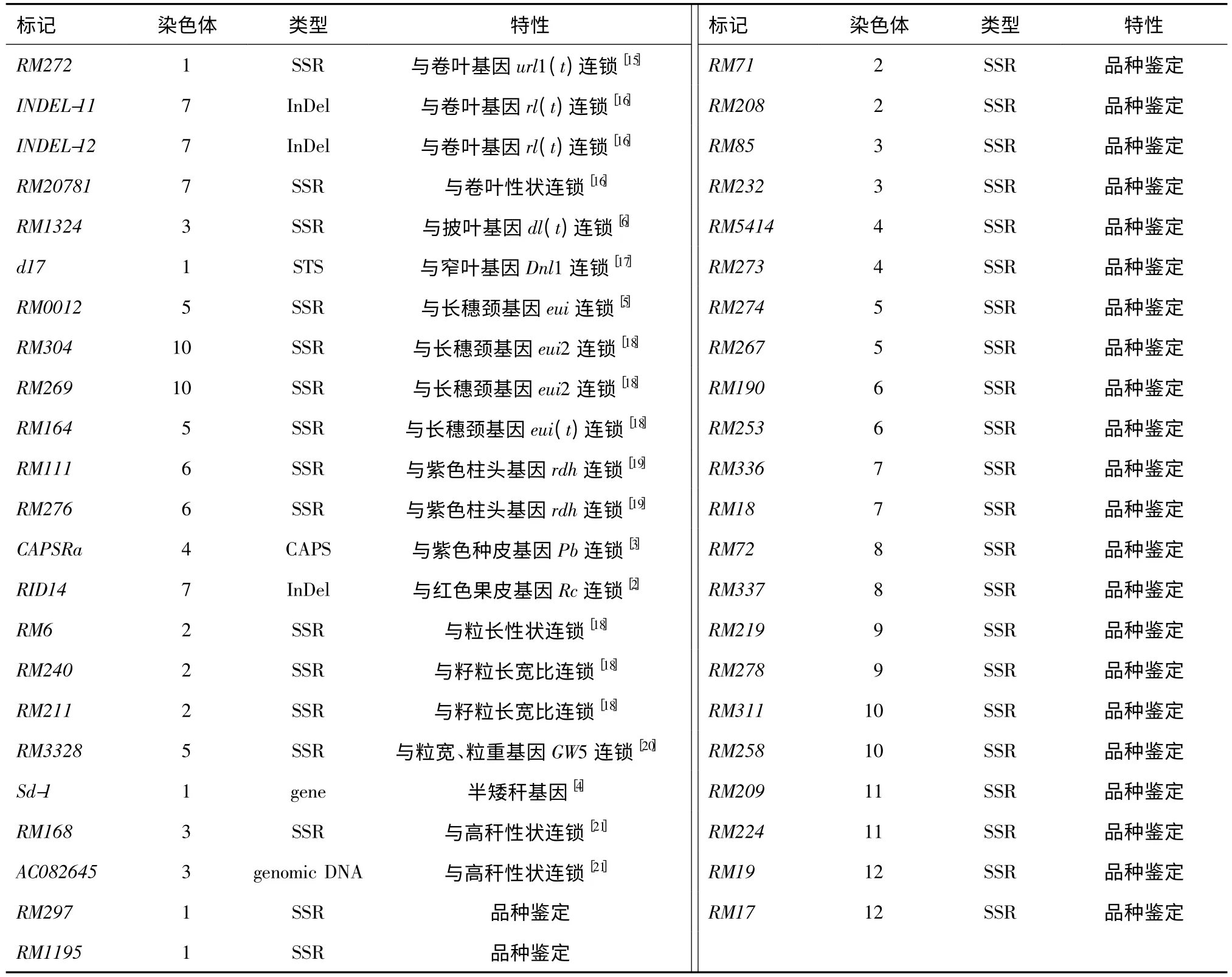
表2 45 个分子标记的基本信息Table 2 Basic information on 45 molecular markers
1.3 数据分析
1.3.1 群体结构分析 品种群体结构分析应用STRUCTURE 2.3.3 软件[22],对标准品种总群体进行基于数学模型的类群划分。首先确定亚群数,然后计算各品种归属第k 亚群的概率Q 值(第i 品种基因组变异源于第k 群体的概率)。在确定亚群数时,选择混合模型和独立等位基因频率模型,依次设定亚群数目(K)为1 ~10,将MCMC(Markov chain monte carlo)开始时的不作数迭代(Length of burn-in period)设为100 000次,再将不作数迭代后的MCMC设为100 000次,然后依据似然值最大的原则选取一个合适的K 值。
1.3.2 关联分析 与性状相关的分子标记的确认使用TASSEL 2.1 软件的GLM(General linear model)程序(http://www.maizegenetics.net/index.php?option = com_content&task = view&id =89&Itemid =119)。将STRUCTURE 2.3.3 软件运行后形成的Q值作为协变量,然后利用标记变异分别对水稻38 个性状的表型值逐一进行回归分析[23]。
2 结果与分析
2.1 水稻45 个品种38 个性状的变异分析
从表3、表4 可以看出,24 个目测性状的代码分布范围较广,试验材料在所分析的这些性状上有较大的变异。在品种总群体中,14 个测量性状变异幅度差异较大,其中性状“穗:最长芒长度”的变异系数最大,为108.64%,其次为“穗:抽出度”(66.03%),“植株:单株穗数”、“茎秆:长度(不包括穗)”和“穗:每穗粒数”的变异系数均超过30%,剑叶长度和剑叶宽度的变异系数分别为20.57%和22.10%,“抽穗期”、“茎秆:粗细”、“穗:长度”、“谷粒:长度”、“糙米:长度”和“糙米:宽度”变异系数为13% ~20%,“谷粒:宽度”的变异系数最小,为12.20%。说明供试水稻标准品种间各性状差异较大,具有较丰富的多样性,可为水稻品种的测试提供很好的参照。

表3 45 个水稻品种的目测性状Table 3 Visual test of 24 traits in 45 rice varieties

表4 45 个水稻品种的测量性状Table 4 Measurement of 14 trait in 45 rice varieties
2.2 水稻品种总群体的结构
利用STRUCTURE 2.3.3 软件,对水稻品种总群体进行结构分析,发现对数似然函数值在亚群数K=9 时最大(图1),因而确定该品种群体的适宜亚群数为9。确定亚群数为9 后,用STRUCTURE 2.3.3软件计算出每个品种归属于9 亚群的后验概率值(图2)。
2.3 与性状相关联的分子标记位点及其对表型变异的解释率

图1 对数似然函数值lnP(D)和K 值随亚群数的变化Fig.1 Changes of the log-likelihood function value lnP(D)and K value on the number of subgroups

图2 用STRUCTURE 2.3.3 软件计算的品种总群体中每个水稻品种归属于9 亚群的后验概率Fig.2 Posterior probability of each rice variety out of total variety population belonging to 9 subgroups calculated by STRUCTURE 2.3.3 software
对45 个位点与38 个性状进行关联分析,共检测到与23 个性状相关联(P <0.01)的20 个标记(表5)。与“基部叶:叶鞘颜色”、“倒二叶:叶耳花青苷显色”、“剑叶:叶片宽度”、“植株:生长习性”、“抽穗期”、“茎秆:长度(不包括穗)”、“穗:长度”、“穗芒有无”、“穗:芒颜色(初期)”、“穗:芒颜色(后期)”、“穗:分枝姿态”、“穗:每穗粒数”相关联的标记各有1 个,与“外颖:颖尖花青苷显色强度(初期)”、“小穗:柱头颜色”、“穗:最长芒长度”、“穗:抽出度”、“外颖:颖尖花青苷显色强度(后期)”、“谷粒:长度”、“糙米:长度”相关联的标记各有2个;与“茎秆:节花青苷显色”、“小穗:外颖茸毛密度”相关联的标记各有3 个;与“倒二叶:叶片绿色程度”相关联的标记有4 个;与“糙米:颜色”相关联的标记有5 个。其中标记RM111 与“基部叶:叶鞘颜色”、“倒二叶:叶片绿色程度”、“外颖:颖尖花青苷显色强度(初期)”、“小穗:柱头颜色”和“抽穗期”5 个性状相关联,与“基部叶:叶鞘颜色”和“小穗:柱头颜色”2 个性状极显著(P <0.01)相关,对5个性状变异的解释率分别为48.47%、26.09%、24.76%、39.31%和21.62%;标记AC082645 与“外颖:颖尖花青苷显色强度(初期)”、“茎秆:节花青苷显色”、“穗:芒颜色(初期)”、“穗:芒颜色(后期)”、“外颖:颖尖花青苷显色强度(后期)”、“糙米:颜色”和“穗:抽出度”7 个性状相关联,与“外颖:颖尖花青苷显色强度(初期)”极显著相关,分别解释7个 性 状 变 异 的 53.81%、44.46%、38.92%、40.30%、38.86%、59.37%和26.29%;标记RM278与“茎秆:长度(不包括穗)”、“小穗:外颖茸毛密度”、“穗:每穗粒数”和“谷粒:长度”4 个性状相关联,可以解释4 个性状变异的14.74%、12.73%、21.31%和16.32%。RM297 与“谷粒:长度”、“糙米:长度”和“糙米:颜色”3 个性状相关联,分别解释3 个性状变异的33.48%、36.55%、56.97%;标记RM85 与“倒二叶:叶片绿色程度”和“糙米:颜色”2个性状相关联,与“倒二叶:叶片绿色程度”极显著相关,对2 个性状变异的解释率分别为55.72%和35.76%;RM253 也与“倒二叶:叶片绿色程度”极显著相关;RM258 与“倒二叶:叶耳花青苷显色”、“糙米:长度”2 个性状相关联;RM276 与“小穗:柱头颜色”、“小穗:外颖茸毛密度”2 个性状相关联;RM232与“茎秆:节花青苷显色”、“穗:最长芒长度”2 个性状相关联;RM336 与“穗:最长芒长度”、“穗:抽出度”2 个性状相关联;RM168 与“穗:长度”相关联;与“茎秆:节花青苷显色”相关联的标记中RM304 和RM232 与“茎秆:节花青苷显色”极显著相关,其变异的解释率分别达到67.19% 和48.94%;标记RM3328 与“植株:生长习性”极显著相关,变异的解释率56%。
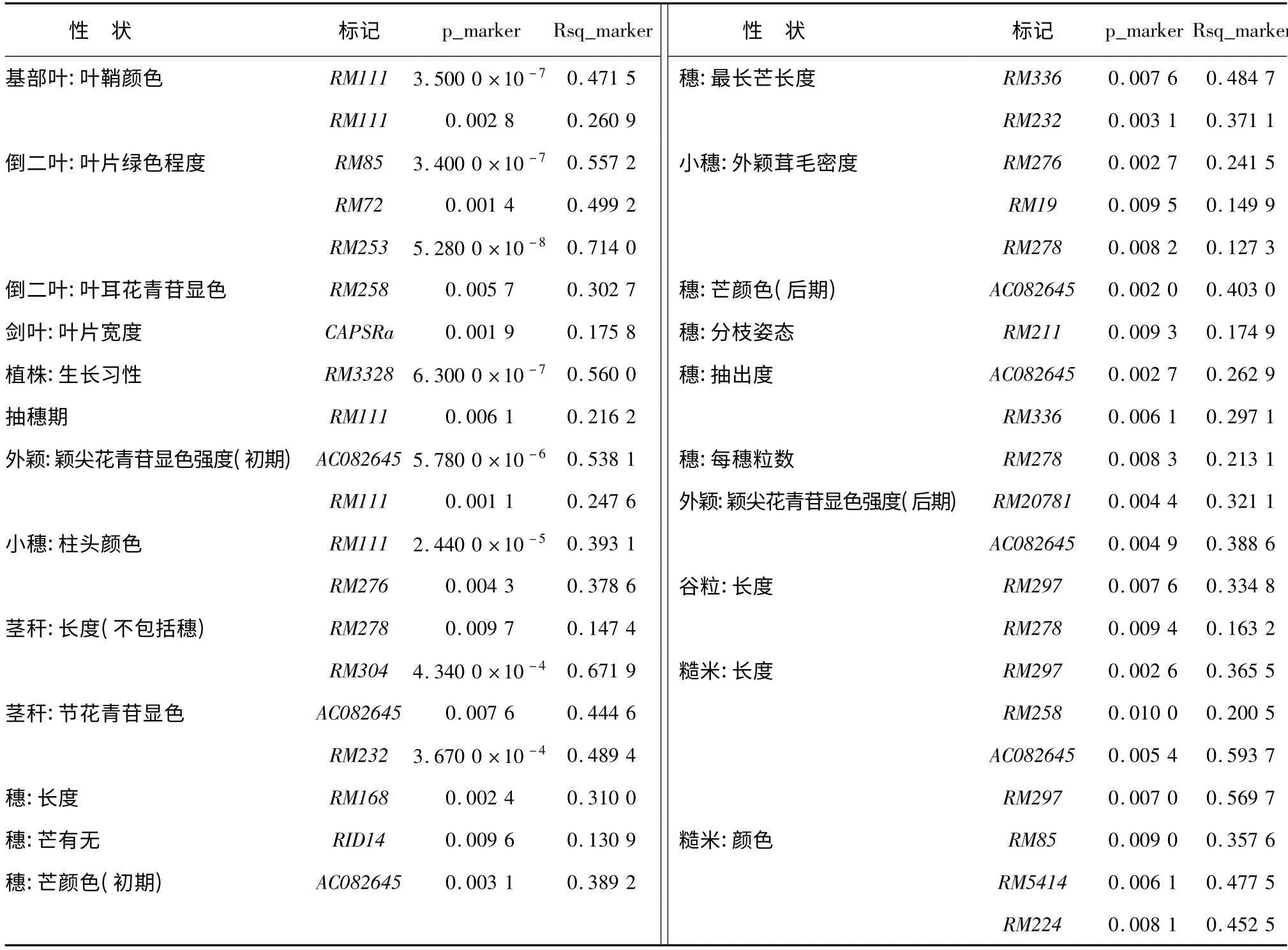
表5 与性状显著相关的标记位点及其对表型变异的解释率Table 5 Marker loci significantly associated with traits and the contributions to phenotypic variation
3 讨论
本研究在45 个水稻品种中共检测到20 个与23 个DUS 测试性状相关联的分子标记。其中AC082645 标记同时与7 个性状关联,RM111 标记同时与5 个性状关联,RM278 同时与4 个性状关联,RM297 同时与3 个性状关联,其它16 个标记与1 个或2 个性状关联。与AC082645 相关联的7 个性状中,6 个不同器官部位与颜色有关的性状“茎杆:节花青苷显色”、“外颖:颖尖花青苷显色强度(初期)”、“外颖:颖尖花青苷显色强度(后期)”、“穗:芒颜色(初期)”、“穗:芒颜色(后期)”、“糙米:颜色”与之相关联,其中与“外颖:颖尖花青苷显色强度(初期)”达到了极显著相关,对该性状的解释率达到53.81%。说明AC082645 位点与控制水稻不同器官部位的花色素苷基因有关。与RM111 相关联的5 个性状中,“基部叶:叶鞘颜色”、“倒二叶:叶片绿色程度”、“外颖:颖尖花青苷显色强度(初期)”、“小穗:柱头颜色”均是花色素基因控制的性状。RM111 与“基部叶:叶鞘颜色”和“小穗:柱头颜色”两性状达到极显著相关,对两性状的解释率分别为47.15%和39.31%。中国水稻研究所范方军等[24]研究发现水稻第6 染色体短臂色素原基因C与RM111 和RM253 连锁。韩磊等[19]对rdh 紫色柱头定位群体的研究结果显示,位于水稻第6 染色体的RM276、RM253 以及RM111 标记与rdh 紫色柱头基因有连锁关系。本研究结果也显示RM253 与“倒二叶:叶片绿色程度”极显著相关,该标记对性状解释率达到了71.4%;RM276 与“小穗:柱头颜色”相关联,与前人的研究结果一致。本研究结果还显示,RM85、RM72 与“倒二叶:叶片绿色程度”相关联,RM258 与“倒二叶:叶耳花青苷显色”相关联,RM304、RM232 与“茎秆:节花青苷显色”相关联,RM20781 与“外颖:颖尖花青苷显色强度(后期)”相关联,RM85、RM5414、RM224 和RM297 与“糙米:颜色”相关联,其中RM85 与“倒二叶:叶片绿色程度”和RM304、RM232 与“茎秆:节花青苷显色”达到极显著相关,这3 个标记对相关性状的解释率分别为55.72%、67.19%和48.94%。
与AC082645 相关联的性状“穗:抽出度”,实际也就是育种上常用的穗颈性状。1981 年,Rutger 和Carnahan 在粳稻杂交后代中发现1 个最上节间明显伸长的高秆隐性突变体,并将控制该性状的基因命名为eui(Elongateduppermost internode)[25]。随后,国内外的一些学者Kita 等[26]、Librojo 等[27]、吴玉良等[28]、杨蜀岚等[29]对eui 基因进行了初步定位。张所兵等[5]将长穗颈eui 基因定位在第5 染色体上的RM3673 和RM0012 之间。马玉银等[21]运用一个高秆突变体对水稻的隐性高秆基因进行研究,发现1个新的隐性高秆基因lc3 与第3 条染色体上RM168与AC082645 共分离。本研究中AC082645 与“穗:抽出度”相关联,与前人报道的相近。
在已有报道中CAPSRa 与紫色种皮基因Pb 连锁,RID14 与红色种皮基因Rc 连锁[2-3],但在本研究中未发现这两个标记与“糙米:颜色”相关。这可能是由于CAPSRa 只与紫皮和白皮性状连锁,RID14只与红皮和白皮性状连锁。而在本研究中,水稻DUS 测试指南中将“糙米:颜色”性状分为白色、浅棕色、棕色斑驳、深棕色、浅红色、红色、紫色斑驳、紫色和紫黑色9 级,颜色分级过细致使CAPSRa 和RID142 标记未检测出与“糙米:颜色”性状的关联。RID14 是杨杰等[2]根据普通野生稻(O. rufipogon)红色果皮基因Rc 的cDNA 序列设计的引物而开发的标记,该标记与野生稻存在较大的相关性。本研究中发现RID14 与“穗:芒有无”显著相关,而芒的有无是野生稻和栽培稻的区别之一,野生稻都是有芒的,栽培稻中有的有芒,有的无芒,所以RID14 标记可以用于水稻的起源研究中。
除上述相关联的标记与性状外,本研究还发现RM3328 与“植株:生长习性”极显著相关,该标记对性状的解释率达到了56.00%;以及RM278 与“茎秆:长度(不包括穗)”相关联的SSR 标记,RM336 与“穗:抽出度”相关联的SSR 标记,RM168 与“穗:长度”相关联的SSR 标记,RM232、RM336 与“穗:最长芒长度”相关联的SSR 标记,RM278 与“谷粒:长度”相关联的SSR 标记,RM258、RM297 与“糙米:长度”相关联的SSR 标记,RM278 与“穗:每穗粒数”相关联的SSR 标记,RM278、RM276、RM19 与“小穗:外颖茸毛密度”相关联的SSR 标记。在籼、粳稻的许多差别中,谷粒和颖毛的差别最为明显,籼稻谷粒细长,颖毛短而散生;粳稻谷粒宽而厚,颖毛长而密生。本研究中用于品种鉴定的部分与水稻DUS 测试性状存在紧密关联的SSR 标记,可以为水稻的籼粳分类研究提供参考信息。
[1] UPOV. Document TG/1/3 General introduction to the examination of distinctness,uniformity and stability and the development of harmonized descriptions of new varieties of plants[S].2002.
[2] 杨 杰,王 军,曹 卿,等.杂草稻红色果皮基因的功能标记开发[J]. 分子植物育种,2009,7(4):721-726.
[3] 王彩霞,舒庆尧. 水稻紫色种皮基因Pb 的精细定位与候选基因分析[J]. 科学通报,2007,52(21):2517-2523.
[4] CHO Y G,DARVASI A. Optimu spacing of genetic markers for determining linkage between marker loci and quantitative trait loci[J]. Theor Appl Genet ,1994,89:54-55.
[5] 张所兵,朱 镇,赵 凌,等. 水稻长穗颈基因eui 紧密连锁SSR 标记获得[J]. 遗传,2007,29(3):365-370.
[6] 王 楠,赵芳明,凌英华,等. 一个水稻披叶突变体的遗传分析和基因定位分子植物育种[J]. 分子植物育种,2007,5(1):54-58.
[7] 高 虹,王嘉宇,姜树坤,等. 水稻粒长基因GL3 的遗传分析和分子标记定位[J]. 植物生理学通讯,2010,46(3):236-240.
[8] LI X B,YAN W G,AGRAMA H,et al. Mapping QTLs for improving grain yield using the USDA rice mini-core collection [J].Planta,2011,234:347-361.
[9] 陈 兰,张 红,张启武,等. 水稻6 个异交相关性状的SSR 关联分析[J]. 南京农业大学学报,2012,35(2):1-9.
[10] 文自翔,赵团结,郑永战,等. 中国栽培和野生大豆农艺及品质性状与SSR 标记的关联分析Ⅰ:群体结构及关联标记[J].作物学报,2008,34(7):1169-1178.
[11] BRESEGHELLO F,SORRELLS M E. Association mapping of kernel size and milling quality in wheat(Triticum aestivum L.)cultivars[J]. Genetics,2006,172:1165-1177.
[12] 武玉国,吴承来,秦保平,等. 黄淮冬麦区175 个小麦品种的遗传多样性及SSR 标记与株高和产量相关性状的关联分析[J].作物学报,2012,38(6):1018-1028.
[13] YAN W G,LI Y,AGRAMA H A,et al. Association mapping of stigma and spikelet characteristics in rice(Oryza sativa L.)[J].Molecular Breeding,2009,24:277-292.
[14] HUANG X H,WEI X H,SANG T,et al. Genome-wide association studies of 14 agronomic traits in rice landraces[J]. Nature Genetics,2010,42:961-969.
[15] 余 东,吴海滨,杨文韬,等. 水稻单侧卷叶突变体B157 遗传分析及基因初步定位[J]. 分子植物育种,2008,6(2):220-226.
[16] 施勇烽,陈 洁,刘文强,等. 一个新的水稻卷叶突变体的遗传分析与基因定位[J]. 中国科学(C 辑:生命科学),2009,39(4):407-412.
[17] 曾生元,郭 旻,李 敏,等. 一个水稻动态窄叶突变体的鉴定和基因定位[J]. 科学通报,2010,55(21):2106-2111.
[18] 陈 瑞,程在全,黄兴奇,等. 水稻优良性状控制基因的定位进展及其在染色体上的分布[J]. 遗传,2007,29(4):399-412.
[19] HAN L,ZHANG T,XU J D,et al. Genetic analysis and gene mapping of purple stigma in rice[J] . Acta Genetica Sinica,2006,33(7):642 -646.
[20] WENG J F,GU S H,WAN X Y,et al. Isolation and initial characterization of GW5,a major QTL associated with rice grain width and weight[J]. Cell Research,2008,18(12):1199-1209.
[21] 马玉银,李 磊,李育红,等. 一个新的水稻隐性高秆突变体的遗传分析和基因定位[J]. 中国农业科学,2008,41(12):3967-3973.
[22] PRITCHARD J K,WENA X,FALUXH D. Documentation for structure software:version 2.3[CP/OL]. Chicago:Department of Human Genetics,University of Chicago,2010[2012-09-12].http://pritch. bsd. uchicago. edu/structure_software/release_versions/v2.3.3/structure_doc.pdf.
[23] BRADBURY P J,ZHANG Z,KROON D E ,et al. TASSEL:software for association mapping of complex traits in diverse samples[J]. Bioinformatics,2007,23:2633-2635.
[24] 范方军,樊叶杨,庄杰云,等. 水稻色素原基因C 的精细定位[J]. 中国水稻科学,2007,21(5):454 -458.
[25] TUTGER J N,CARNAHAN H L. A forth genetic element to facilitate hybrid cereal production—a recessive tall in rice[J]. Crop Science,1981,21:373-376.
[26] KITA M M. F1 Interaction of eui gene for the elongation of uppermost internode and some genes for elongation of internode[J].Japanese Journal of Plant Breeding,1983,33 (11):124-125.
[27] LIBROJO L,KHUSH G S. Chromosomal location of some mutant genes through the use of primary trisomics in rice[C]. Manila:Island Press Inc,1986:249-255.
[28] 吴玉良,何祖华,董继新,等. 水稻株高基因eui 的初步定位[J]. 中国水稻科学,1998,12(2):119-120.
[29] 杨蜀岚,马洪丽,张书标,等. 水稻长穗颈高秆隐性基因eui2的分子标记和定位[J]. 福建农业大学学报,2002,31(4):480-483.

