树干毕赤酵母基因组文库的构建及纤维二糖酶基因的筛选
马经纬 , 张 梁 *, 薛 卫 , 石贵阳
(1.工业生物技术教育部重点实验室,江南大学,江苏 无锡 214122;2.粮食发酵工艺与技术国家工程实验室,江南大学,江苏 无锡 214122;3.南京农业大学 信息科学技术学院,江苏 南京 210095)
随着分子生物学技术的迅猛发展,发现新基因、研究新基因的功能已经成为功能基因组研究的热点。生物工程产业化更需要分离出有应用价值的新基因[1]。构建DNA基因组文库是功能基因组学研究的基本手段,一个物种的基因组DNA包含了它所有的遗传信息基因,可真实反映出基因组的全部信息[2]。基因组文库不仅保存物种的遗传信息,而且提供了一个筛选基因的平台,可用于分离鉴定具有特定功能的基因[3-4]。
树干毕赤酵母(Pichia stipitis)不仅可以发酵木糖、葡糖糖、甘露糖、半乳糖,还可以发酵纤维二糖和木二糖,对于纤维质原料发酵产燃料乙醇具有重要意义[5-6]。树干毕赤酵母已被证明具有良好的转运和利用纤维二糖的能力,但该菌株产酒精的能力有限,无法在工业规模应用[7]。近年来也有许多学者通过改变发酵条件提高树干毕赤酵母发酵产乙醇的得率,但其生产能力距工业化还有一定的距离,这就凸显出通过基因手段改造得到理想菌株尤为重要。
目前,对于树干毕赤酵母的木糖利用酶系的研究已经取得一定的进展,树干毕赤酵母基因组测序也已经初步完成。但是,树干毕赤酵母基因水平的研究正处于起步阶段,许多关键的功能基因并没有标注,能够检索到的文献甚少。其中,在其转运和利用纤维二糖方面的研究基本空白,仅推测得知该酵母基因组中有7个编码β-葡萄糖苷酶的基因[8-9]。课题组前期根据文献[9]对预测的7个基因进行了PCR扩增,并连接表达载体后转入酿酒酵母进行表达验证,但均未检测获得纤维二糖酶活性。
鉴于此,构建树干毕赤酵母的DNA基因组文库,不仅将树干毕赤酵母的遗传信息以稳定的重组体形式储存起来,还可从中筛选、克隆和验证出新基因。
1 材料与方法
1.1 材料
1.1.1 菌株和载体 树干毕赤酵母CBS 5773,大肠杆菌JM109,酿酒酵母W303-1A,均保藏于江南大学中国高校工业微生物资源和信息中心;载体YEpLac181,由作者所在实验室保藏。
1.1.2 其他材料 蛋白胨和酵母膏,购自英国OXOID公司;蜗牛酶,购自Fermentas公司;Sau3AⅠ和BamHⅠ限制性内切酶,均购自NEB公司;氨苄青霉素,购自上海生工生物工程公司;X-Gal,IPTG,T4DNA连接酶,购自宝生物工程有限公司;其他试剂和药品,均为国产或进口分析纯。
1.2 树干毕赤酵母染色体DNA的提取
接种树干毕赤酵母于YEPD液体培养基中,30℃,200 r/min摇床过夜培养。取2 mL培养物至5 mL的离心管中,6 000r/min离心5min收集菌体;加入0.5mL酵母染色体提取试剂Ⅰ (0.1 mol/L Na2EDTA+0.9 mol/L山梨醇,pH 7.5)重悬菌体;加入30 μL的5 mg/mL蜗牛酶酶解细胞壁,37℃处理至大多数细胞形成原生质体;6 000 r/min离心5 min,弃上清液;加入0.5 mL酵母染色体提取试剂Ⅱ(20 mmol/L Na2EDTA+50 mmol/L Tris-HCl,pH 7.4)重悬菌体,并加入50 μL质量分数10%SDS,65℃保温30 min裂解细胞;加入200 μL 5 mol/L醋酸钾溶液,冰浴1 h;8 000 r/min离心8 min;取上清液移至干净离心管中,在冰上加入等体积的异丙醇,放置15 min;6 000 r/min离心5 min;弃上清液,用体积分数75%的酒精洗涤沉淀两次;待沉淀物干燥后加入适量的TE缓冲液(pH 7.4)或无菌水使溶解沉淀,-4 ℃保存[10]。
1.3 载体的制备
碱裂解法大量提取YEpLac181质粒,经BamHⅠ酶切成线形,纯化回收后用CIAP对YEpLac181/BamHⅠ去磷酸化处理。
1.4 树干毕赤酵母基因组文库的构建及验证
采用微量稀释法用内切酶Sau3AⅠ部分酶切基因组DNA,同时取处理为线性的质粒YEpLac181,Sau3AⅠ和BamHⅠ为同尾酶,利用T4DNA连接酶16℃将二者过夜连接,将连接产物转化大肠杆菌JM-109感受态细胞,涂布含100 μg/mL的氨苄青霉 素 、20 μL 100 mg/mL 的 IPTG 和 100 μL 20 mg/mL的X-gal的LB平板,37℃恒温箱培养,随机挑取白色菌落接种于含100 μg/mL的氨苄青霉素的LB液体培养基,37℃摇床过夜培养,提取出质粒BamHⅠ酶切电泳验证。
1.5 基因组文库的保存
将蓝白斑筛选所得白色菌落计数,用无菌牙签将平板上的白色单菌落分别挑至无菌的96孔板,每个孔有100 μL含100 μg/mL的氨苄青霉素 LB液体培养基,封口膜封死37℃恒温箱过夜培养,加等体积的体积分数30%的甘油保存于-70℃。
1.6 基因组文库的评估
根据所获得的基因组文库的克隆子的数目及平均插入片段的大小,依据公式:库容量=文库中阳性克隆子的数目×插人片段的平均大小/该生物基因组的大小计算出该基因组文库的库容量的大小。
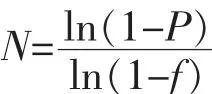
根据Clarke-Carbon公式[11],N为当要求的克隆概率为P时,一个基因组文库中所需的含有重组DNA的克隆数;P为克隆概率,即任一DNA片断至少一份拷贝存在于该文库的概率;f为限制片断的平均长度与基因组DNA总长度之比。计算基因组文库中所需的含有重组DNA的克隆数。
1.7 从文库中筛选纤维二糖酶相关基因
分别提取构建好的文库大肠杆菌中的重组质粒,用醋酸锂转化法将所提的质粒转入酿酒酵母W303-1A中做游离表达,涂布YNBC平板30℃培养4 d左右。
挑取能够在YNBC平板生长的酵母转化株接种于YEPD液体培养基30℃摇床过夜培养,pNPG法测定纤维二糖酶酶活[12]。每分钟每毫升酶液水解产生1 μmol对硝基酚(pNP)所需要的酶量定义为一个酶活单位。方法如下:离心分离菌体和发酵液,将所得菌体用超声波破碎仪破碎细胞,离心分离胞内液体和细胞碎片。分别取0.2 mL经适当稀释或浓缩的发酵液上清液、细胞碎片和胞内液,加入1.8 mL 0.2 mol/L Na2HPO4+0.1 mol/L柠檬酸缓冲液(pH 4.5),30℃预热10 min后,加入已预热的5 mmol/L对硝基酚-β-D-吡喃葡萄糖苷(pNPG)溶液2 mL,反应10 min后立即加入2 mL 1 mol/L的碳酸钠溶液终止反应,室温放置5 min后于400 nm处测定吸光度。以加热失活的酶液按照同样方法处理作空白。取转化株所对应质粒的插入片段测序,得到纤维二糖酶相关基因序列。
1.8 生物信息学手段分析纤维二糖酶相关基因
将测序得到的碱基序列导入NCBI数据库中的BLAST程序进行碱基同源性分析;将碱基序列翻译成氨基酸利用SWISS-MODEL(http://swissmodel.expasy.org/)工具进行三维建模。
2 结果与分析
2.1 树干毕赤酵母基因组文库的构建
由于树干毕赤酵母染色体基因组较大,用普通限制性内切酶HindⅢ和BamHⅠ等酶切8 h均未能获得较为理想的片段组合。经过反复试验,最终选择采用Sau3AⅠ酶,该酶是识别4 bp的限制性内切酶,完全酶切会产生平均256 bp的片段。通过微量稀释法设置时间梯度和酶活梯度,对染色体基因组进行酶切处理,确定了树干毕赤酵母染色体基因的最佳酶切条件。
经质量分数1%的琼脂糖凝胶电泳检测,树干毕赤酵母染色体经限制性内切酶Sau3AⅠ稀释100倍酶切6 h的片段大小在0.5 kb~8 kb之间,大多数片段在5 077 bp处,如图1所示。

图1 树干毕赤酵母染色体经Sau3AⅠ酶切片段1%的琼脂糖凝胶电泳Fig.1 P.stipitis chromosome digested by Sau3AⅠwas analyzed by electrophoresis on 1%agarose gel
随机挑取蓝白斑筛选所得白色菌落接种含100 μg/mL的氨苄青霉素的LB液体培养基,37℃摇床过夜培养,提取出质粒BamHⅠ酶切质量分数1%的琼脂糖凝胶电泳验证,如图2所示。

图2 质粒经BamHⅠ酶切1%的琼脂糖凝胶电泳,2为空载的线性化载体YEpLac181Fig.2 Plasmids digested by BamHⅠwas analyzed by electrophoresis on 1% agarose gel,2 was YEpLac181 digested by BamHⅠ
共涂布10块平板,每块平板大约得300多个白斑,55个蓝斑,共计得到300个阳性克隆子。根据公式计算出该基因组文库的库容量为:库容量=3 000×5 000/15 441 179=97%。即该文库中所含插入片段的总长度为树干毕赤酵母基因组的0.97倍。
根据Clarke-Carbon公式,已知P=97%,即从该文库筛选到树干毕赤酵母任一DNA序列的精确概率为97%。计算得到N为1.08,即该文库已经覆盖了树干毕赤酵母的所有基因。
2.2 纤维二糖酶相关基因的筛选
根据1.7步骤,筛选获得唯一一株能够在YNBC平板生长的酿酒酵母转化株,接种YEPD液体培养基30℃过夜培养后,离心分离发酵液上清液和菌体,将菌体超声波破碎离心分离胞内液和细胞碎片,pNPG法分别测定发酵液上清液、胞内液和细胞碎片的纤维二糖酶酶活,结果见表1。在细胞碎片中测到纤维二糖酶酶活,说明该基因编码的蛋白质可在细胞间质处起作用。
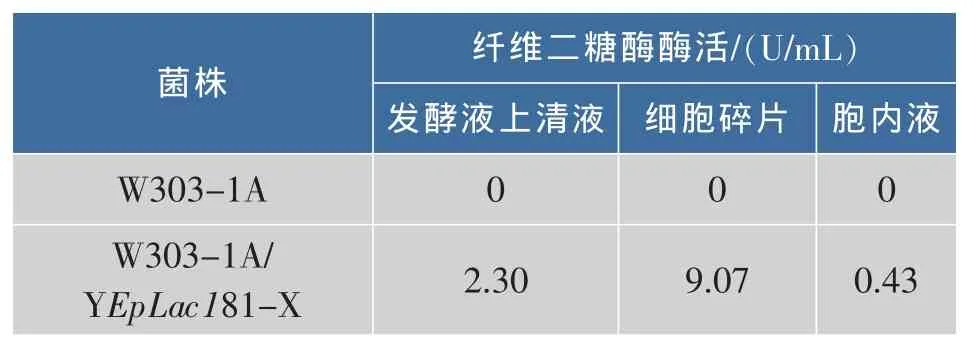
表1 发酵液上清、细胞碎片和胞内液酶活比较Table 1 Cellobiase activity of supernatant of the medium,the cell wall and cell extracts
提取转化株所对应的质粒,BamHⅠ酶切后琼脂糖凝胶电泳,如图3所示。将插入片段胶回收纯化后测序,得到一段1 821bp的碱基序列。
图3 转化株对应质粒BamHⅠ酶切后1%琼脂糖凝胶电泳Fig.3 Plasmid of transformation digested by BamHⅠwas analyzed by electrophoresis on 1%agarose gel
2.3 纤维二糖酶相关基因的分析
将测序得到的碱基序列导入BLAST程序没有检索到同源序列;利用SWISS-MODEL工具三维建模失败。
3 结语
基因组文库的构建载体的浓度和纯度的高低都直接关系到文库构建的成败,空载的多少直接影响到文库的质量。为了避免空载现象,采取大提质粒以增加载体的浓度,酶切成线性化后跑琼脂糖凝胶电泳验证,将完全酶切呈线性的载体进行胶回收防止污染,纯化后用CIAP进行脱磷处理以防止载体自连现象,再次琼脂糖凝胶电泳回收纯化备用。
高质量的染色体基因是另一个构建完整文库的影响因素,树干毕赤酵母染色体的各种提取方法原理相通,仅破裂细胞方法不同,大体分为物理法和酶法。物理法有液氮研磨法和玻璃珠震荡破碎法,这种方法由于震动剧烈会使细胞核破裂从而染色体断裂;而酶法采用蜗牛酶破壁形成原生质体,再碱裂解细胞,相对温和,大大减少了染色体的断裂。染色体DNA的处理可以用物理机械剪切,也可以用限制性酶消化。机械切割法可获得较均一的随机片段,但片段不能直接用于克隆,需要经过末端修饰,连上接头后再用限制性内切酶消化产生黏性末端;直接用限制酶消化的方法则可以直接产生黏性末端,大大减少了工作量。
酵母菌中能够降解纤维二糖的菌株很少,树干毕赤酵母是其中比较重要的一种,虽然有研究根据同源性预测了其纤维二糖酶基因信息[8],但通过实验无法验证其具有活性(数据另发)。本课题研究中通过构建树干毕赤酵母基因组文库,以纤维二糖酶对底物纤维二糖的底物特异性筛选文库所含基因,获得一段P.stipitis来源的纤维二糖酶基因。该基因通过反复表达验证,具有明显的纤维二糖水解活性。但其碱基序列通过BLAST检索结果均为预测序列或未知序列,未找到同源序列,三维建模也没有成功,表明该基因是一个新基因,这为树干毕赤酵母纤维二糖代谢机理的研究提供了一个新的切入口,具有一定的学术意义。课题组接下来将进一步对所获得的基因进行功能和调控机理等分析,并构建高效利用纤维二糖的重组工业酒精酵母菌株。
[1]Quiniou S M,Waldbieser G C,Duke M V,et al.A first generation BAC based physical map of the channel catfish genome[J].BMC Genomics,2007,8:40.
[2]Jung S,Main D,Staton M,et al.Synteny conservation between the Prunus genome and both the present and an cestral Arabidopsis genomes[J].BMC Genomics,2006(7):81.
[3]Zhebentyayeva T N,Swire-Clark G,Georgi L L ,et al.A frame work physical map for peach ,a model Rosaceae species[J].Tree Genetics and Genomes,2008(4):745-756.
[4]Chan A K N,Wang Y Y,Ng K,et al.Cloning and characterization of a novel cellobiase gene,cba3,encoding the first knownβglucosidase of glycoside hydrolase family 1 of Cellulomonas biazotea[J].Gene,2012,493(1):52-61.
[5]Parekh S,Wayman M.Fermentation of cellobiose and wood sugars to ethanol by Candida shehatae and Pichia stipiti[J].Biotechnolgy Letters,1986(8):597-600.
[6]Parekh S R,Parekh R S,Wayman M.Fermentation of xylose and cellobiose by Pichia stipitis and Brettanomyces clausenii[J].Applied Biochemistry and Biotechnology,1988,18:325-338.
[7]Passoth V,Cohn M,Schafer B,et al.Analysis of the hypoxia-induced ADH2 promoter of the respiratory yeast Pichia stipitis reveals a new mechanism for sensing of oxygen limitation in yeast[J].Yeast,2003,20(1):39-51.
[8]Jeffries T W,Grigoriev I V,Grimwood J,et al.Genome sequence of the lignocellulose-bioconverting and xylose-fermenting yeast Pichia stipitis[J].Nature Biotechnol,2007,25(3):319-26.
[9]Jeffries T W,Jennifer R,Vleet H V.Pichia stipitis Genomics,transcriptomics,and gene clusters[J].FEMS Yeast Research,2009(9):793-807.
[10]Sambrook J,Russel D.Molecular Cloning:a Laboratory Manual,third ed[M].New York:Cold Spring Harbor,Cold Spring Harbor Laboratory Press,2001:485-486.
[11]萨姆布鲁克·J,拉塞尔·D·W.分子克隆实验指南[M]//第2版.金冬雁,黎孟枫,译.北京:科学出版社,1992:399.
[12]Guo Z P,Zhang L,Ding Z Y,et al.Development of an industrial ethanol-producing yeast strain for efficient utilization of cellobiose[J].Enzyme and Microbial Technology,2011,49:105-112.

