枯草芽孢杆菌氨肽酶超滤提取技术
曹松龙, 田亚平
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
氨肽酶是一类从蛋白质或肽链的N端酶切氨基酸残基的外肽酶的总称[1]。氨肽酶种类繁多,不同氨肽酶对N端氨基酸残基的水解能力不同。即使同一类氨肽酶对不同N端氨基酸残基的水解能力也有一定的差异。氨肽酶在食品行业、医学研究等方面具有广泛的应用。在食品行业,氨肽酶常被应用于各种蛋白质的深度水解以及水解后的脱苦方面,通过氨肽酶的水解可以提高游离氨基酸的含量,改善风味,增加营养价值;在脱苦方面,它可以避免化学试剂的使用所可能带来的有毒物质。其次,利用氨肽酶制备活性多肽目前也越来越普遍,并且是一种安全高效的方法。另外在医学研究中,氨肽酶还可以作为医疗诊断用酶。
目前膜分离技术在酶制剂工业的应用越来越广泛[2-3]。膜分离技术具有物质不发生相态变化、不消耗相变能、耗能耗质少、效率高等特点,可以应用于酶的浓缩和分离过程[4-7]。采用膜分离技术不仅酶活损失小,而且操作简单,易于实现工业规模的放大[8-10]。作者应用超滤技术对枯草芽孢杆菌氨肽酶进行一定程度的浓缩[11]及脱盐,所得浓缩脱盐发酵液为进一步提取创造了良好基础。
1 材料与方法
1.1 试剂与仪器
枯草芽孢杆菌发酵液:本实验室自制,并经过离心除菌、质量分数18%的(NH4)2SO4澄清的操作。L-亮氨酸-4-硝基苯胺 (AR),美国Alfa公司产品。超滤装置:FILTECH-UF101型,上海弗立特实业有限公司产品;3种PES卷式超滤膜,截留分子量分别为 10、30、50 kDa;尺寸 35 mm×250 mm;有效过滤面积为0.1 m2。722型分光光度计,上海第三分析仪器厂制造;电热恒温水浴锅,上海医疗器械五厂制造。
1.2 实验方法
1.2.1 超滤方法 超滤操作包括浓缩和洗脱脱盐两个过程。具体操作:将发酵结束后经预处理的发酵液加到超滤系统中进行浓缩,当浓缩到一定程度时,开始定时加水洗脱,直到发酵液中的盐基本除去,停止加水,最后再将其浓缩到合适的倍数。
1.2.2 洗膜方法 配制0.01 mol/L的NaOH溶液,在操作压力0.15 MPa的条件下反复清洗,之后再用去离子水清洗,直到滤液澄清且膜通量恢复到98%左右为止。最后将卷式膜从超滤装置中取出,贮存于0.01 mol/L的NaOH溶液中。
1.3 测定方法
1.3.1 氨肽酶酶活测定方法 采用LNA法[12],测定时,首先加入一定量的Tris-HCl缓冲液和底物(L-亮氨酸-4-硝基苯胺 L-leu-pNA),然后再加入一定量稀释一定倍数的粗酶液,在50℃水浴反应10 min后,405 nm比色测定酶活。酶活力定义:在50℃水浴下,每分钟分解L-亮氨酸-4-硝基苯胺产生1 μmol的硝基苯胺所需酶量定义为一个酶活单位。
1.3.2 膜通量测定方法 采用量筒接滤出液,同时用秒表计时,最后根据结果计算出单位时间单位膜面积的流出量,即为膜通量。详见文献[13]。
1.3.2 蛋白质含量测定方法 采用福林酚法[14]。
1.3.3 残留(NH4)2SO4测定方法 采用BaCl2来检验SO42-的残留情况,进而判断(NH4)2SO4的去除情况。
2 结果与讨论
依据先前的研究,初步确立了一种提取枯草芽孢杆菌液体氨肽酶的方法。枯草芽孢杆菌的原始发酵液,经离心、澄清、超滤浓缩、脱盐、醇沉后再溶解获得液体氨肽酶。提取工艺整个流程图如图1所示。
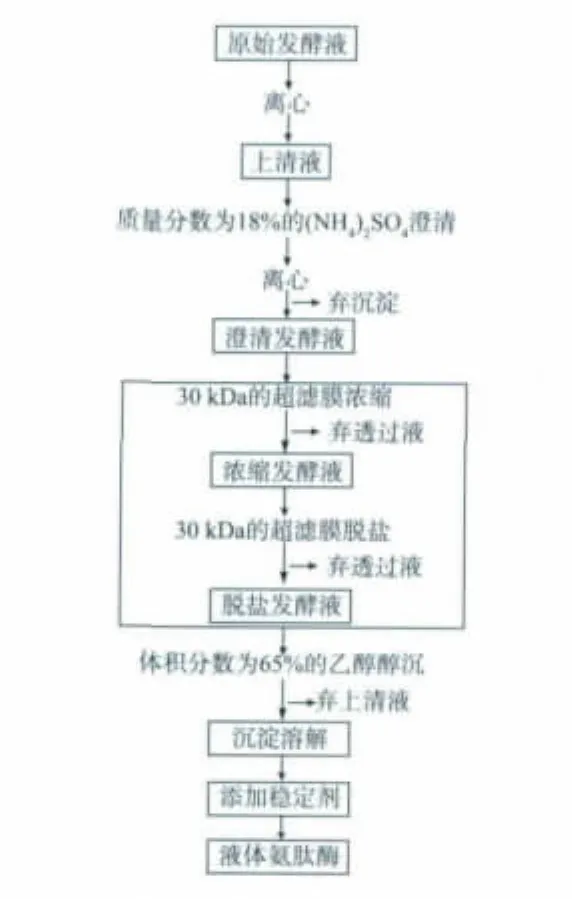
图1 提取工艺流程Fig.1 Process of the extraction
本文中主要对超滤浓缩、脱盐过程的各种参数进行优化,提高该过程酶活回收率,以及获得相对高的膜通量。
2.1 不同截留分子量的PES膜的选择
由先前文献报道,知该氨肽酶的分子量约为75 kDa[14],故选择 10、30、50 kDa 这 3 种不同截留分子量的PES膜进行研究。将发酵液浓缩到一定倍数后,选择酶活回收率高且膜通量较大的这种膜,结果见表1。
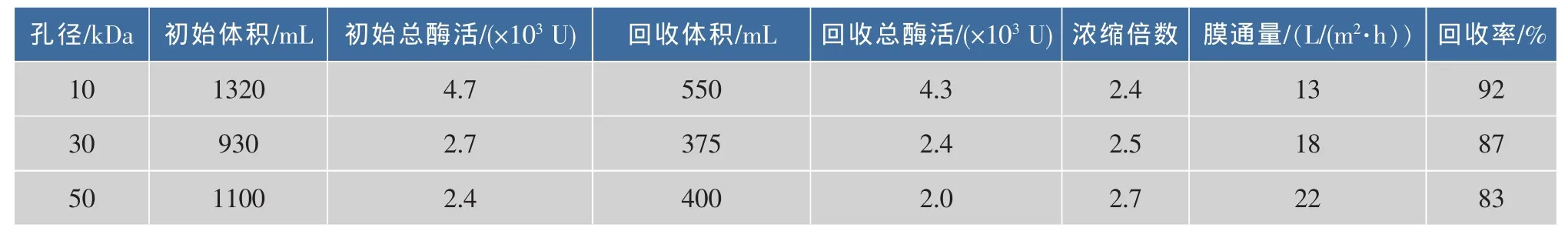
表1 超滤结果Table 1 Results of ultrafiltration
由表1可知,10 kDa的PES膜过滤后酶活回收率相对较高,达到90%以上,但膜通量太小;50 kDa的PES膜膜通量最高,但酶活回收率太低;只有30 kDa的PES膜既有相对较高的酶活,又有相对高的膜通量。主要原因可能是酶蛋白质分子本身形状不规则,膜孔径大小不一,酶蛋白质分子在膜中通过率不同,从而引起酶活回收率改变以及膜通量的差异。综上分析,选择30 kDa的PES膜进行超滤操作。
2.2 不同操作压力对酶活与膜通量的影响
在超滤过程中,维持发酵液的温度在20℃左右, 通过控制不同的操作压力 0.1、0.15、0.2、0.25、0.3 MPa来分别测定酶活回收率、膜通量,结果见图2。
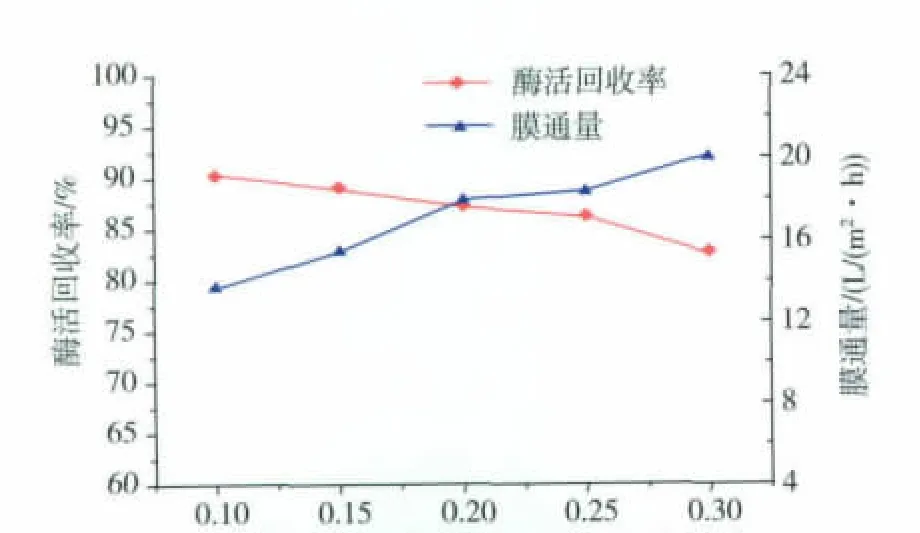
图2 操作压力对酶活及膜通量的影响Fig.2 Influence of operating pressure on the activity and membrane flux
由图2可知,酶活回收率随操作压力的增大而减小,而膜通量随操作压力的增大而增大。主要原因,一方面是当操作压力较小时,酶分子在膜中的通过率小,酶活损失较小;随着操作压力的增大,酶分子受到较大压力的作用,在膜中的通过率增大,酶活损失也随之增多。另一方面,随着超滤时间的增长,浓差极化现象随之增加,此时膜通量会显著下降,因此要尽可能缩短时间来获得较高的膜通量,就要选择合适的操作压力。综上分析,为了既保证较高的酶活回收率,又获得相对较大的膜通量,选择操作压力在0.2~0.25 MPa范围内[15]。
2.3 发酵液的初始pH值对超滤浓缩脱盐的影响
由发酵罐发酵得到的发酵液经离心除菌、低浓度盐的澄清后,pH值在5.6左右,另外调节发酵液的pH值至6.5、7.5。在操作压力0.2~0.25 MPa范围下,将这3种不同pH值的等量发酵液进行超滤浓缩实验,结果见图3,图4。
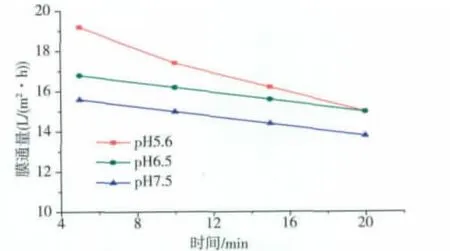
图3 不同pH值发酵液的膜通量随时间的变化曲线Fig.3 Membrane flux changes with time in different pH values of fermentation broth
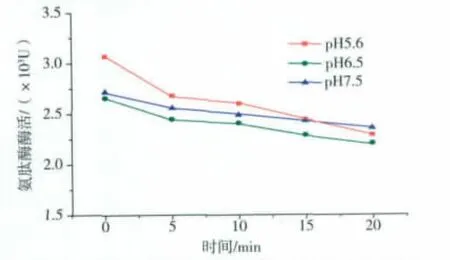
图4 不同pH值的发酵液酶活随时间的变化曲线Fig.4 Enzyme activity changes with time in different pH values of fermentation broth
由图3,图4可知,不同初始pH值的发酵液在超滤的过程中,其膜通量以及氨肽酶活变化有一定的差异。当发酵液初始pH值在5.6~6.5范围时,其膜通量与酶活下降较缓,整个过程中膜通量与总酶活相对较高,可能是因为不同pH值的发酵液其带电性质与电荷的多少不一样,若PES膜所带电荷与酶蛋白质分子所带电荷相反,则易吸附酶蛋白质分子于膜上,从而影响酶活与膜通量。综上分析,选择初始发酵液最佳pH值在5.6~6.5范围内。
2.4 超滤时间对膜通量以及酶活的影响
随着超滤操作[16-18]的进行,浓差极化的现象越来越严重,于是膜表面形成浓缩的凝胶层,从而引起膜通量下降。本文中对该枯草芽孢杆菌氨肽酶的膜通量以及酶活收率随时间的变化进行了分析研究,结果见图5。在超滤过程的前20 min,膜通量下降迅速,主要是因为开始在膜表面没有其他物质,阻力较小;随着大分子物质在膜表面沉淀而使阻力迅速增加。在20~60 min阶段,膜通量下降相对迟缓一些,主要是膜表面的大分子物质缓慢地加厚,阻力也缓慢地增加,且趋于稳定。在60 min以后膜通量下降加快,同时酶活回收率也急剧下降,说明此时膜污染较严重,应立即停止超滤浓缩的操作,需要对膜进行清洗。
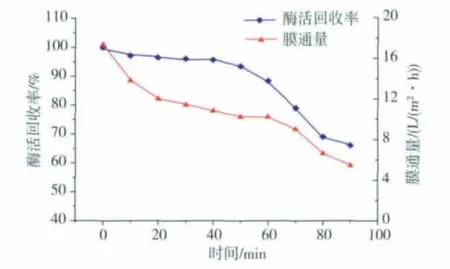
图5 氨肽酶酶活收率及膜通量随时间的变化曲线Fig.5 Aminopeptidase activity yield and the flux change with the time
2.5 超滤浓缩倍数对酶活以及膜通量的影响
如图6,随着超滤的进行,酶活回收率与膜通量都呈显著的下降趋势,当浓缩至3倍左右时,酶活回收率在85%左右,此时膜通量也相对较高,之后急剧下降,因此选择发酵液浓缩至3倍。
2.6 超滤洗脱脱盐操作过程的控制
经上述超滤浓缩之后,发酵液已浓缩到一定的倍数,此时需要对该浓缩发酵液进行洗脱进一步脱除其中的盐。向已浓缩过的发酵液中流加水来洗脱除盐,直到最后将盐基本脱除干净。在洗脱的过程中,通过中间取样来检测SO42-的残留情况,进而判断盐的残留情况,直至最后几乎检测不到SO42-,说明此时盐已基本洗脱干净,停止流加水。综上分析,最后确定当所用洗脱水的体积为洗脱前浓缩发酵液体积的10倍左右时,发酵液中90%以上的盐被脱除,该脱盐过程的酶活回收率为79%。最后以最初发酵液的体积为基准,将该洗脱的发酵液浓缩8~10倍,得到浓缩脱盐发酵液,整个超滤过程酶活回收率为67.15%。
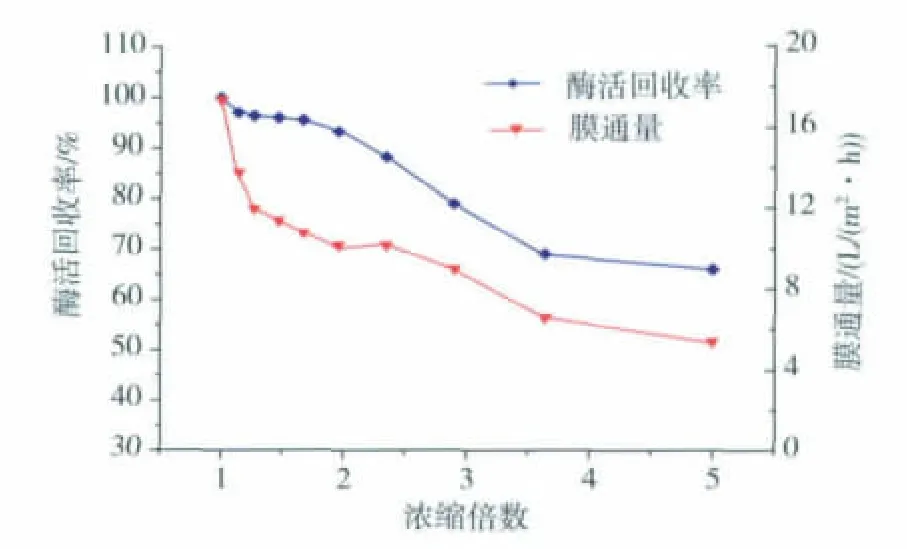
图6 氨肽酶酶活收率及膜通量随浓缩倍数的变化曲线Fig.6 Aminopeptidase activity yield and the flux change with the concentration ratio
2.7 膜的清洗与再生
在超滤操作的过程中,膜的渗透通量会因浓差极化、膜孔堵塞等原因造成膜污染而下降,可以通过定期的清洗使膜恢复其分离功能。针对膜污染的情况,作者采用0.01 mol/L的NaOH溶液对膜进行清洗,使吸附在膜孔和表面的污染物脱落,恢复膜通量。通过研究发现,清洗时间在40~50 min时,膜通量基本可以恢复到98%以上,时间再长膜通量不再有明显变化。因此清洗时间确定为40~50 min。最后将PES膜液封于0.01 mol/L的NaOH溶液中,并定期更换保存液以避免长菌而造成滤芯的堵塞。
3 结语
采用FILTECH-UF101型超滤系统对枯草芽孢杆菌氨肽酶发酵液进行超滤操作,通过对其超滤过程中操作参数的优化,最终选择采用截留分子量为30 kDa的 PES膜,操作压力 0.2~0.25 MPa,发酵液初始pH 5.5~6.5,超滤浓缩倍数为3倍左右时进行洗脱操作,洗脱水的体积为该浓缩发酵液体积的10倍左右,最终将该发酵液浓缩8~10倍。在以上最优条件下,超滤浓缩过程的酶活回收率达85%,洗脱脱盐过程的酶活回收率达79%,整个过程酶活回收率为67.15%,并且整个过程中膜通量维持在16 L/(m2·h)以上。
[1]王俊.枯草芽孢杆菌氨肽酶的研究[D].无锡:江南大学 生物工程学院,2009.
[2]张玉忠.液体分离膜技术及应用[M].北京:化学工业出版社,2004:126-158.
[3]韩少卿,赵芹,彭奇均.膜分离技术提取海藻糖的工艺[J].食品与生物技术学报,2005,24(2)94-96.HAN Shao-qing,ZHAO Qin,PENG Qi-jun.Membrane separation technology to extract the process of trehalose[J].Journal of Food Science and Biotechnology,2005,24(2):94-96.(in Chinese)
[4]李占生.超滤技术在酶的浓缩中的应用[J].天津纺织工学院学报,1996,15:57-59.LI Zhan-sheng.Application of ultrafiltration technology in the the enzyme concentration[J].Journal of Tianjin Textile Institute of Technology,1996,15:57-59.(in Chinese)
[5]朱彬华.超滤法浓缩-淀粉酶的研究[J].膜科学与技术,1988,8(3):15-20.ZHU Bin-hua.Study on the ultrafiltration concentration of amylase[J].Brane Science and Technology,1988,8(3):15-20.(in Chinese)
[6]张延良.超滤技术应用于透明质酸发酵液初提工艺的研究[J].医学信息,2010(6):1529-1530.ZHANG Yan-liang.Ultrafiltration technology used in the extraction process of the hyaluronic acid fermentation liquid[J].Medicine Information,2010(6):1529-1530.(in Chinese)
[7]XING Wang,LIU Ya-li,YANG Ke-hu.Clinical effects of modified ultrafiltration during pediatric cardiac surgery:a systematic review[J].Journal of Southern Medical University,2010,30(7):1665-1672.
[8]徐锡莲,童微星.盐藻胞外多糖分离纯化方法研究[J].食品与生物技术学报,2007,26(4):28-33.XU Xi-lian,TONG Wei-xing.Purification of Salina extracellular polysaccharide [J].Journal of Food Science and Biotechnology,2007,26(4):28-33.(in Chinese)
[9]孙月梅,李杨,江连洲.超滤技术在抗氧化大豆肽制备中的研究[J].食品工业科技,2009,30(2):94-96.SUN Yue-mei,LI Yang,JIANG Lian-zhou.Study on ultra-filtration technology of the preparation of soybean peptide[J].Science and Technology of Food Industry,2009,30(2):94-96.(in Chinese)
[10]Sanz,Y,Toldr,F.Purification and characterization of an arginine aminopeptidase from Lactobacillus sakei[J].Appl Environ Microbiot,2002,68(4):1980-1987.
[11]Konrad,Gerd;Kleinschmidt,Thomas;Faber Wolfgang.Ultrafiltration flux of acid whey obtained by lactic acid fermentation[J].International Dairy Journal,2012,22(1):73-77.
[12]王俊,吕广林,田亚平.一种枯草芽孢杆菌亮氨酸氨肽酶的提取及部分酶学性质研究[J].食品工业科技,2010,30(1):203-206.WANG Jun,LV Guang-lin,TIAN Ya-ping.Study on extraction process and partial characterization of the leucine aminopeptidase of bacillus subtilis[J].Science and Technology of Food Industry,2010,30(1):203-206.(in Chinese)
[13]王健.超滤法提纯万古霉素的应用[J].生物加工过程,2010,7(4):17-21.WANG Jian.Application of Ultrafiltration in the purification of vancomycin[J].Bioprocess,2010,7(4):17-21.(in Chinese)
[14]田亚平,须瑛敏.一种枯草芽孢杆菌氨肽酶的纯化及酶学性质[J].食品工业科技,2006,32(3):7-9.TIAN Ya-ping,XU Ying-min.Purification and characterization of one kind of Bacillus subtilis aminopeptidase[J].Science and Technology of Food Industry,2006,32(3):7-9.(in Chinese)
[15]罗安伟,刘兴华,任亚梅,等.猕猴桃干酒超滤澄清技术研究[J].中国食品学报,2005,5(2):55-59.LUO An-wei,LIU Xing-hua,REN Ya-mei,et al.Ultrafiltration technology to clarify Kiwi dry win[J].China Journal of Food,2005,5(2):55-59.(in Chinese)
[16]苏春燕,朱科学,周惠明.超滤法分离富集谷粉抗氧化活性肽[J].食品与生物技术学报,2011,30(1):44-48.SU Chun-yan,ZHU Ke-xue,ZHOU Hui-ming.Preparation and enrichment antioxidant peptides from wheat gluten hydrolysate using Ultrafiltration[J].Journal of Food Science and Biotechnology,2011,30(1):44-48.
[17]SHENG Zhan-wu,SUN Zhi-gao,HUANG Xue-gen.Study on extraction technology of hesperidin by ultrafiltration[J].Food science,2008,29(2):188-191.
[18]Boodhwani M,Williams K,Babaev A,et al.Ultrafiltration reduces blood transfusions following cardiac surgery:a meta-analysis[J].European Journal of Cardio-Thoracic Surgery,2006,30(6):892-897.

