兔瘟重组VP60蛋白间接ELISA抗体诊断方法的建立
祖立闯 ,王金良 ,肖跃强 ,沈志强 ,
(1.山东绿都生物科技有限公司,滨州 256600;2.山东省滨州畜牧兽医研究院,滨州 256600)
兔病毒性出血症(rabbit hemorrhagic disease,RHD)又名兔瘟,是由兔病毒性出血症病毒(rabbit hemorrhagic disease virus,RHDV)引起的兔的一种急性、高度致死性、高度传染性疾病,其发病率和致死率都很高,是危害养兔业和实验兔的一种烈性、毁灭性传染病[1-3]。该病于1984年春在江苏无锡、江阴等县市首次暴发,现在已蔓延至世界各地,呈世界性分布,给全球养兔业造成了巨大的经济损失[4-8]。世界动物卫生组织将其列为B类传染病,我国农业部也将其列为二类动物疫病。由于RHDV在体外组织细胞的培养方法尚未建立,现行RHD的诊断和预防制剂一直利用来自感染兔的肝脏组织,成本高,抗原不易纯化,也不符合动物福利的要求。目前,研究者更倾向于利用分子生物学手段进行新型诊断试剂及疫苗的研制和开发。VP60为病毒衣壳蛋白,是RHDV唯一的结构蛋白,与诱导抗病毒感染免疫反应直接相关,是病毒免疫保护性抗原[9-11]。鉴于此,本研究对 VP60基因主要抗原区域(长度为510 bp)进行了截短表达,并研制了间接ELISA诊断试剂盒。
1 材料与方法
1.1 菌株、病毒与血清
克隆菌株DH5α、表达菌株BL21、表达载体PGEX-4T-1、RHDV毒株及参考阳性、阴性血清,均由山东省滨州畜牧兽医研究院实验室保存。
1.2 主要试剂
Ex Taq酶、M-MLV反转录酶、T4 DNA连接酶、pMD18-T克隆载体及限制性内切酶,购自宝生物(大连)工程有限公司;山羊抗兔IgG辣根过氧化物酶(HRP)标记抗体,购自上海研卉生物科技有限公司。
1.3 引物设计与合成
根据GenBank公布的RHDV基因组序列,利用oligo6.2设计合成了 1对特异性引物:P1 5’-3’CCGGAATTCGAGGGCAAAACC CGCAC;P2 5’-3’CCGCTCGAGT TGGGACGCAAGTCTGG。引物由生工生物工程(上海)有限公司合成。
1.4 病毒基因组RNA的提取
将兔瘟肝脏组织毒反复冻融3次,经3 000 r/min离心15 min,吸取上清作为病毒液,按Trizol试剂使用说明提取病毒基因组RNA。
1.5 VP60基因的RT-PCR扩增
以提取的病毒基因组RNA为模板,反转录合成cDNA。以cDNA为模板进行PCR反应,反应条件:94℃预变性 5 min;94℃ l min、58℃ l min、72℃ l min,共进行30个循环,72℃延伸10 min,4℃终止反应。取扩增产物5 μL,在10 g/L的琼脂糖凝胶上电泳,利用凝胶成像系统扫描进行初步鉴定。
1.6 VP60基因表达载体的构建与鉴定
利用EcoRI/XhoI双酶切VP60,回收VP60基因片段,定向克隆到经EcoRI/XhoI双酶切的PGEX-4T-1表达载体中,取连接产物转化DH5α大肠杆菌感受态细胞,经PCR及EcoRI/XhoI双酶切鉴定后获得重组表达载体PGEX-VP60。将鉴定为阳性的克隆送生工生物工程(上海)有限公司测序,以验证其阅读框架。
1.7 VP60重组蛋白的表达与纯化
将鉴定正确的PGEX-VP60重组质粒转化表达菌BL21感受态细胞诱导表达后,超声破碎细胞,12 000 r/min离心15 min,分别收集上清及沉淀进行SDS-PAGE分析,对以包涵体形式存在于沉淀中的重组蛋白用尿素进行变性处理,包涵体溶解后采用亲和层析法纯化,纯化后的蛋白进行透析复性。
1.8 VP60重组蛋白的Western blot检测
纯化的重组蛋白经SDS-PAGE后,转印至硝酸纤维素膜上,5%脱脂奶粉4℃封闭过夜,加RHDV阳性血清(1∶100稀释)37℃作用1 h,TBST缓冲液洗3次;加入山羊抗兔IgG辣根过氧化物酶(HRP)标记抗体(1∶5 000稀释),37℃作用50min,TBST缓冲液洗3次,在二氨基联苯胺(DAB)缓冲溶液中显色10min。
1.9 RHDV间接ELISA诊断方法(VP60-ELISA)的建立
1.9.1 反应条件的优化 在相同反应条件下,分别将重组抗原的不同稀释度与血清的不同稀释度、不同封闭液与不同封闭时间、酶标二抗不同稀释度与不同作用时间组成方阵滴定试验,以阳性血清OD450nm≈1.0、阴性血清OD450nm<0.2、阳性血清/阴性血清(P/N值)最大为选择标准,确定重组抗原最佳包被浓度与血清样品最佳稀释度、最佳封闭液与最佳封闭时间、酶标二抗最佳稀释度与最佳作用时间。在相同反应条件下,血清样品分别作用 30、60、90、120min,TMB 底物液分别显色 5、10、15、20 min,以阳性血清 OD450nm≈1.0、阴性血清OD450nm<0.2、P/N值最大为选择标准,分别确定血清、底物的最佳作用时间。
1.9.2 判断标准的确定 在最佳反应条件下,利用VP60-ELISA检测48份已知RHDV阴性血清样本,以样品号为横坐标、OD450 nm值为纵坐标,绘制阴性样品OD450 nm数值分布图,并计算出48份阴性血清的OD450 nm平均值()和标准差(SD),本试验规定样本OD450 nm≥+3SD时为阳性,样本OD450 nm<+2SD时为阴性,当+2SD≤样本OD450 nm<+3SD时为可疑,需重新检测样本,重新检测时样本OD450 nm≥+2SD时判为阳性,样本OD450 nm<+2SD时判为阴性。
1.9.3 敏感性试验 将RHDV标准阳性对照血清分别按 1∶50、1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600比例稀释,每个稀释度平行做4个重复,用建立的RHDV VP60-ELISA检测,测定OD450 nm值,判定其抗体效价。
1.9.4 重复性试验 ①批内重复性。选取6份RHDV抗体水平不同的血清,进行RHDV VP60-ELISA检测,每份血清平行做6个重复,对结果进行分析。②批间重复性。选取6份RHDV抗体水平不同的血清,于4个不同时间用RHDV VP60-ELISA进行检测,对结果进行分析。
1.10 临床应用
应用研制的RHDV VP60-ELISA对来自河南、山东、河北等地的426份兔血清样本进行检测,确定上述地区RHDV血清抗体的阳性率。
2 结果与分析
2.1 RHDV VP60基因的PCR扩增及其表达载体的鉴定
RT-PCR扩增产物经琼脂糖凝胶电泳,在约510 bp处可见特异性DNA扩增条带(图1),与预期大小相符。构建的PGEX-VP60重组质粒经PCR及EcoRI/XhoI双酶切鉴定(图2)后,测序结果表明其阅读框正确。

图1 PCR扩增结果

图2 重组表达载体酶切鉴定
2.2 VP60重组蛋白的表达及纯化
以最佳条件对PGEX-VP60诱导表达后,超声破碎细胞,可见目的蛋白大部分以包涵体形式存在,包涵体经8 mol/L尿素变性、亲和层析法纯化后,获得了分子质量为42ku的VP60重组蛋白(图3)。

图3 重组蛋白的SDS-PAGE分析
2.3 VP60重组蛋白的活性鉴定
取纯化后的VP60重组蛋白,经SDS-PAGE分析后,转印至硝酸纤维素膜上,与RHDV阳性血清作用,结果表明该重组蛋白能与RHDV阳性血清发生特异性反应,而空载体表达菌与RHDV阳性血清没有反应(图4)。
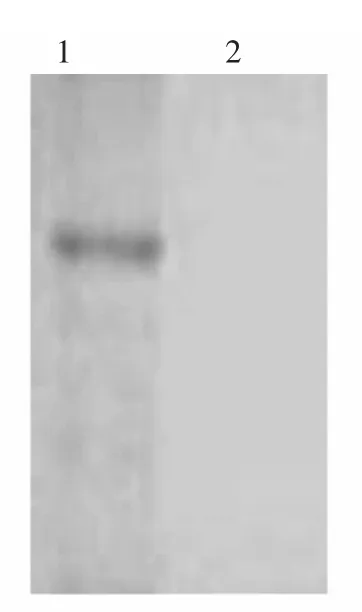
图4 表达产物的免疫印迹分析
2.4 RHDV VP60-ELISA检测条件的确定
2.4.1 最佳反应条件 重组抗原的最佳包被浓度为5.88 μg/mL;最佳封闭液为含 10 g/L BSA 的 PBST,最佳封闭时间37℃1 h;血清最佳稀释度1∶100,最佳作用时间为37℃1 h;酶标二抗最佳工作浓度1∶4 000,最佳作用时间37℃1h;底物最佳显色时间37℃10min。
2.4.2 判定标准 48份阴性血清样本经RHDV VP60-ELISA检测后,以样品编号为横坐标、OD450 nm值为纵坐标,得到阴性样品OD450 nm数值分布图(图5)。计算得出48份阴性样本OD450nm平均值和标准差分别为x=0.224和SD=0.058。即当样本OD450 nm≥0.398时判为阳性;当样本OD450nm<0.340时判为阴性;当0.340≤样本OD450nm<0.398时判为可疑。对可疑样本必须重新检测,重新检测时,样本OD450 nm≥0.340为阳性。
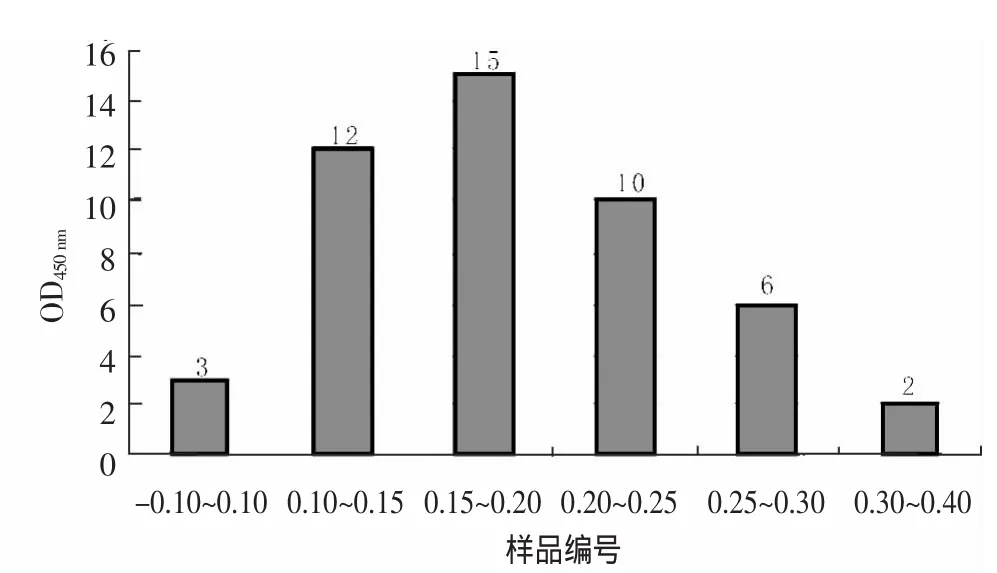
图5 RHDV VP60-ELISA检测48份阴性样品OD450 nm分布图
2.5 敏感性
用建立的RHDV VP60-ELISA检测RHDV标准阳性对照血清,当血清稀释至12 800倍时,检测结果仍为阳性(图6),证明所建立的方法具有较好的敏感性。

图6 RHDV VP60-ELISA敏感性试验结果
2.6 重复性
批内重复性试验样品的变异系数小于4.9%;批间重复性试验样品的变异系数均小于6.9%。说明RHDV VP60-ELISA具有良好的重复性。
2.7 临床应用结果
应用研制的RHDV VP60-ELISA试剂盒检测了来自河南、山东、河北等地的426份血清样本,检测出阳性352份、阴性74份,阳性率82.6%。
3 讨论
RHD是对兔威胁最严重的一种病毒性传染病,常予兔群以毁灭性打击,危害性极大,是养兔业和实验用兔必检病毒之一,检测要求血清抗体必须达到保护性水平,才可以安全地用于生产和实验。随着我国养兔业的发展及实验动物标准化程度的普及和提高,RHD诊断方法的建立和标准化不可或缺。目前常用的RHDV抗体检测方法是血凝抑制试验(HI),需要人“O”型红血球,血清需经过吸附处理,过程较为繁琐;结果判定易受许多主、客观因素的影响,所以在实际应用中受到很多限制。而ELISA诊断方法具有特异性和敏感性强、快速、准确、通量高等特点,是动物传染病检疫、免疫抗体水平监测和流行病学调查广泛采用的诊断技术。目前RHDV所用疫苗和诊断试剂均来源于感染兔的肝脏组织,获得纯度较高的病毒比较困难。同时这种组织毒抗原制备过程繁琐、成本高、存在潜在的危险性及不符合动物福利的要求,一定程度上限制了全病毒间接ELISA检测试剂盒的标准化。因此,利用基因工程表达的人工抗原已逐步得到重视。VP60是RHDV唯一结构蛋白,是病毒免疫保护性抗原,在RHDV诊断、新型疫苗的研制中具有十分重要的意义。为此,本试验利用PGEX-4T-1原核表达载体,表达了RHDV的VP60蛋白,经免疫印迹试验证实所截短表达的重组VP60蛋白具有良好的反应性与特异性,并以该蛋白为包被抗原建立了检测RHDV抗体的VP60-ELISA诊断方法。
目前,国内各兔场均将兔瘟作为重点免疫疫病,作为重点防范的疫病之一,多年来未曾见大疫情流行报道,本次调查发现RHDV的平均抗体阳性率高达82.6%,说明我国现行兔瘟疫苗效果较好,但仍存在个别兔场免疫失败的现象。总之,本试验所表达的重组VP60蛋白具有良好的反应活性,以其作为包被抗原建立的间接ELISA诊断方法具有很好的敏感性和特异性,显示出了良好的应用前景。本实验室预期将其组装成试剂盒,为我国RHDV的诊断、疫苗免疫水平监测、流行病学调查、实验兔等级检测等提供一种简便、快速的血清学检测方法。
[1]Meyers G,Wirblich C,Thiel H J.Genomic and subgenomic RNAs of rabbit hemorrhagic disease virus are both protein-linked and packaged into particles[J].Virology,1991,184(2):677-686.
[2]Abrantes J,van der Loo W,Le Pendu J,et al.Rabbit haemorrhagic disease(RHD)and rabbit haemorrhagic disease virus(RHDV):a re view[J].Vet Res,2012,3(1):12.
[3]金明兰,侯继波,郑其升,等.兔出血症病毒JL株分离鉴定及VP60 基因主要抗原表位分析[J].中国兽医学报,2012,32(6):833-838.
[4]刘胜江,薛华平,蒲伯清,等.一种新的家兔病毒病——兔病毒性出血症[J].畜牧与兽医,1984,16:253-255.
[5]Kerr P J,Kitchen A,Holmes E C.Origin and phylodynamics of rabbit hemorrhagic disease virus[J].J Virol,2009,83(23):12129-12138.
[6]Gould E A.First case of rabbit haemorrhagic disease in Canada:contaminated flying insect,vs.long-term infection hypothesis[J].Mol Ecol,2012,21(5):1042-1047.
[7]Le Gall-Recule G,Zwingelstein F,Boucher S,et al.Detection of a new variant of rabbit haemorrhagic disease virus in France[J].Vet Rec,2011,168(5):137-138.
[8]Alda F,Gaitero T,Suárez M,et al.Evolutionary history and molecular epidemiology of rabbit haemorrhagic disease virus in the Iberian Peninsula and Western Europe[J].BMC Evol Biol,2010,10:347.
[9]Ma W,Yu L.Analysis of two VP60 capsid protein genes of rabbit hemorrhagic disease virus from viruses obtained from the same farm[J].Arch Virol,2010,155(9):1497-501.
[10]Spibey N,McCabe V J,Greenwood N M,et al.Novel bivalent vectored vaccine for control of myxomatosis and rabbit haemorrhagic disease[J].Vet Rec,2012,170(12):309.
[11]Kinnear M,Linde C C.Capsid gene divergence in rabbit hemorrhagic disease virus[J].J Gen Virol,2010,91(1):174-181.
- 中国草食动物科学的其它文章
- 种羊生产中全混合日粮应用效果评价
- 湖北乌羊基因杂合度与血液黑色素之间的关联分析

