高效液相色谱法同时测定植烟土壤和水中3种除草剂残留量
丁春霞,龚道新,肖 浩,任颖俊,杨丽华
(1.湖南农业大学理学院,长沙 410128;2.湖南农业大学资源环境学院,长沙 410128;3.湖南农业大学烟草研究院,长沙 410128)
农田杂草对农产品的产量和质量会产生严重的影响,随着除草剂品种的日益增多,新的除草剂不断用于农业生产,因此环境样品中常常含有多种除草剂的残留组分,除草剂残留分析方法也逐渐由单一种类除草剂的检测向多种除草剂多残留分析发展[1]。高效氟吡甲禾灵、精吡氟禾草灵及精喹禾灵是一类芳氧苯氧丙酸酯类除草剂[2],属于内吸传导型茎叶处理除草剂,被广泛用于烟草、油菜、花生、马铃薯、大豆、番茄等多种阔叶作物地中,防除马唐、狗尾草、稗草、牛筋等多种一年生和多年生禾本科杂草,除草活性高[3]。但随着此类除草剂的广泛使用,它对生态环境产生的不利影响也日趋增多[4-9]。因此,建立一套能同时检测该类除草剂在环境中残留量的分析与检测方法就显得十分必要。目前,对于这类除草剂的单剂在环境及作物中的残留检测方法已有一些报道,主要的分析检测方法有气相色谱法[10]、气相色谱-质谱法[11]、高效液相色谱法[12-14]、高效液相色谱-质谱法[15]、酶联免疫法[16-17]等。但尚未见有这3种除草剂在环境样品中同时分析与检测的报道。笔者通过对样品前处理条件及其分析检测条件的摸索,建立了一种能同时测定植烟土壤及其周边水样中精喹禾灵、高效氟吡甲禾灵和精吡氟禾草灵残留量的分析方法。
1 材料与方法
1.1 仪器和试剂
Agilent 1260型高效液相色谱仪带紫外检测器(美国安捷伦科技有限公司),SHZ-D型循环水真空泵(巩义市予华有限责任公司),RE-2000A型旋转蒸发器(上海亚带生化仪器厂),2HWY-2102型双层大容量全温度恒温培养振荡器(上海智城分析仪器制造有限公司)。
甲醇为色谱纯,二氯甲烷、丙酮、乙腈、氯化钠均为分析纯。
高效氟吡甲禾灵标准品(纯度为95.3%)、精吡氟禾草灵标准品(纯度为94.8%)均由山东绿霸化工股份有限公司提供;精喹禾灵标准品(纯度为96.7%)由湖南化工研究院提供。土壤样品采自湖南农业大学烟草基地,样品经风干后磨碎过 20目筛;水样采自湖南农业大学烟草基地附近的池塘和水渠。
1.2 混合标准溶液的配制
分别准确称取高效氟吡甲禾灵、精吡氟禾草灵及精喹禾灵的标准品,用甲醇配制成一定浓度的储备液,准确吸取一定量各种农药的储备液,用甲醇梯度稀释法配制质量浓度分别为0.0050、0.05、0.10、0.50、1.00、5.00 mg/L的混合标准溶液。
1.3 样品的提取与净化
1.3.1 植烟土壤 准确称取植烟土壤样品20.0 g,置于250 mL具塞三角瓶中,加入60 mL丙酮,在恒温振荡器中震荡提取 30 min,减压抽滤,再用60 mL丙酮分2次洗涤残渣和抽滤瓶,合并滤液,无损转入250 mL具塞三角瓶中,在旋转蒸发仪上浓缩至近干后,用5 mL二氯甲烷-丙酮(3:1,v:v)混合液溶解,然后将其无损转移入经10 mL二氯甲烷-丙酮(3:1,v:v)混合液预淋洗过的弗罗里硅土净化柱中,用60 mL二氯甲烷-丙酮(3:1,v:v)混合液洗脱,收集全部洗脱液,置于旋转蒸发仪上浓缩近干,用色谱甲醇溶解并定容至5.0 mL,过0.45 μm滤膜,待HPLC检测。
1.3.2 水 准确量取100.0 mL已制备好的水样置于500 mL分液漏斗中,向其中加入20 mL10%的氯化钠水溶液,再加入5 mL丙酮,摇匀,分别用40、40、20 mL二氯甲烷液萃取3次,合并二氯甲烷萃取相,在旋转蒸发仪上浓缩至近干;用甲醇溶解并定容至5.0 mL,过0.45 μm滤膜,待HPLC检测。
1.4 HPLC条件
色谱柱:Hypersid-C18不锈钢柱(250 mm×4.6 mm,5.0 μm);流动相为甲醇-水(85:15,v:v);流速0.6 mL/min;检测波长223 nm;柱温35 ℃;进样量 20 μL。
1.5 添加回收率实验
植烟土壤添加回收率:准确称取空白植烟土壤20.0 g,用3种混合标准溶液分别添加至0.050、0.50、1.0 mg/kg三个水平,每个水平重复5次,按照1.3.1前处理方法处理,按照1.4的色谱操作条件进行测定;水的添加回收率:取空白水100 mL过滤,用3种混合标准溶液分别添加至0.0050、0.10、1.0 mg/L三个水平,每个水平重复5次。按照1.3.2前处理方法处理,按照1.4的色谱操作条件进行测定。
2 结 果
2.1 提取溶剂的选择
分别比较了甲醇、乙腈、丙酮以及二氯甲烷作为提取溶剂对植烟土壤中的精喹禾灵、高效氟吡甲禾灵及精吡氟禾草灵的提取效果。结果表明,用甲醇和二氯甲烷提取时,有杂质峰干扰测定,而且精吡氟禾草灵的回收率低于50%;乙腈提取时,虽然杂质较少,但提取率低;而采用丙酮作为提取剂时,3种除草剂的提取率均有较大的提高,但有杂峰干扰,需进一步净化。因此,对植烟土壤中3种除草剂的提取选丙酮作为提取溶剂。
在对水样进行前处理时,选用二氯甲烷在对水中目标物进行提取时发现,只有精喹禾灵的回收率较高(80%~101%),而另外两种目标物的回收率均低于70%,后通过往萃取体系中加入5%的丙酮后,3种目标物的回收率均有较大的提高,回收率均为88.9%~101.2%。这可能是因为丙酮的加入可以使二氯甲烷在水相中分散成细小的液滴,增大其与待萃取物的接触面积,从而提高萃取效率。因此,水样用二氯甲烷萃取时需加入5%的丙酮作为分散剂。
2.2 柱净化条件的选择
分别以二氯甲烷-甲醇(3:1,v:v)、二氯甲烷-甲醇(5:1,v:v)、二氯甲烷-丙酮(3:1,v:v)以及二氯甲烷-丙酮(5:1,v:v)作为柱淋洗液,考察其对3种除草剂与杂质分离效果的影响。结果表明,用二氯甲烷-甲醇作为洗脱液时,有一杂质峰干扰对精吡氟禾草灵的测定,且高效氟吡甲禾灵的峰形不好,拖尾严重。谢勇波等[13]对烟叶的高效氟吡甲禾灵残留进行分析,用二氯甲烷-甲醇(5:1,v:v)作为洗脱液,可将高效氟吡甲禾灵与烟叶中杂质有效分离,而我们用其作为洗脱液不能将土壤中的杂质与3种目标化合物有效分开,这可能是由于土壤与烟叶中存在的杂质极性不同造成的。当把洗脱液中的甲醇换成极性比它弱的丙酮时,目标物与杂质分离较好,在用二氯甲烷-丙酮(3:1,v:v)洗脱时,3种目标化合物的回收率为 77.5%~110.3%,无杂质干扰测定,峰形良好。因此,选用二氯甲烷-丙酮(3:1,v:v)作为洗脱液。
2.3 HPLC条件的选择与优化
2.3.1 检测波长的选择 高效氟吡甲禾灵、精吡氟禾草灵和精喹禾灵甲醇溶液的紫外光谱表明,其最大吸收波长分别为223、220、235 nm。当检测波长为220 nm时,高效氟吡甲禾灵和精吡氟禾草灵的灵敏度较高,精喹禾灵有杂质峰干扰其测定;当检测波长235 nm时,精喹禾灵的响应值大,灵敏度高,但是高效氟吡甲禾灵和精吡氟禾草灵的灵敏度低,不能满足检测要求;当检测波长为223 nm时,尽管精喹禾灵的灵敏度度相对于在235 nm条件下稍有降低,但其峰形良好,高效氟吡甲禾灵和精吡氟禾草灵的灵敏度相对于在235 nm条件下均有大幅度提高,而且在此条件下杂质干扰也较少。因此,选择223 nm作为检测波长。
2.3.2 分离条件的优化 在流速为 0.6 mL/min不变的条件下,分别考察了不同体积比(70:30、75:25、80:20、85:15)的甲醇和水作为流动相时的分离效果。当柱温为25 ℃,甲醇-水体积比为70:30时,在25 min内未见3种供试农药出峰;当甲醇-水体积比为85:15时,3种供试农药的保留时间变短,最迟出峰的农药精喹禾灵的保留时间为14.27 min,但是精吡氟禾草灵和精喹禾灵不能完全分开,但当柱温升高至35 ℃时,不仅3个目标化合物的响应值均增大,而且精吡氟禾草灵和精喹禾灵也能完全分开。故选择在柱温为 35 ℃,流动相为甲醇-水(85:15,v:v),流速为0.6 mL/min的条件下进行测定。其典型色谱图见图1。
2.4 线性关系
准确配制系列浓度为0.0050、0.05、0.10、0.50、1.00、5.00 mg/L的标准溶液,按所优选的条件进行测定,以峰面积y与相应的质量浓度x(mg/L)作标准曲线,得到相应的线性回归方程:高效氟吡甲禾灵为y=71.949x+ 4.8899(R2=0.9996),精吡氟禾草灵为y=59.757x+ 4.0504(R2=0.9979),精喹禾灵为y=111.08x+ 6.8451(R2=0.9974),表明3种目标化合物在质量浓度为0.005~5.00 mg/L范围内线性关系良好。
2.5 方法的回收率、精密度
在植烟土壤和水中,分别添加了高效氟吡甲禾灵、精吡氟禾草灵及精喹禾灵的混合标准溶液,设3个不同浓度水平,每个浓度水平样品重复5次,按照前面优选的方法处理及测定,实验结果见表1。结果表明,3种供试除草剂在土壤中的添加回收率为77.5%~110.3%,相对标准偏差为1.6%~10.2%,在水中的添加回收率为 88.9%~101.2%,相对标准偏差为0.9%~8.2%。此方法精密度和准确度均符合农药残留量分析与检测技术的要求。
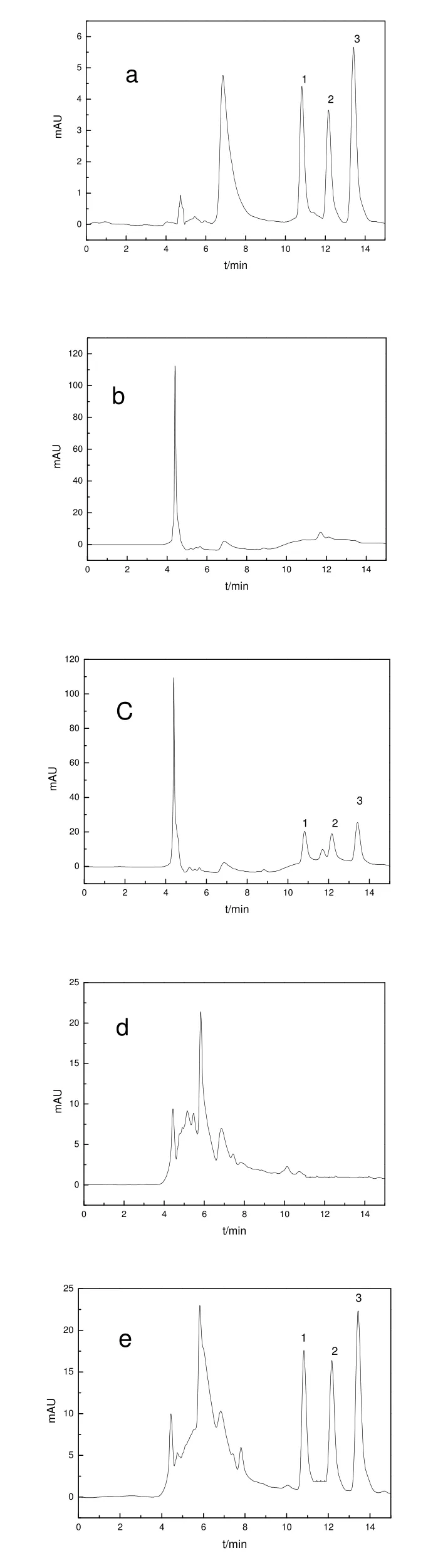
图1 农药标准溶液、空白样品及其加标样品的色谱图Fig.1 Chromatograms of pesticide standard solution, blank and spiked samples
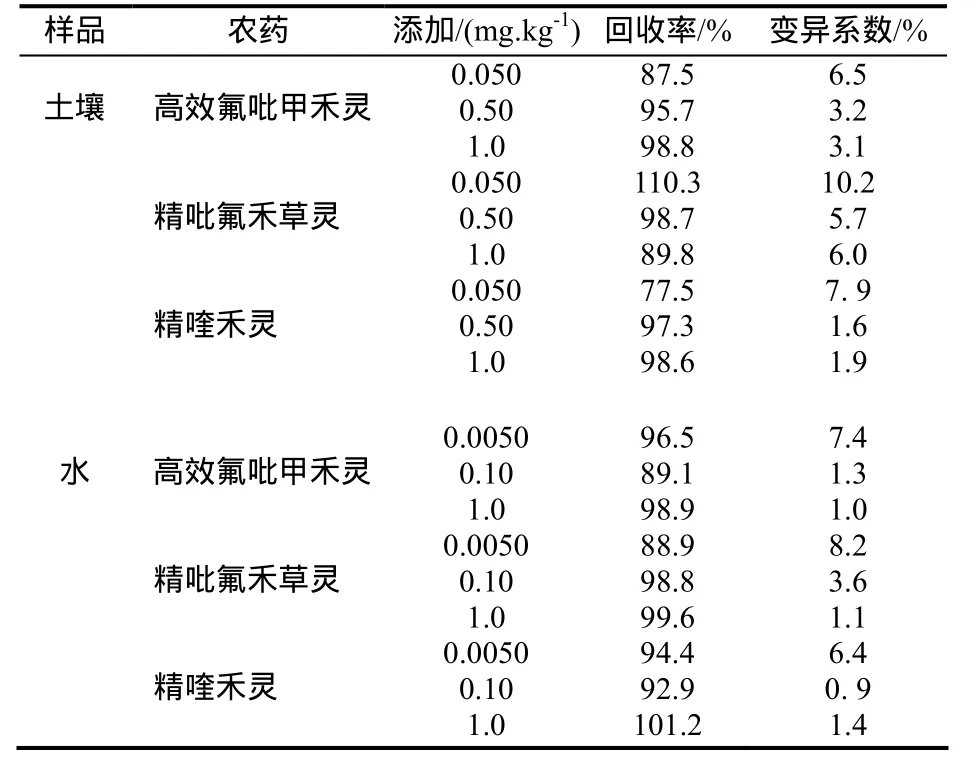
表1 高效氟吡甲禾灵、精吡氟禾草灵和精喹禾灵在土壤和水中的添加回收试验Table 1 The spiked recoveries and relative standard deviations(RSD) of haloxyfop-p-methyl, fluazifop-p-butyl and quizafop-p-ethyl in soil and water
2.6 植烟环境中除草剂残留分析
用所建立的方法可以对常用该类除草剂的土壤及周边水体进行分析检测,以便得知这几种除草剂在环境中的残留情况。本实验对常用该类除草剂的湖南农业大学烟草基地的植烟土壤及周边的河水、池塘水及水渠进行分析检测,结果发现,一植烟土壤附近的水渠中存在精喹禾灵 0.016 mg/L残留,其余植烟土壤和周边水样中均未检测到。
3 结 论
建立了高效液相色谱法同时测定植烟土壤及水样中3种常见的芳氧苯氧基丙酸酯类除草剂的分析方法。水样使用二氯甲烷-丙酮(20:1,v:v)混合液提取,土壤样品用丙酮提取,以弗罗里硅土净化,二氯甲烷-丙酮(3:1,v:v)洗脱。该方法具有操作简单、分离效果好、回收率高、精密度高等特点,符合农药残留分析要求,可用于植烟环境中土壤及水样中3种常用芳氧苯氧基丙酸酯类除草剂残留量的同时测定。
[1]Sakamoto M, Tsutsumi T.Applicability of head space solid-phase micro-extraction to the determination of multi-class pesticides in waters[J].Journal of Chromatography A, 2004, 1028(1): 63-67.
[2]韩熹莱.中国农业百科全书(农药卷)[M].北京:农业出版社,1993:164-165.
[3]孙亚林,朱文达,陈文,等.精喹禾灵对夏大豆田间的控草效果和光照及养分的影响[J].华中农业大学学报,2009,28(2):161-163.
[4]Mustfa Y, Arikan E S.Genotoxicity testing of quizalofop-p-ethyl herbicide using the Allium cepa anaphase-telophase chromosome aberration assay[J].Caryologia, 2008, 61: 45-52.
[5]Elefsiniotis I S, Liatsos G D, Stamelakis D, et al.Case report: mixed cholestatic/hepatocellular liver injury induced by the herbicide quizalofop-p-ethyl[J].Environ.Health Perspect, 2007, 115: 1479-1481.
[6]Borjan M.Evidence on developmental and reproductive toxicity of quizalofop-ethyl[R].California: California Environmental Protection Agency (CEPA), 1999.
[7]Doganlar Z B.Quizalofop-p-ethyl-induced phytotoxicity and genotoxicity in Lemna minor and Lemna gibba[J].Journal of Environmental Science and Health, 2012,47(11): 1631-1643.
[8]Zhang X, Wang S, Wang Y, et al.Differential enantioselectivity of quizalofop-ethyl and its acidic metabolite:Direct enantiomeric separation and assessment of multiple toxicological endpoints[J].Journal of Hazardous Materials, 2011, 186: 876-882.
[9]俞少勇,陈日萍,陈彤,等.高效氟吡甲禾灵对大鼠睾丸生精细胞的损伤作用[J].毒理学杂质,2006,20(6):390-392.
[10]曾得意,施海燕,李波,等.气相色谱法(NPD)测定水和土壤中精喹禾灵的残留量[J].贵州大学学报:自然科学版,2006,23(2):184-187.
[11]苏建峰,钟茂生,张光军,等.固相萃取-气相色谱-质谱联用测定葱属蔬菜中二甲嘧菌胺和吡氟禾草灵残留量[J].应用化学,2010,27(5):590-593.
[12]田华,王延华.10.8%精喹禾灵水乳剂的高效液相色谱分析[J].应用化工,2011,40(7):1291-1289.
[13]谢勇波,周清明,龚道新,等.高效液相色谱法测定土壤、烟草和油菜中高效氟吡甲禾灵残留[J].农药,2011,50(3):209-212.
[14]李桂红,张东飞,赵瑞,等.超高效液相色谱串联质谱测定大豆和土壤中精喹禾灵的残留分析方法[J].农药科学与管理,2011,32(8):37-40.
[15]刘慧,曹赵云,张利强,等.分散固相萃取-液相色谱-串联质谱法测定农产品中吡氟甲禾灵[J].分析实验室,2011,30(3):83-86.
[16]Zeng D Y, Shi H Y, Li B, et al.Development of an enzyme-linked immunosorbent assay for quantitative determination of quizalofop-p-ethyl[J].Agricultural and Food Chemistry,2006, 54: 8682-8687.
[17]Bao H, Fang S, Liu Z, et al. Development of an enzyme-linked immunosorbent assay for the rapid detection of haloxyfop-p-methyl[J]. Journal of Agricultural and Food Chemistry, 2010, 58(14):8167-8170.

