哮喘气道重塑大鼠气道上皮细胞及线粒体超微结构变化
李 淼 尚云晓
(中国医科大学附属盛京医院小儿呼吸内科,沈阳110004)
气道重塑是慢性哮喘气道的重要病理特点。气道重塑不仅表现为气道上皮的脱落,气道上皮细胞间胶原沉积,线粒体的改变也是其中的重要特点。线粒体是气道上皮细胞中重要的细胞器。既往有文献报道哮喘气道上皮细胞中线粒体产生ATP功能下降[1],但对于哮喘气道上皮细胞中线粒体超微结构发生的变化研究较少,本文通过制作哮喘气道重塑大鼠模型,透射电镜观察哮喘大鼠气道上皮细胞中线粒体结构的变化,旨在为哮喘的治疗寻求新的理论基础。
材料和方法
1.实验动物及分组
雌性Wistar大鼠6只,周龄6w-8w,体质量60-80 g,中国医科大学中心实验室动物部提供;随机进行分为2组。其中正常对照组3只、模型组3只。饲养期间给予正常饮食。
2.哮喘模型制作
2.1 制作方法:
参照文献[2],即1 d及8 d腹腔注射1%卵蛋白10 mg、氢氧化铝凝胶200 mg及百日咳灭活杆菌6×109/ml混合液共1 ml致敏,第15 d开始超声雾化吸入2%卵蛋白诱喘,隔日一次吸入6w,模型制作共8w。诱喘成功后24 h内取材。正常对照组用生理盐水代替卵蛋白吸入,吸入方法同模型组并同期取材。百日咳灭活杆菌购自北京生物制品研究所;卵蛋白及氢氧化铝凝胶购自美国Sigma公司;
2.2 模型成功表现:
按哮喘气道重塑模型制作方法,在致敏后大鼠出现剧烈咳嗽、打喷嚏、呼吸困难、喘息、呼气费力或点头样呼吸、听诊闻及喘鸣音,则表明哮喘模型制作成功。
3.电镜制作
两组大鼠在最后一次致敏后24 h内,腹腔注射10%水合氯醛(30 mg/kg)麻醉后,左心室取血处死大鼠。取气管浸泡于2%戊二醛固定液中在4℃保存2 h后取出,按常规方法制备超薄切片,铀-铅双染,以日立H-7650型透射电镜进行观察,重点观察指标为气道上皮细胞纤毛上皮,气道上皮细胞间胶原,上皮细胞内线粒体超微结构改变。透射电镜由中国医科大学电镜室提供。
结 果
1.气道上皮细胞超微结构改变
正常组大鼠气道纤毛上皮排列整齐、规则(图A);哮喘组大鼠气道多层纤毛上皮,纤毛脱落,杯状细胞增多,排列不整齐(图B),气道上皮细胞中线粒体基膜密度下降,线粒体峡减少,细胞核多切迹,形状不规则(图C)。
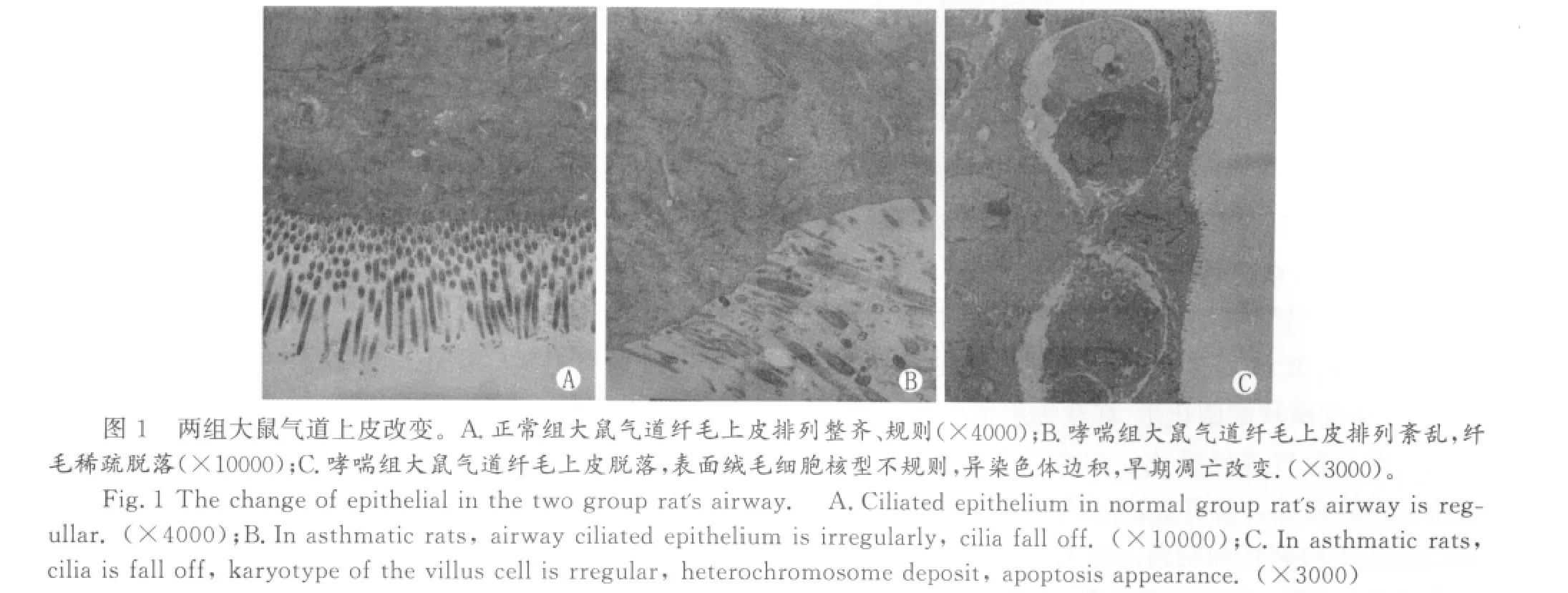
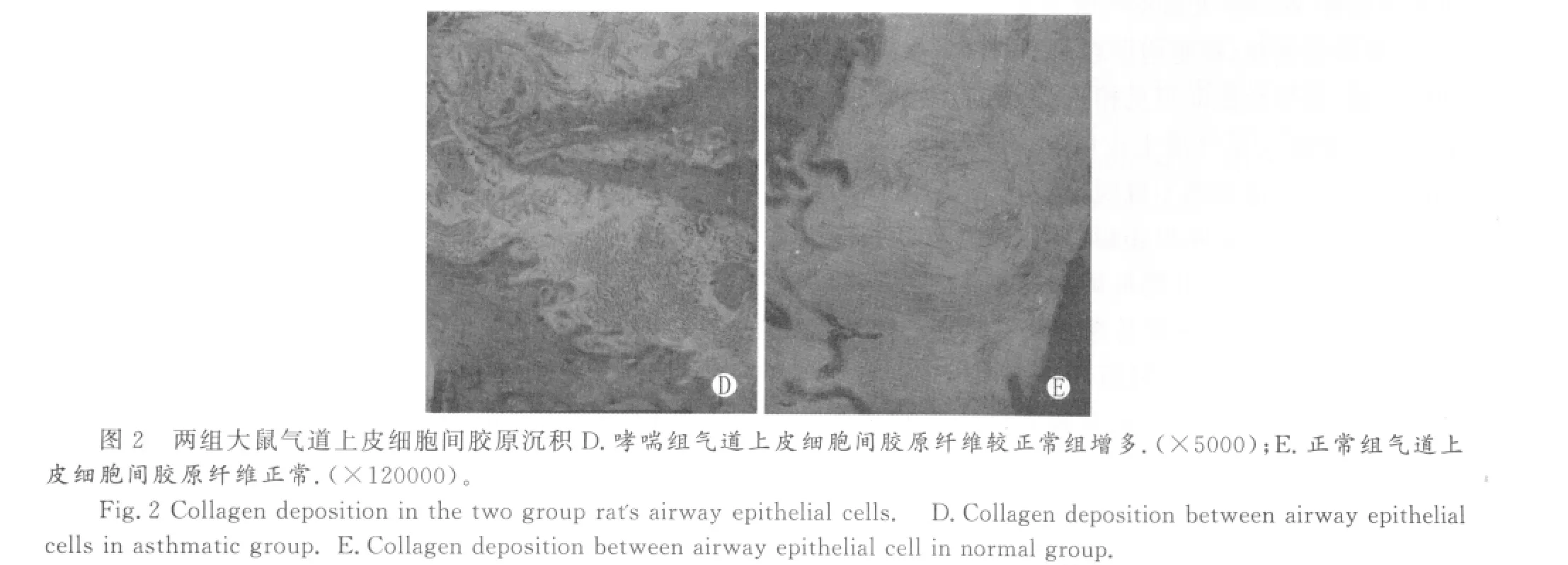
2.气道上皮细胞间胶原沉积
哮喘组大鼠气道上皮细胞间胶原沉积较正常组大鼠增加(图D,E)。
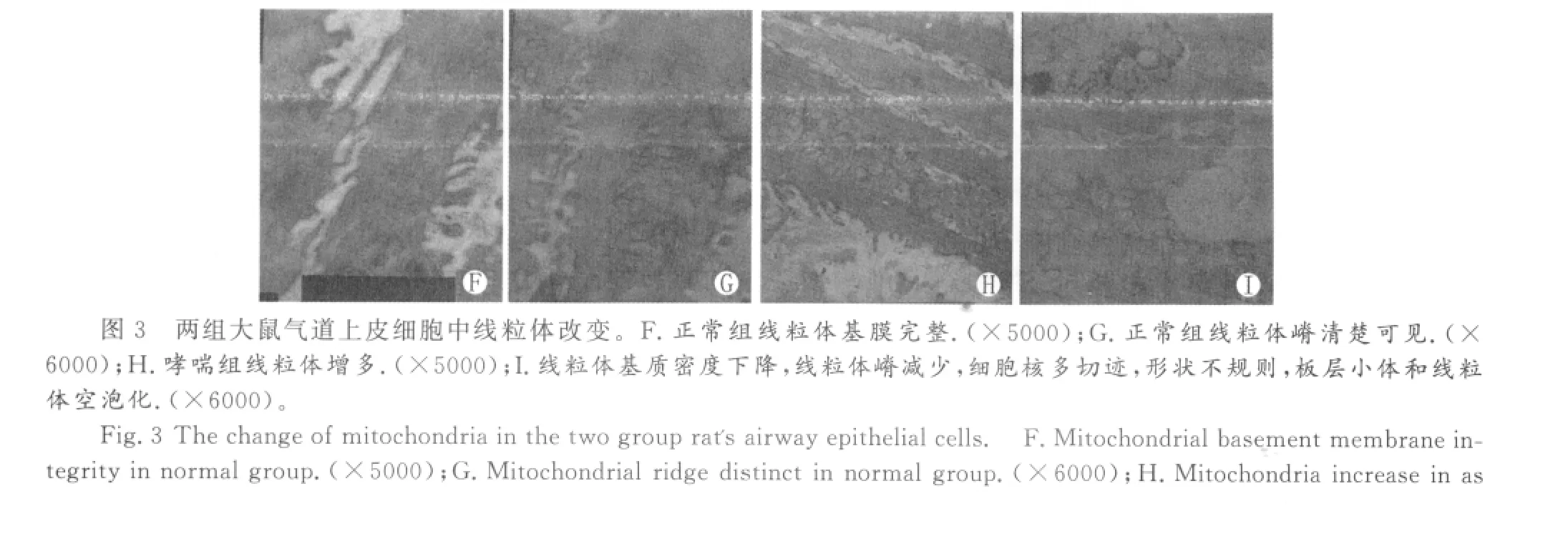
3.气道上皮细胞内线粒体超微结构改变
哮喘组大鼠气道上皮细胞内线粒体肿胀,线粒体增多(图H),线粒体基质密度下降,线粒体嵴减少,细胞核多切迹,形状不规则,板层小体和线粒体空泡化(图I)。
讨 论
哮喘气道重塑是哮喘气道的重要病理特点。从组织学角度来看,气道上皮的破坏和脱落是哮喘的特征性病理变化,众多柱状细胞的分离凝聚,导致creola小体的形成。上皮组织损伤同时即诱导出现上皮组织修复过程,其修复过程可导致柱状上皮的完全修复,也可导致鳞状细胞化生、杯状细胞增生、肺成纤维细胞聚集导致气道纤维化。在临床上哮喘患者由于气道的持续慢性炎症可直接造成气道上皮的损伤,出现气道上皮的破坏和脱落。本文通过透射电镜观察正常组雄性Wistar大鼠支气管上皮细胞层纤毛排列整齐,微绒毛密集,细胞内线粒体嵴清晰可见,线粒体结构完整;相邻细胞间可见相互接触由细胞膜凸起的微绒毛。哮喘大鼠气道上皮脱落,排列紊乱,杯状细胞增多,绒毛上皮核型不规则,出现早期凋亡改变。
由于气道上皮的损伤影响了哮喘气道功能,其机制有很多。首先,上皮屏障功能破坏使得抗原易于侵入,同时组织成分容易渗漏到气道。其次,由于上皮细胞可通过释放抑制因子和降解活性介质抑制气道的反应性,但气道炎症导致上皮细胞的破坏减轻了气道上皮的抑制作用。再次,气道细胞激活后释放包括纤维连接蛋白和转化生长因子-β(TGF-β)在内的多种介质,导致气道纤维化。
线粒体是产生内源性活性氧至关重要的细胞器,其与哮喘的关系密切[3]。线粒体是能量的重要来源,本实验通过透射电镜观察到在哮喘气道上皮细胞中线粒体形态及结构发生改变,线粒体嵴减少使能量供应减少,既往实验已证明线粒体功能障碍增加气道炎症[4]。线粒体基质密度下降,线粒体嵴减少,细胞核多切迹,形状不规则,板层小体和线粒体空泡化。这些结果表明,线粒体结构变化与过敏性哮喘密切相关。如果药物有改善线粒体结构或功能的作用有可能有助于开发新型药物分子治疗哮喘。有学者通过对比IL-4抗体干预BALB/c哮喘小鼠与哮喘小鼠发现IL-4抗体可明显改善气道上皮细胞中线粒体产生ATP功能,及哮喘小鼠气道反应性[3]。也有文献报道L-精氨酸能够改善哮喘小鼠气道上皮损伤并修复线粒体功能,从而改善哮喘气道炎症[5]。然而也有实验证明,有的药物能改善哮喘气道炎症但并不能改善线粒体结构变化及功能[6],其具体机制仍不清楚。由于结构是功能的基础,因此,本文通过对哮喘气道上皮细胞及线粒体的结构变化为进一步研究线粒体功能及哮喘治疗提供理论基础。
[1]Mabalirajan U,Aich J,Leishangthem GD,et al.Effects of vitamin E on mitochondrial dysfunction and asthma features in an experimental allergic murine model.J Appl Physiol,2009,107(4):1285-1292
[2]Xie M,Liu XS,Xu YJ,et al.ERK1/2 Signaling Pathway Modulates the Airway Smooth Muscle Cell Phenotype in the Rat Model of Chronic Asthma.Respiration,2007,74(6):680-690
[3]Mabalirajan U,Dinda AK,Kumar S,et al.Mitochondrial structural changes and dysfunction are associated with experimental allergic asthma.J Immunol,2008,181(5):3540-3548
[4]Aguilera-Aguirre L,Bacsi A,Saavedra-Molina A,et al.Mitochondrial dysfunction increases allergic airway inflammation.J Immunol,2009,183(8):5379-5387
[5]Mabalirajan U,Ahmad T,Leishangthem GD,et al.L-arginine reduces mitochondrial dysfunction and airway injury in murine allergic airway inflammation.Int Immunopharmacol,2010,10(12):1514-1519
[6]Ram A,Mabalirajan U,Singh SK,et al.Mepacrine alleviates airway hyperresponsiveness and airway inflammation in a mouse model of asthma.Int Immunopharmacol,2008,8(6):893-899
- 中国组织化学与细胞化学杂志的其它文章
- 宫颈异倍体细胞Ki67和P16蛋白的表达
- 阿霉素对心肌肌醇依赖酶l-JNK通路的影响

