骨髓间充质干细胞移植治疗生精细胞损伤模型大鼠的实验研究
王 聪 何志旭 周从容
1.贵州省贵阳市妇幼保健院辅助生殖科(550002);2.贵阳医学院组织工程及干细胞研究中心;3.贵阳医学院附属医院生殖中心
·基础研究·
骨髓间充质干细胞移植治疗生精细胞损伤模型大鼠的实验研究
王 聪1何志旭2周从容3
1.贵州省贵阳市妇幼保健院辅助生殖科(550002);2.贵阳医学院组织工程及干细胞研究中心;3.贵阳医学院附属医院生殖中心
目的:探讨骨髓间充质干细胞(MMSCs)在睾丸内定向分化为生精细胞用于治疗实验性雄性不育模型大鼠的可行性。方法:复苏冻存的MMSCs-GFP并培养传代后经睾丸网移植到经白消安处理的生精细胞损伤模型大鼠睾丸曲细精管内,移植后8周采样,观察睾丸质量指数、组织学表现和供体细胞分布,运用免疫荧光检测生殖细胞表面特异标志c-kit的表达。结果:MMSCs-GFP移植组右侧受体睾丸质量指数与模型组大鼠及自体未细胞移植的左侧睾丸相比有差异(P﹤0.01),与正常组大鼠睾丸质量指数相比无差异(P﹥0.05);光镜下显示曲精管内生精上皮明显恢复,荧光显微镜下观察MMSCs-GFP大部分迁移至曲精管基底部,免疫荧光结果显示移植组与自身未移植组相比,睾丸曲细精管内精原细胞表面特异标志基因c-kit表达有差异。结论:细胞冻存不影响MMSCs的增殖能力,MMSCs在体内生精微环境中能够定植并定向分化为生殖细胞。
骨髓间充质干细胞 男性不育症 移植 睾丸 动物模型
男性不育症的治疗逐渐由传统的药物治疗转换到辅助生殖领域。但是对于非梗阻性无精子症患者,由于其精子发生巢内没有单倍体生殖细胞,使卵胞质内单精子注射(ICSI)技术的应用受到限制。Brinster[1]首次报道,将精原干细胞(SSCs)移植到不育受体小鼠睾丸曲细精管后,供体SSCs启动了精子发生并产生具有授精能力的精子。虽然SSCs移植技术发展很快,但存在潜在问题,如SSCs来源数量少、在冷冻保存后是否仍保持其生物学特性、受试者睾丸对异体移植的细胞产生免疫反应等问题仍处于实验阶段。骨髓间充质干细胞(MMSCs)是近年来研究较多且深入的一类成体干细胞,它是具有高度自我更新和多向分化潜能及低免疫原性的干细胞[2]。本研究旨在将外源性MMSCs植入生精细胞损伤的不育症大鼠模型的睾丸中,探讨其在体内生精微环境中横向分化为生殖细胞可行性,以期为临床应用MMSCs治疗男性不育症提供理论依据。
1 材料与方法
1.1 主要试剂
L-DMEM培养基购自Gibco公司,胎牛血清(FBS)、0.4%无菌台盼蓝购自杭州四季青公司;胰蛋白酶购自Hyclone公司;白消安购自Sigma;鼠抗人c-kit单克隆抗体购自Santa Cruz公司;DylightTM594标记山羊抗大鼠IgG(H+L)为Biocare Medical公司产品;DAB试剂盒购自武汉博士德公司;10%水合氯醛由贵阳医学院附属医院配制;携带绿色荧光蛋白的SD大鼠骨髓间充质干细胞(MMSCs-GFP)由Cyagen Biosciences研究所提供。
1.2 动物模型建立及鉴定
取6周龄,体重200±20g/只,健康、清洁级、雄性SD大鼠80只(动物合格证号:SCXK(黔)2002-0001)。采用白消安处理去除内源性SSCs而建立生精细胞损伤不育大鼠模型:将白消安溶于DMSO中(5mg/ml),以50mg/kg剂量单次腹腔注射大鼠(模型组)(60只)。正常对照组(20只)注射等量的含10%DMSO的生理盐水。白消安处理4周后,随机抽取大鼠,观察睾丸体积改变及组织学表现,进行动物模型鉴定。
1.3 供体MMSCs-GFP的复苏及纯化扩增
本研究采用直接贴壁法,体外培养及扩增携带绿色荧光蛋白的SD大鼠骨髓间充质干细胞(MMSCs-GFP)。将MMSCs-GFP从液氮罐中取出,迅速放入37℃水浴中,在1min内使其完全融化。加入含有10%FBS的L-DMEM培养液,1 000 r/min离心5min,弃上层液,加入培养液后接种于底面积为25cm2的无菌塑料培养瓶中,置于37℃、5%CO2温箱培养,次日换液。以后每2~3d用含10%FBS的L-DMEM全量换液,待细胞融合80% ~90%时,用含0.02%EDTA的0.25%的胰蛋白酶消化后按1∶3比例传代。体外扩增和富集至第四代后,以0.25%胰蛋白酶消化,再加入含10%FBS的L-DMEM 5ml离心,用无血清L-DMEM培养液制成终浓度5×106cell/ml的细胞悬液,加入0.4%无菌台盼蓝染液,置于37℃水浴保温备用。
1.4 MMSCs-GFP的移植
白消安处理不育模型大鼠4周后,将其分为两组,即MMSCs-GFP移植组(30只)和模型组(30只)。移植组以10%水合氯醛(0.4 ml/100g)腹腔注射麻醉后,仰卧固定。以碘酒及酒精消毒皮肤,沿大鼠腹中线切口,取出睾丸,以1ml无菌注射器吸取收集的MMSCs-GFP细胞悬液。将针尖轻轻插入睾丸网中,将其经睾丸网注入移植组大鼠的右侧睾丸中(200μl/睾丸)。对照组及模型组大鼠右侧睾丸以同法注入等量的L-DMEM液。同法将等量生理盐水注入3组大鼠左侧睾丸中,以作自体对照。细胞移植完毕,将双侧睾丸经腹腔顺行回纳入大鼠阴囊内,手术缝合大鼠腹壁,青霉素抗炎(8U/只)。将大鼠置于温暖处,待其复苏后放回饲养室。
1.5 MMSCs-GFP移植后相关指标检测
①生存质量:自细胞移植后1周内,观察各组大鼠的一般情况及存活状态。②睾丸质量指数:自细胞移植8周后,将3组大鼠颈椎脱臼处死后,计算每只大鼠的睾丸质量指数[睾丸质量指数=(睾丸重量/体重)×10 000]。③组织学检测:细胞移植8周后取3组受体大鼠的睾丸,作常规石蜡包埋切片经HE染色后,光学显微镜下观察睾丸组织学表现。将蜡块切成3μm切片,脱蜡制成白片,以90%甘油的PBS封片,荧光显微镜下观察MMSCs-GFP定植情况(GFP荧光:激发最大吸收峰为488nm,最大发射峰为507nm,呈绿色);将石蜡切片经二甲苯脱蜡和梯度酒精水化后,蒸馏水冲洗3遍,每张切片滴加50μl的3%H2O2,室温孵育 10min,滴加 50μl胃蛋白酶消化,于37℃孵育15min后,滴加50μl鼠抗人c-kit单克隆抗体(1:80),37℃孵育 30min,4℃过夜,滴加DylightTM594标记山羊抗大鼠IgG(1:180 PBS 稀释)50μl,避光37℃孵育1h,PBS冲洗5min×3次,用含90%甘油的PBS封片,荧光显微镜下观察c-kit的表达情况(DylightTM594荧光:激发最大吸收峰为591nm,最大发射峰为616nm,呈红色)。
1.6 统计学处理
数据分析统计采用SPSS15.0软件,结果用均数士标准差(±s)表示,组间比较采用单因素方差分析(q检验)。
2 结果
2.1 生精细胞损伤不育模型的鉴定
白消安处理2周后,大鼠活动明显减少,毛发直立、晦暗无光泽,食欲下降、消瘦,体重均较同时期正常对照组轻;4周时,未发现大鼠死亡,处死后取出睾丸,发现睾丸体积均小于对照组。
睾丸组织学表现:从图1A可见,正常大鼠睾丸曲细精管分布正常,各级生精细胞层次清楚,基底膜最表面可见到SSCs,各级生精细胞之间可见支持细胞,曲细精管中央可见到少许精子。图1B为白消安处理4周后,模型组大鼠睾丸曲细精管间可见间质细胞增生,各级生精细胞已完全消失,残存精母细胞空泡变性,支持细胞相对增多,曲细精管中央未见精子。

图1 受体大鼠睾丸组织切片(HE×200)
2.2 MMSCs-GFP移植后相关指标
2.2.1移植后生存质量术后第7天,移植组15只大鼠死亡4只。模型组和正常组大鼠经睾丸网移植L-DMEM液,模型组死亡3只(3/15),正常组死亡2只(2/15)。随后再无动物死亡。
2.2.2睾丸质量指数如表1所示,模型组大鼠两侧睾丸质量指数均明显下降,与正常组相比有差异(P﹤0.01);移植组右侧睾丸质量指数明显回升,与自体未移植的左侧睾丸质量指数及模型组相比有差异(P﹤0.01),与正常组相比无差异。见表1。
表1 各组大鼠睾丸质量指数计算结果(±s)

表1 各组大鼠睾丸质量指数计算结果(±s)
组织 正常组 模型组 移植组左侧睾丸(未移植)40.969 ±3.6793 27.095 ±1.4371 27.676 ±1.6168右侧睾丸(移植) 41.269 ±2.6169 27.031 ±1.3422 37.339 ±3.7852
2.2.3组织学MMSCs-GFP移植后第8周,光镜下显示对照组睾丸曲细精管分布正常,各级生精细胞层次清楚,其间可见支持细胞,基底膜最表面可见SSCs,曲细精管中央可见到精子(图2A);而模型组右侧睾丸组织(移植L-DMEM液)及移植组左侧睾丸组织(移植L-DMEM液)曲细精管内仍只见残存精母细胞空泡变性,各级生精细胞仍未明显恢复,曲细精管中央未见精子(图2B、D);而MMSCs-GFP移植组右侧受体睾丸(移植MMSCs-GFP)曲细精管开始恢复生精结构,各级生精细胞数量明显增加并逐渐依次排列,从基底部至管腔中央依次为SSCs,初级精母细胞,次级精母细胞,精子细胞,其间可见支持细胞均匀排列,管腔中央偶见少许精子,但也存在部分曲细精管生精过程尚未恢复的情况(图2C)。
2.2.4 MMSCs-GFP的定植情况移植 MMSCs-GFP后8周,荧光显微镜下移植组右侧睾丸组织大部分曲细精管管腔内的基底膜上方有大量GFP+细胞,在管腔中央偶见散在GFP+细胞,在部分间质中也发现少量GFP+细胞,(图3A);而其自体未移植干细胞的左侧睾丸,曲精管间质及管腔内均未发现GFP+细胞(图3B)。

2.2.5免疫荧光检测生精细胞表达结果移植MMSCs-GFP后8周,荧光显微镜下观察精原细胞表面特异抗原标志c-kit的表达情况。移植组右侧受体睾丸大部分曲细精管内,基底膜上方生精细胞部位发现大量红色荧光,管腔中央未见(图4A);而自体对照的左侧睾丸曲细精管管腔中几乎无红色荧光,仅靠近基底膜上方及间质中偶见红色荧光(图4B)。
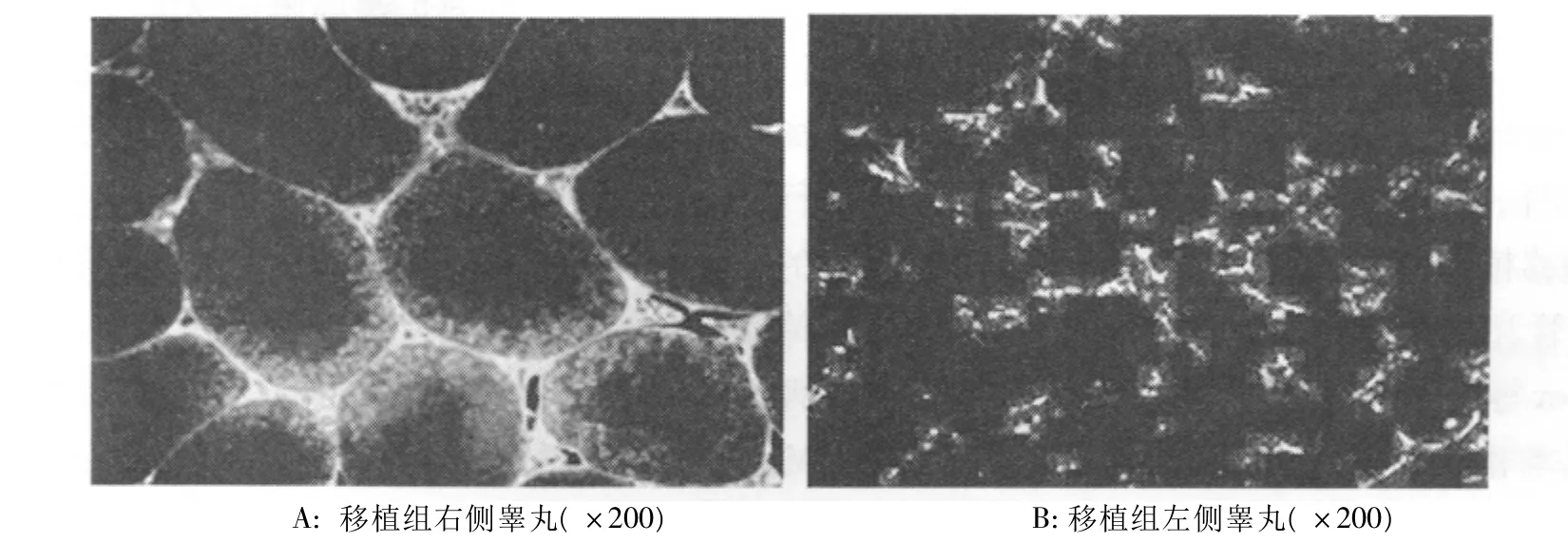
图4 移植MMSCs-GFP后8周c-kit红色荧光的表达(箭头所示为精原细胞)
3 讨论
3.1 不育动物模型的建立
抗肿瘤药物白消安目前已被国际公认作为建立不育动物模型的经典药物。本实验选用6周龄雄性SD大鼠作为受体,在移植前以白消安处理,消除了睾丸内的精原细胞成功复制了不育模型。
3.2 供体移植干细胞的选择
胚胎干细胞(ESC)被誉为“万能细胞”,研究证明ESC在经过体外诱导后,可以形成单倍体的雄性生殖细胞[3]。但ESC的应用受到取材和伦理方面的制约。而研究表明,成体MMSCs具有多向分化潜能,在一定条件下能分化为多种不同组织的细胞[4]。选取MMSCs为供体细胞具以下优势:①克服ESC取材和伦理限制,骨髓采集操作方便;②易于体外培养扩增并保持干细胞特性;③具有低免疫原性,能降低细胞移植后免疫排斥反应;④MMSCs作为成体干细胞,形成肿瘤的倾向性极低,在目前发表的文献中未见MMSCs生成肿瘤的报道。Pittenger等[5]研究表明,扩增一、二代后细胞纯度分别达95%、98%。细胞标记是细胞移植实验不可缺少的环节。GFP是一种具有自发荧光的小分子蛋白[6],为追踪MMSCs在受体睾丸中的定植情况,本实验以携带荧光标记GFP的MMSCs作为供体细胞。
本研究将冻存的MMSCs-GFP复苏24h后,光镜下示大部分细胞贴壁,约5 d达融合状态,进行传代。传至第4代时,细胞更均匀,有序地呈纤维细胞样分布,排列成漩涡状,仍具较强的增殖活力。MMSCs-GFP传至第8代,荧光显微镜下可见GFP仍能稳定表达,这说明冻融过程并不影响MMSCs-GFP的生物学活性。
3.3 MMSCs的移植及其在睾丸中的分化
干细胞所处的微环境,控制着干细胞的自我更新和定向分化[7]。研究表明[8],睾丸支持细胞除构成生精过程的微环境、具有营养作用、促进精原细胞的增殖与分化外,也可促进睾丸外其他细胞分化。目前将干细胞移植睾丸的方法有3种:曲细精管注入法、输出小管注入法和睾丸网注入法。1997年Takehiko Ogawa等[9]报道这3种方法的移植成功率及移植效果基本相似。前两种方法都需要显微操作仪器辅助,要求操作人员技术熟练,且操作时间较长,而睾丸网注入法不需要显微操作仪器,也不需要特殊的细胞悬液注射设备,使用1ml注射器即可,操作简便,操作时间较短,因此,本实验采用该种方法进行MMSCs-GFP移植,平均完成1例移植需时12min。
移植MMSCs-GFP 8周后,光镜下显示,被清除内源性生精细胞的受体大鼠睾丸曲细精管内开始恢复生精过程。同时,荧光显微镜观察结果显示,经睾丸网注射的大鼠外源性MMSCs-GFP在受体大鼠睾丸曲细精管中得以归巢并增殖。这说明,开始恢复的生精细胞来源于供体MMSCs,外源性MMSCs可以逆向通过血睾屏障,在基底膜位置重新定位,进行自我增殖分化并启动精子发生。支持细胞不仅可以识别SSCs,还可以识别外源的MMSCs,并允许其回到曲细精管基底膜位置,重新开始增殖、分化。与此同时,本研究也观察到曲细精管的部分间质部位也有绿色荧光。这与2006年Yazawa[10]关于骨髓基质干细胞向间质细胞横向分化的结果一致。他们的结果表明,GFP阳性的细胞定位在睾丸间质并表达间质细胞特异的分子标志:P450sc、3β-HSD和P450c17。由此,推测本实验组受体睾丸内的绿色荧光间质细胞也来源于MMSCs,这可能是由于在进行细胞移植时,因睾丸网部位很薄,承受压力很小,不可避免有一部分MMSCs进入睾丸间质中,在该微环境中横向分化为间质细胞。同时,由于经睾丸网注入的干细胞是借助曲细精管管腔内液体自身的流动将外源干细胞带到睾丸中各条曲细精管内,这就难以避免其流动位置的随机性,所以未能重建生精过程的个别曲细精管很可能就是外源MMSCs没有涉及的部位。
Rossi等[11]发现c-kit及其配体干细胞因子(c-kit/SCF)对精子的发生过程起调节作用,SCF由睾丸支持细胞产生,而其受体c-kit在精原细胞中表达。Schrans-Stassen等[12]采用原位杂交等方法通过c-kit对Aal、Al~A4、In和B型精原细胞进行分离和鉴定。本研究对MMSCs-GFP移植受体睾丸进行免疫荧光染色,检测精原细胞表面特异基因c-kit的表达情况,结果显示在MMSCs-GFP移植组的受体睾丸曲细精管基底膜上方,原始精原细胞的位置发现大量c-kit阳性荧光的细胞,这进一步说明移植的MMSCs-GFP在受体睾丸内不但进行增殖,并且还分化为精原细胞。而未移植细胞的对侧睾丸基底膜位置也发现少许c-kit阳性细胞,这可能来源于残存的精原干细胞。本实验结果是在干细胞移植后第8周所观察的,由于时间较短,精子分化较少,同时对于MMSCs来源的精原细胞的生殖功能如何在本实验中未能得以说明,有待下一步实验研究。
综上所述,MMSCs在睾丸内分化为精原细胞是可行的,为不育症治疗的临床研究提供了可靠的实验依据。虽然目前运用MMSCs进行临床治疗还面临着巨大的挑战,但相信随着研究的深入,运用MMSCs进行治疗将给男性不育症患者带来新的曙光。
1 Brinster RL,Avarbock MR.Germline transmission of donor haplotype following spermato - gonial transplantation[J].Porc Natl Acad sci,1994,91(24):11303 -11307.
2 Bartholomew A,Sturgeon C,Siatska M,et al.Mesenchymal stem cues suppress lyruphocyte proliferation in vitro and prolong skin graft Surrival in vivo[J].Exp Hematol,2002,30(1):42.
3 Bowles J,Knight D,Smith C,et al.Retinoid signaling determines germ cell fate in mice[J].Science,2006,312(5773):516 -600.
4 Minguell JJ,Erices A ,Conget P.Mesenchymal stem cells[J].Exp Biol Med(Maywood),2001,226(6):5072.
5 Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesen-chymal stem cells[J].Science,1999 ,284(5411):143-147.
6 Shimomura O.The discovery of aequorin and green fluorescent protein[J].J Microsc,2005,217(1):1 -15.
7 Raffaghello L,Bianchi G,et al.Human mesenchymal stem cells inhibit neutrophil apoptosis:a model for neutrophil preservation in the bone marrow niche[J].Stem Cells,2008,26(1):151 - 162.
8 Basta G,Racanicchi L,Mancuso F,et al.Transdifferentiation Molecular Pathways of Neonatal Pig Pancreatic Duct Cells into Endocrine Cell Phenotypes[J].Transplant Proc,2004,36(9):2857 -2863.
9 Ogawa T.Spermatogonial transplantation:the principle and possible applications.J Mol Med,1997,79(7):368.
10 Yazawa T,Mizutani T,Yamaka K,et al.Differentiation of Adult Stem Cell Derived from Bone Marrow Steoma into Leydig or Adrenocortical Cells.Endocrinology,2006,147:4101 -4111.
11 Rossi P,Sette C,Dolci S,et al.Role of c - kit in mammalian spermatogenesis[J].Endocrinol Invest,2000,23(9):609 -615.
12 Schrans- Stassen BH,Van De Kant HJ,De Rooij DG,et al.Differential expression of c-kit in mouse undifferentiated and differentiating type A spermatogonia[J]Endocrinology1999,140(12):5894 -5898.
Transplantation of marrow mesenchymal stem cells into seminiferous tubule of rat model with spermatogenic cells damaged:a experimental study
Wang Cong1,He Zhixu2,Zhou Congrong3
1.Department of Assisted Reproduction,Maternal&Child Health Hospital of Guiyang,Guiyang550003;2.Tissue engineering&Stem Cell Research Center,Guiyang Medical University;3.Medical Reproduction Center,Guiyang Medical University
Objective:To investigate whether the marrow mesenchymal stem cells(MMSCs)could differentiate into spermatogenic cells in a rat model of male infertility.Methods:The frozen MMSCs-GFP were recovered and cultured,and then transplanted into the seminiferous tubule of the right testis of rat model of spermatogenic cells injure established with Busulfan(50mg/kg),with the left testis untreated as self control.The testes were collected 8 weeks later.The testicle weight index,testicular histology and donor cell distribution were observed.Immunofluorescence was employed to test the germ cell-specific marker c-kit expression.Results:The testicle weight index of MMSCs-GFP transplanted testis was comparable to that of normal rat testes(P>0.05),but significantly different from that of self-control testis(P<0.01).No local or systemic inflammartory reaction was observed,while the spermatogenic epithelium was regenerated in the the MMSCs-GFP transplanted testis.Fluorescence microscopy showed that most of MMSCs-GFP moved to the basilar zone of seminiferous tubule.The ckit expression in the seminiferous tubule of the MMSCs-transplanted testis was significantly different from that of the selfcontrol testis.Conclusion:Cryopreservation did not affect the proliferation ability of MMSCs.MMSCs transplanted into convoluted seminiferous tubule could differentiated into spermatogenic cells.
Marrow mesenchymal stem cells;Male Infertility;Transplantation;Testis
10.3969/j.issn.1004 -8189.2012.11
2012-04-27
2012-06-24
[责任编辑:王丽娜]

