两种雌雄同株榕树榕果内小蜂空间分布格局
王振吉, 李国昌, 彭艳琼, 杨大荣,*
(1. 中国科学院西双版纳热带植物园, 云南 昆明 650223; 2. 楚雄师范学院化学与生命科学系, 云南 楚雄 675000; 3. 楚雄市林业局, 云南 楚雄 675000)
两种雌雄同株榕树榕果内小蜂空间分布格局
王振吉1,2, 李国昌3, 彭艳琼1, 杨大荣1,*
(1.中国科学院西双版纳热带植物园,云南 昆明650223; 2.楚雄师范学院化学与生命科学系,云南 楚雄675000; 3.楚雄市林业局,云南 楚雄675000)
在雌雄同株榕树榕果内, 除传粉榕小蜂外, 还寄生着很多种类的非传粉榕小蜂。为弄清传粉和非传粉榕小蜂在榕果内的空间分布格局, 以西双版纳地区的垂叶榕和高榕及与之相关的传粉和非传粉榕小蜂为研究材料,比较了不同种类小蜂所在瘿花花梗长度差异。结果表明:(1) 在高榕中,Eupristinasp.所在瘿花花梗平均长度最长,传粉榕小蜂Eupristina altissima所在瘿花花梗长度次之。Micranisa ralianga、Sycobiasp.和Sycoscaptersp. 2所在瘿花花梗长度无显著差异。Sycobiasp.、M.ralianga以及Sycoscaptersp. 2所在瘿花花梗长度范围要窄于传粉榕小蜂所在瘿花花梗长度范围。这都说明这三种果外产卵非传粉榕小蜂与传粉榕在空间生态位上存在部分的分离。(2)在垂叶榕中,Eupristina koningsbergeri可以分布在从最外层到内层的瘿花, 而大多数Walkerellasp.都集中在靠近果壁的瘿花内, 表明两者也存在部分空间生态位的分离。
榕小蜂; 空间分布; 瘿花; 花梗
榕树与榕小蜂互利共生体系被认为是动植物间互作关系最特化、最具代表性的互利共生系统之一(Janzen, 1979; Wiebes, 1979; Herre et al, 1999)。在榕-蜂共生体系中, 除传粉榕小蜂外, 还生活着许多非传粉榕小蜂(Hawkins & Compton, 1992; West & Herre, 1994; Kerdelhué & Rasplus, 1996a; Jousselin et al, 2001)。非传粉榕小蜂一直以来都被认为对互利共生系统具有负面的影响(Kerdelhué & Rasplus,1996a)。传粉和非传粉榕小蜂后代在榕果内有不同的空间分布格局(Kerdelhué & Rasplus, 1996b; Zhai et al, 2008), 这可能降低非传粉榕小蜂对传粉小蜂的危害性。
在雌雄异株榕树中, 雌树榕果中小花的花柱较长, 不适合传粉榕小蜂产卵(Nefdt & Compton, 1996), 雄树榕果的雌花花柱较短, 这些雌花被传粉榕小蜂或非传粉榕小蜂所寄生, 所以尽管雄果中有雌花和雄花, 但是在功能上, 它们是雄性的, 只能产生花粉和小蜂(Kjellberg et al, 1987);而在雌雄同株榕树中, 每个榕果既会产生种子又会产生榕小蜂(Yang et al, 2001)。在雌雄同株榕树中, 由于花梗长度差异, 榕果的雌花分数层排列, 但是几乎所有雌花的柱头都呈现在同一个平面上, 这是由于花柱和花梗长度的变异所致(Ganeshaiah et al, 1999)。靠近果腔的为内层, 靠近果壁的为外层, 在外层和内层中间的是中层(Kerdelhué & Rasplus, 1996b; Kerdelhué et al, 2000)。在雌雄同株榕果中, 传粉榕小蜂偏爱于把卵产在靠近果腔花柱较短的小花中,而位于靠近果壁花柱较长的花产生种子(Nefdt & Compton, 1996; Anstett, 2001; Jousselin et al, 2001)。Kerdelhué & Rasplus(1996a)研究了非洲的非传粉榕小蜂对聚果榕亚属榕树榕-蜂互利共生系统的影响,发现进入Ficus sur榕果内产卵的Sycophaga silvestrii在大多数情况下会把卵产在内层小花, 也就是短花柱小花内。只有在繁殖雌蜂数量较多, 对产卵位点竞争激烈的情况下才会把卵产在外层小花内, 但在这个层次小花上产卵的数量仍然很少。Apocryptophagussp. 2和Apocryptophagussp. 3也将卵产在内层小花内。另外, 在Ficus vallis-choudae产卵的Apocryptophagussp. 4也将卵产在内层小花。与Kerdelhué & Rasplus (1996a)的研究结果不同, Zhai et al (2008)研究了西双版纳聚果榕隐头果内传粉和非传粉榕小蜂空间分布格局, 发现除Platyneura testacea外, 其他种类非传粉榕小蜂(Platyneura mayri、Apocrypta westwoodi、Apocryptasp.)主要利用榕果外层小花。以上两研究结果虽然存在差异, 但都说明非传粉榕小蜂会在利用榕果内不同层次小花时具有一定倾向性。然而, 上述所有研究都仅仅把榕果内小花分为内层、外层、中层三个层次, 但事实上榕果内小花长度是连续型定量数据, 而非定性数据, 仅仅分成三个层次, 必然会导致研究结果存在一定的偏差。所以, 在研究榕果内小蜂空间分布格局过程中, 有必要将花梗的长度细分化。
高榕(Ficus altissimaBlume)和垂叶榕(Ficus benjaminaLinnaeus)是西双版纳地区常见雌雄同株榕树种类。两种榕树都属于榕属、环纹榕组, 但榕果物候期存在明显差异。两种榕树中都寄生着多种非传粉榕小蜂, 其中高榕中有24种非传粉榕小蜂(Gu et al, 2003);垂叶榕中有12种非传粉榕小蜂(Bai et al, 2008), 但两种榕树的非传粉榕小蜂种类均不同。本研究以高榕、垂叶榕,以及与其相关的传粉和部分非传粉榕小蜂为材料, 研究了两种榕树榕果内各种小蜂空间分布规律的异同, 以回答如下两个主要问题:1)两种榕树榕果内传粉和非传粉榕小蜂是否存在空间生态位分离;2) 两种榕树榕果内各种非传粉榕小蜂之间是否存在空间生态位分离。
1 材料与方法
1.1 材料
研究样地—西双版纳热带植物园(XTBG)位于云南省西双版纳傣族自治洲境内。地理位置为N21°41'~22°36', E99°56'~101°25', 海拔560~680 m, 地处东南亚热带北缘, 为热带季风性气候(Guan et al, 2007)。
高榕(Ficus altissimaBlume)隶属桑科(Moraceae),榕属榕亚属(Urostigma)组 (Urostigma), 环纹榕亚组(Conosycea), 为高大乔木。本文涉及的与之相关的小蜂为: 传粉榕小蜂Eupristina altissima; 非传粉榕小蜂Eupristinasp.、Micranisa ralianga、Sycobiasp.以及Sycoscaptersp. 2。
垂叶榕 (Ficus benjaminaLinnaeus)也为环纹榕亚组的乔木。本文涉及的与之相关的小蜂为: 传粉榕小蜂Eupristina koningsbergeri和非传粉榕小蜂Walkerellasp.。
1.2 方法
1.2.1 小蜂所在瘿花花梗长度测量方法 2008年,开始在西双版纳热带植物园内分别选取1株高榕和1株垂叶榕。当两种榕树结果后, 分别观察各种小蜂在两种榕树隐头果的产卵顺序和产卵情况, 并标记各种小蜂产卵比较集中的区域。当榕果发育至雄花期, 小蜂尚未离开瘿花, 但是种类已经可以辨别时, 在标记区域采摘高榕和垂叶榕的榕果各10个带回实验室, 放入用75%酒精内, 使瘿花内小蜂死亡, 从而避免其离开瘿花进入果腔。在实验室内测量并记录隐头果的直径、轴长。然后将榕果剖开, 用镊子挑出瘿花, 置于培养皿中, 在OLYMPUSSZX12 体视镜下测量瘿花花梗长度。每测完一个瘿花后, 用镊子夹裂瘿花, 将小蜂从瘿花中用镊子挑出, 然后鉴定其种类并做好记录。
1.2.2 数据分析方法 采用单因素方差分析比较各种小蜂所在瘿花的花梗长度差异。其中, 方差同质性检验采用Levene检验, 多重比较采用LSD法。采用单样本K-S检验对各种小蜂所在瘿花花梗长度进行正态性检验。所有分析都采用SPSS16.0软件。
2 结 果
2.1 高榕榕果内小蜂的空间分布
在高榕中,Eupristinasp.所在瘿花花梗平均长度最长, 传粉榕小蜂E. altissima所在瘿花花梗长度次之。M. ralianga和Sycoscaptersp. 2所在瘿花花梗长度无显著差异。虽然Sycobiasp.所在瘿花花梗长度与M. ralianga以及Sycoscaptersp. 2所在瘿花花梗长度均存在差异, 但统计学检验不显著(表1)。
从小蜂所利用的小花花梗长度范围来看, 传粉榕小蜂以及另一种进入果内产卵的非传粉榕小蜂Eupristinasp.可以占据靠近果壁、靠近果腔以及果壁与果腔之间的瘿花。而其他3种果外产卵的非传粉榕小蜂只能占据从果壁到果腔内一定长度范围的瘿花, 都不能占据靠近果腔的瘿花。这说明这3种果外产卵非传粉榕小蜂与传粉榕小蜂在空间生态位上存在部分分离, 并且这3种小蜂空间生态位也并非完全重叠。其中,M. ralianga和Sycoscaptersp.2所在瘿花花梗长度范围大体一致, 而Sycobiasp.所在瘿花花梗长度范围最窄, 仅能利用从外层到中层的小花 (表1) 。
高榕榕果内5种小蜂所在瘿花花梗长度都属于正态分布(表2)。这也表明这些小蜂的繁殖雌蜂产卵时, 可能并不能主动识别并区分具不同花梗长度的小花;而3种果外产卵非传粉榕小蜂不能较靠近果腔的小花产卵可能是由于榕果形态以及其自身产卵器长度所限。
2.2 垂叶榕榕果内小蜂的空间分布
在垂叶榕中, 传粉榕小蜂E. koningsbergeri与Walkerellasp.所在瘿花花梗长度平均值无显著差异。从两种小蜂所占据瘿花花梗长度范围来看, 所占据瘿花花梗长度范围大体一致, 且分布在从外层到内层的瘿花内,但这并不能说明两者所占据的生态位完全重叠。Walkerellasp.所在瘿花的花梗长度属于非正态分布, 其繁殖雌蜂会将大多数卵产在靠近果壁的小花内。
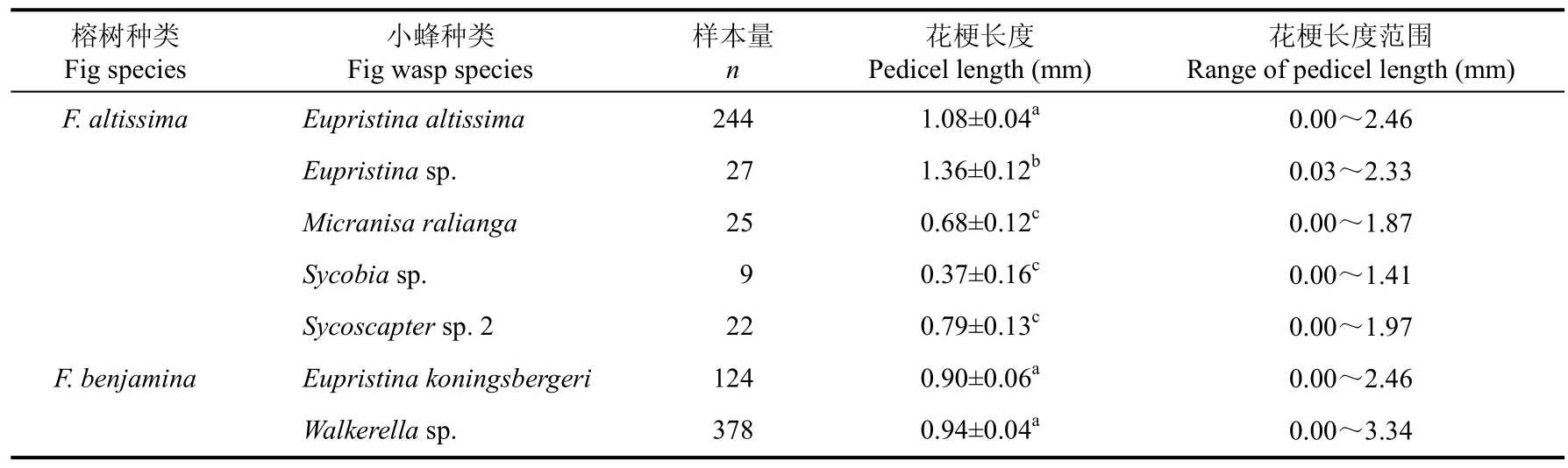
表1 不同种类小蜂所在瘿花的花梗长度比较Tab. 1 Comparison of pedicel length of galls containing different fig wasps

表2 不同种类小蜂所在瘿花的花梗长度正态性检验Tab. 2 Normal distribution test of pedicel length of galls containing different fig wasps
3 讨 论
生态位分化假说认为, 当资源存在空间差异并且每一物种都在其有竞争优势的位置定居时, 大量物种可以共存(Sun et al, 2008)。每种榕树的榕果内可以寄生多种非传粉榕小蜂, 有些榕树上寄生的非传粉榕小蜂种类多达30种以上(Compton & Hawkins, 1992)。如此多的小蜂能够共存在同一榕果内, 那么这些小蜂或者存在时间生态位的分化, 或者是通过利用果内不同类型小花而达到空间生态位的分化(Proffit et al, 2007)。在雌雄同株榕树的隐头果内由于花梗长度的差异, 导致雌花子房分层明显(Ganeshaiah et al, 1999)。可能正是由于这种分层现象为多种榕小蜂共同栖息于同一榕果提供了空间基础(Kerdelhué & Rasplus, 1996b)。
进入榕果产卵的传粉榕小蜂的产卵器不能到达具较长度花柱的小花子房, 它们只能在较短花柱小花内繁殖后代(Ramirez, 1974)。本研究结果表明,高榕和垂叶榕的传粉榕小蜂可以分布在从最外层到最内层的瘿花中, 即它们可以利用果内不同空间分布类型的小花资源。果外产卵的非传粉榕小蜂则均不能利用靠近果腔的小花,说明虽然这些非传粉榕小蜂小蜂和传粉榕小蜂在空间生态位上存在重叠, 但是也存在部分分离的现象。这种生态位的分离对维持榕-蜂互利共生系统在面对寄生的情况下维持稳定具有积极的意义。因为, 大部分果外产卵非传粉小蜂占据外层子房可以减少对传粉小蜂的危害, 保证了传粉小蜂的种群维持, 进而保证了榕树的雄性功能(Zhai et al, 2008)。
在高榕中, 果外产卵的非传粉榕小蜂Sycobiasp.、M. ralianga和Sycoscaptersp.2所在瘿花花梗长度范围虽存在明显差异;但三种非传粉榕小蜂所在瘿花梗长度都属于正态分布, 这表明这三种小蜂的繁殖雌蜂可能并不会对不同花梗长度小花进行识别, 它们选择哪些小花来产卵是一种随机行为。它们所利用瘿花花梗长度范围差异可能是由于其产卵器长度以及榕果不同发育历期形态共同决定的。随着榕果的增大, 不同种类的非传粉小蜂按照不同的时间顺序到达榕果产卵, 而它们的产卵器长度也是不相等的, 越是后来产卵的小蜂具有越长的产卵器(Zhai et al, 2008)。榕果果壁的增厚限制了它们在内层子房中产卵, 因而在不同的果壁厚度产卵的非传粉小蜂也有可能把卵产到相同层次的瘿花子房内(Zhai et al, 2008)。前期研究发现Sycobiasp.、M. ralianga和Sycoscaptersp.2都是用产卵器刺穿榕果果壁, 然后将卵产在小花子房或瘿花内。Sycobiasp.在榕果发育雌花前期产卵, 虽然此时榕果较小, 果壁和子房层较薄, 但是其产卵器可能较短, 导致其不能利用靠近果腔的小花。Micranisa ralianga和Sycoscaptersp.2产卵器长度虽然可能较长, 但由于它们都在间花期产卵产卵, 此时榕果较大, 果壁和子房层加厚, 也导致它们不能利用靠近果腔的小花。在垂叶榕中, 果外产卵的非传粉榕小蜂Walkerellasp.所在瘿花多接近果壁,但由于其寄生的瘿花及其花梗在发育过程中异常膨大, 这就导致Walkerellasp.与E. koningsberger所在瘿花花梗未体现出长度差异。
Eupristinasp.与高榕传粉榕小蜂所占据的生态位几乎完全重叠。Eupristinasp.虽然也属于非传粉榕小蜂, 但它与传粉榕小蜂都属于同一个属, 其产卵方式、产卵时间与传粉榕小蜂一致。重叠的生态位必然导致Eupristinasp.与传粉榕小蜂之间激烈的资源竞争。但可能是由于苞片口形态结构不仅限制进入榕果内的传粉榕小蜂数量, 也限制了进入榕果内Eupristinasp.数量, 从而削弱了Eupristinasp.对互利共生系统的影响。
总之, 本实验的结果表明,在高榕和垂叶榕中,果外产卵的非传粉榕小蜂与传粉榕小蜂, 以及这些非传粉榕小蜂之间都存在着或多或少的空间生态位分离, 进而达到共存。而进入果内的Eupristinasp.与传粉榕小蜂虽然在空间生态位上重叠, 但由于苞片口限制了进入榕果内Eupristinasp.数量, 也导致了Eupristinasp.的影响也不会导致互利共生系统的崩溃。
致谢:感谢西双版纳热带植物园协同进化组全体老师和同学在实验和论文写作过程中给予的鼓励与帮助。
Anstett MC. 2001. Unbeatable strategy, constraint and co–evolution, or how to resolve evolutionary conflicts: the case of the fig/wasp mutualism [J].Oikos,95(3): 476–484.
Bai LF, Yang DR, Compton SG. 2008. A gall midge inhabiting the figs of Ficus benjamina in Xishuangbanna, south-western China[J]. Symbiosis,45(1-3): 149–152.
Compton SG, Hawkins BA. 1992. Determinants of species richness in southern African fig wasp assemblages[J]. Oecologia,91(1): 68–74.
Ganeshaiah KN, Kathuria P, Shaanker RU. 1999. Does optimal packing of flowers in syconia shape style length variation in monoecious figs [J]Biotropica,31(2): 312–320.
Gu HY, Yang DR, Zhang GM, Peng YQ, Song QS. 2003. Species of fig wasps in Ficus altissima and their ecological characters[J]. Chn J Ecol,22(2): 70-73. [谷海燕,杨大荣,张光明,彭艳琼,宋启示. 2003.高榕隐头果内寄生蜂种类及生态学特征初步观察[J].生态学杂志,22(2): 70–73.]
Guan JM, Peng YQ, Yang DR. 2007. Host sanctions in fig—fig wasp mutualism [J]. Biodivers Sci,15(6): 626-532. [管俊明,彭艳琼,杨大荣. 2007.榕-蜂互惠关系中榕树对未传粉榕小蜂的惩罚效应[J].生物多样性, 15(6): 626-532.]
Hawkins BA, Compton SG. 1992. African fig wasp communities–undersaturation and latitudinal gradients in species richness[J]. J Anim Ecol,61(2): 361–372.
Herre EA, Knowlton N, Mueller UG, Rehner SA. 1999. The evolution of mutualisms: exploring the paths between conflict and cooperation [J]. Trends Ecol Evol,14(2): 49–53.
Janzen DH. 1979. How to be a fig [J]. Annu Rev Ecol Syst,10: l3–51.
Jousselin E, Rasplus JY, Kjellberg F. 2001. Shift to mutualism in parasitic lineages of the fig/fig wasp Interaction [J]. Oikos,94(2): 287–294.
Kerdelhué C, Rasplus JY. 1996a. Non–pollinating Afrotropical fig wasps affect the fig–pollinator mutualism in Ficus within the subgenus Sycomorus. Oikos,75(1): 3–14.
Kerdelhué C, Rasplus JY. 1996b. The evolution of dioecy among Ficus (Moraceae): an alternative hypothesis involving non–pollinating fig wasp pressure on the fig–pollinator mutualism [J]. Oikos,77(1): 163–166.
Kerdelhué C, Rossi JP, Rasplus JY. 2000. Comparative community ecology studies on Old World figs and fig wasps [J]. Ecology,81(10): 2832–2849.
Kjellberg F, Gouyon PH, Ibrahim M, Raymond M, Valdeyron G. 1987. The stability of the symbiosis between dioecious figs and their pollinators: a study of Ficus carica L. and Blastophaga psenes L. [J]. Evolution,41(4): 693–704.
Nefdt RJC, Compton SG. 1996. Regulation of seed and pollinator production in the fig–fig wasp mutualism [J].J Anim Ecol,65(2): 170–182.
Proffit M, Schatz B, Borges RM, Hossaert–Mckey M. 2007. Chemical mediation and niche partitioning in non–pollinating fig–wasp communities. J Anim Ecol,76(2):296–303.
Ramirez BW. 1974. Coevolution of Ficus and Agaonidae[J]. Ann Miss Bot Gard61(3): 770–780.
Sun BF, Wang RW, Hu Z. 2008. Diet segregation of fig wasps and the stability of fig–fig wasp mutualism. Biodivers Sci,16(6): 525–532. [孙宝发,王瑞武,胡忠. 2008.榕小蜂食性分化与榕树–榕小蜂系统稳定性[J].生物多样性,16(6): 525–532.]
West SA, Herre EA. 1994. The ecology of the New World fig–parasitizing wasps Idarnes and implications for the evolution of the fig–pollinator mutualism [J]. Proc R Soc Lond B,258(1351): 67–72.
Wiebes JT. 1979. Co–evolution of figs and their insect pollinators [J]. Annu Rev Ecol Syst,10: 1–12.
Yang DR, Zhao TZ, Wang RW, Zhang GM, Song QS. 2001. Study on pollination ecology of fig wasp (Ceratosolen sp.) in the tropical rainforest of Xishuangbanna, China [J]. ZoolRes,22(2): 125–130. [杨大荣,赵庭周,王瑞武,张光明,宋启示. 2001.西双版纳热带雨林聚果榕小蜂传粉生态学研究[J].动物学研究,22(2): 125–130.]
Zhai SW, Yang DR, Peng YQ. 2008. Distribution Patterns of Galls with Different Fig Wasps in Syconium of Monoecious Ficus racemosa [J]. For Res,21(2): 145–149.[翟树伟,杨大荣,彭艳琼. 2008.聚果榕雄花前期隐头果内小蜂瘿花分布格局的初步研究[J].林业科学研究,21(2): 145–149.]
Spatial distribution of fig wasps in syconia of two monoeciousFicussp.
WANG Zhen-Ji1,2, LI Guo-Chang3, PENG Yan-Qiong1, YANG Da-Rong1,*
(1. XishuangbannaTropical Botanical Garden, Chinese Academy of Science, Kunming 650223, China; 2. Department of Chemistry and Life Science, Chuxiong Normal University, Chuxiong 675000, China; 3. Forestry Bureau of Chuxiong City, Chuxiong 675000, China)
In addition to pollinator fig wasps, there are several non-pollinating fig wasps associated with monoeciousFicussp. In order to understand how pollinator fig wasps and non-pollinating fig wasps are distributed across the same syconium, the spatial distribution of fig wasps associated withFicus altissimaandF. benjaminawere compared using the pedicle lengths of galls containing each species. The results indicate that inFicus altissima, the average pedicel length of galls containingEupristinasp. is longer than that containingE. altissima. Average pedicel length of galls containingSycobiasp.,Micranisa raliangaandSycoscaptersp. two did not show significant difference. The range of pedicel lengths of galls containingSycobiasp.,M. raliangaorSycoscaptersp. two is narrower than that of galls containingE. altissima, indicating these non-pollinating fig wasps and pollinator have partially separated spatial niches. InF. benjamina,E. koningsbergeriwas distributed in galls from the outer layer to inner layer, while mostWalkerellasp. were found in outer layer galls, indicatingE. koningsbergeriandWalkerellasp. have partially separated spatial niches.
Fig wasp; Spatial distribution; Gall; Pedicel
Q969. 54; Q948.122.1
A
0254-5853-(2012)02-0182-05
10.3724/SP.J.1141.2012.02182
2011-05-08;接受日期:2011-12-13
国家自然科学基金(30970403, 30970439);云南省应用基础基金(2011FZ186)
∗通信作者(Corresponding author),E-mail: yangdr@xtbg.ac.cn
王振吉(1983−),男,博士,楚雄师范学院教师,主要从事进化生态学研究

