抵抗素对NAFLD肝纤维化的影响及可能的体内外机制
杨云鹏, 管小琴, 祁明美, 朱良荣
(重庆医科大学 病理教研室, 分子医学与肿瘤研究中心, 重庆 400016)
抵抗素对NAFLD肝纤维化的影响及可能的体内外机制
杨云鹏, 管小琴*, 祁明美, 朱良荣
(重庆医科大学 病理教研室, 分子医学与肿瘤研究中心, 重庆 400016)
应用高脂饮食饲养Wistar大鼠建立非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)肝纤维化体内模型, 选用重组抵抗素作用于肝星状细胞(hepatic stellate cell-t6, HSC-T6)建立体外模型。观察肝组织纤维化的情况;检测体内体外Ⅲ型前胶原(PCⅢ)、透明质酸(HA)、Ⅳ型胶原(CIV)、层黏蛋白(LN)水平;检测肝组织抵抗素mRNA和蛋白的表达水平;检测HSC-T6中转化生长因子β-1(TGF-β1) mRNA及肿瘤坏死因子α(TNF-α)mRNA表达水平。结果显示, 随着高脂喂养时间的延长, 大鼠肝组织抵抗表达逐渐增加且纤维化程度逐渐加重; 随着抵抗素浓度的增加, HSC-T6上清中纤维化指标升高, 细胞中TGF-β1 mRNA及TNF-α mRNA表达增加。与对照组比较, 各指标差异均有显著性(P<0.05或0.01)。上述结果显示抵抗素通过TNF-α、TGF-β1诱导NAFLD肝纤维的发生和发展。
抵抗素; 非酒精性脂肪肝; 纤维化; 肿瘤坏死因子α
2002 年,美国肝脏病学会非酒精性脂肪性肝炎专题研讨会认为NAFLD (non-alcoholic fatty liver disease)是代谢综合征在肝脏的表现 (Neuschwander-Tetri & Caldwell, 2003), 其病理过程包括单纯性脂肪肝、脂肪性肝炎(NASH)和肝硬化, 后期可发展为肝细胞癌和失代偿性肝病(Adams et al, 2005)。以肝纤维化为主要特征的NASH是NAFLD进展的重要中间阶段, 也是隐源性肝硬化的重要病因。在此阶段经积极治疗病情可稳定或在一定程度上好转, 但当继续发展即可导致不可逆转的肝硬化,甚至肝癌(Castera, 2008)。肝纤维化是肝脏对多种病因慢性刺激所致损伤后的修复反应, 其特征是以Ⅰ型胶原为主的细胞外基质(EMC)的过度沉积。HSC(hepatic stellate cell)是产生EMC的主要细胞, HSC的活化是纤维生成的关键。抵抗素为新近发现的细胞因子,有研究认为抵抗素与炎症密切相关(Lee et al,2009)。目前, 抵抗素与NAFLD发生和发展关系尚存在许多争议, 其是否可通过炎症机制参与肝纤维化进展研究甚少。
本实验通过高脂喂养大鼠模拟 NAFLD模型,观察抵抗素与肝纤维化关系,并通过体外细胞实验,应用抵抗素作用于与肝纤维化密切相关的 HSC-T6(hepatic stellate cell-t6), 探讨抵抗素与炎症及肝纤维化的关系及作用机制。
1 材料与方法
1.1 实验动物
清洁级健康雄性 Wistar大鼠 24只, 体重为(200±20)g (由重庆医科大学实验动物中心提供)。实验动物饲养于重庆医科大学实验动物中心。基础饲料适应性饲养1周后,随机分为对照组(9只)和模型组(15只), 分笼饲养。对照组给予基础饲料, 模型组给予改良高脂饲料(Wang & Guan, 2007)。根据预实验观察于 15周出现较理想的纤维化趋势, 本实验分别于15、18、21周末处理对照组(各3只)和模型组(各 5 只)。
1.2 培养细胞
HSC-T6由重庆医科大学附属第二医院消化研究室惠赠。用含10%胎牛血清的RPMI-1640培养基培养 HSC-T6细胞, 细胞长满培养瓶 75%后传代,待贴壁后分4组:A组(1640培养液); B、C和D组分别于 1640培养液中加入不同浓度抵抗素25 µg/ L、50 µg/ L 和 100 µg/ L, 各组细胞分别培养72 h后, 进行各项实验指标的检测。
1.3 主要试剂
PRMI-1640、胰酶购自中国重庆百杰生物有限公司; 胎牛血清购自中国杭州四季青生物公司; 重组抵抗素购自中国重庆博培生物技术有限公司; 总RNA提取试剂BioZol购自中国重庆升博科技有限公司; reverse transcription-PCR (RT-PCR)试剂盒购自中国成都天泰生物技术有限公司; 蛋白提取试剂盒购自中国江苏碧云天生物技术研究所; 抵抗素抗体购自中国重庆百杰生物有限公司代理; β-actin、辣根过氧化物酶标记的IgG购自中国北京博奥森生物技术有限公司。
1.4 标本采集
处理前大鼠禁食12 h, 用3.5%的水合氯醛腹腔麻醉(1 mL/100 g体重), 眼球取血并分离血清,-80 ℃冰箱保存。剖腹取肝脏组织, 取相同部位肝组织(1 cm×1 cm×0.3 cm)浸泡入10%中性甲醛溶液固定, 备常规石蜡包埋切片VG染色作光镜标本; 另取相同部位肝组织(~0.3 cm×0.3 cm×0.3 cm, 数枚)。戊二醛固定制备电镜标本。其他操作由重庆医科大学电镜室完成。其余的肝组织置于液氮罐中冻存。
1.5 动物血清、体外细胞上清纤维化指标检测
酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)试剂盒检测各实验组血清、体外细胞上清中Ⅲ型前胶原(PCⅢ)、透明质酸(HA)、Ⅳ型胶原(CⅣ)、层黏蛋白(LN)水平, 按照试剂盒说明书操作。
1.6 RT-PCR法检测大鼠肝组织中抵抗素、HSC-T6的TGFβ-1 mRNA及TNF-a mRNA表达水平
按 TRIzol试剂说明书提取肝组织和细胞总RNA。分光光度计于260 nm波长测RNA含量。取2 g总RNA为模板, 按照RT-PCR试剂盒说明进行逆转录合成cDNA。各引物序列见表1。
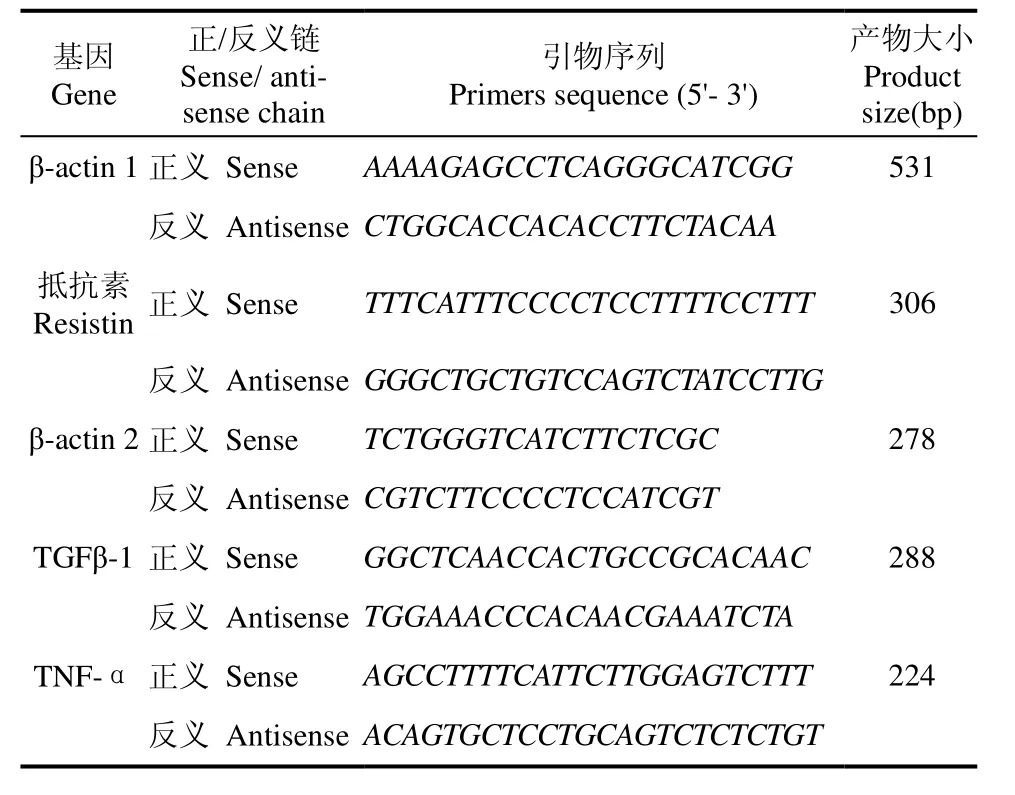
表1 本研究中的RT-PCR引物序列Tab. 1 RT-PCR primers sequence in the study
内参β-actin 1基因扩增条件为:94 ℃ , 3 min;94 ℃ , 30 s, 56 ℃ , 30 s, 72 ℃ , 1 min,共30个循环;72 ℃, 5 min。抵抗素基因扩增条件为:94 ℃, 3 min;94 ℃ , 30 s, 54 ℃ , 30 s, 72 ℃ , 1 min,共30个循环;72 ℃ , 5 min。β-actin 2 基因和TGFβ-1基因扩增条件为:94 ℃ , 3 min; 94℃ , 30 s, 58 ℃ , 30 s, 72 ℃, 1 min, 共30个循环; 72 ℃ , 5 min。TNF-α基因扩增条件为:94 ℃, 3 min; 94℃ , 30 s, 55 ℃ , 30 s, 72 ℃,1 min, 共 30个循环; 72 ℃ , 5 min。扩增产物经1.5%琼脂糖凝胶电泳(电压 100 V, 20 min), 用Quantity One软件成像及定量分析, 以各目的基因与内参基因光密度的比值示其相对含量。
1.7 Western blotting法检测大鼠肝组织中抵抗素
蛋白水平的表达
提取肝组织蛋白, 并采用Bradford法进行蛋白定量。取50 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis SDS-PAGE)电泳, 转膜, 用脱脂奶粉稀释抵抗素一抗, 4 ℃孵育过夜, 室温下孵育相应二抗60 min, 发光, 应用Quantity One软件成像及定量分析, 以各目的基因与内参基因光密度的比值示其相对含量。
1.8 统计学分析
计量资料采用均数±标准差(mean±SD)表示, 采用SPSS11.5统计软件进行单因素方差分析, 组间比较用t-检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 肝组织病理学改变
较正常对照组, 15~18周NAFLD模型组大鼠可见肝组织纤维组织增生, 21周NAFLD模型组大鼠肝组织纤维明显增生致汇管区扩大并局部形成纤维条索 (图 1A)。电镜观察见肝细胞胞浆中见较多脂质空泡。狄氏间隙内胶原原纤维增生, HSC(hepatic stellate cell)胞浆内脂质空泡明显减少,甚至消失(图 1B)。
2.2 血清纤维化指标检测结果
与对照组比较, PCⅢ、HA、CIV、LN均随着高脂喂养大鼠时间的延长而逐步升高, 并且在 21

图1 21周模型组肝组织纤维化VG染色(×400)(A)和肝星状细胞电镜(×8 000)(B)Fig. 1 VG staining of liver fibrosis (×400)(A) and electron microscopy of hepatic stellate cells (×8 000)(B)for the 21 weeks model group
周时各指标升高最为显著。各时相模型组与对应对照组比较差异有统计学意义(P<0.05或P<0.01)(表 2)。

表2 大鼠血清纤维化谱的变化和肝组织抵抗素基因和蛋白表达Tab. 2 Spectrum of changes in serum fibrosis and liver tissue resistin gene and protein expression
2.3 大鼠肝组织中抵抗素基因和蛋白的表达
与对照组比较, 各时相模型组大鼠肝组织中抵抗素基因转录水平逐渐升高, 且以 21周升高最为明显, 差异具有统计学意义(P<0.05)。(图 2A 和表2)大鼠肝组织中抵抗素蛋白表达趋势与抵抗素基因转录水平趋势相一致(图2B和表2)
2.4 体外细胞上清纤维化指标检测
随着重组抵抗素浓度的增加, 纤维化谱各指标逐渐增加。与对照组比较, 差异具有统计学意义(P<0.05) (表 3)。
2.5 细胞 TGFβ-1 mRNA 及 TNF-α mRNA 转录水平
RT-PCR扩增产物电泳结果显示:与A组比较,随着加入抵抗素浓度的增加, TGFβ-1及 TNF-α mRNA表达水平升高, 且以D组表达水平最高, 差异具有显著性(P<0.05)(图3和表3)。

图2 各组抵抗素的mRNA表达的RT-PCR(A)和蛋白表达(B)的检测结果Fig. 2 Results of mRNA expression by RT-PCR (A) and protein expression (B) for each group of resistin

表3 细胞上清纤维化指标变化及细胞TGFβ-1mRNA、TNF-α mRNA基因转录水平Tab. 3 Cell supernatant fibrosis indexes and gene transcription level of TGFβ-1 mRNA, TNF-α mRNA

图3 TGFβ-1(A)和 TNF-α(B)各组 mRNA 表达的RT-PCR检测结果Fig. 3 mRNA expression by RT-PCR for each group of TGFβ-1(A) and TNF-α(B)
3 讨 论
HSC又称Ito细胞、维生素A储存细胞、窦周细胞等, 在生理状态下 HSC位于肝索与肝窦壁之间的狄氏间隙内。HSC分布广泛, 形态不规则, 常伸出树状突起, 包绕5~6个肝细胞, 因此得名为肝星状细胞。在肝纤维化形成初期, HSC即被激活转化为myofibroblast, 产生多种ECM组分, 是形成肝纤维化主要的细胞(Wells, 2008)。
抵抗素是新近发现的脂肪因子, Szalowska et al(2009)发现抵抗素不仅表达于脂肪组织, 在肝脏中也表达, 且表达量高于脂肪组织。其与 NAFLD纤维化的关系尚存在争议, 其作用机制研究甚少。
本课题通过高脂饮食喂养大鼠建立NAFLD模型, 实验结果显示, 从血清学上分析:与对照组比较, PCⅢ、HA、CIV、LN均随着高脂喂养大鼠时间的延长而逐步升高, 并且在 21周时各指标升高最为显著。各时相模型组与对应对照组比较差异有统计学意义(P<0.05或P<0.01, 表 2)。从组织学上观察:较正常对照组, 15~18周NAFLD模型组大鼠可见肝组织纤维组织增生, 21周NAFLD模型组大鼠肝组织纤维明显增生致汇管区扩大并局部形成纤维条索(图1A)。电镜观察见肝细胞狄氏间隙内有大量胶原原纤维形成,还可见 HSC(图 1B)。HSC又是形成肝纤维化的主要细胞。这表明, 随着高脂喂养时间的延长, 血清学及组织学均显示纤维化程度逐渐加重。同时, 本实验对抵抗素的研究结果显示:与对照组比较, 各时相模型组大鼠肝组织中抵抗素基因转录水平逐渐升高, 且以 21周升高最为明显, 差异具有统计学意义(P<0.05)(图2A和表2)。大鼠肝组织中抵抗素蛋白表达趋势与抵抗素基因转录水平趋势相一致(图2B和表2)。
这表明, 随着高脂喂养时间的延长, 大鼠肝脏内的抵抗素浓度越来越高。提示抵抗素与肝纤维化密切相关。
抵抗素与肝纤维化之间的关系是怎样的;是通过什么机制来诱导肝纤维化的呢,为此,我们做了体外实验予以研究。
我们选用不同浓度重组抵抗素直接作用于HSC-T6 ,能够排除其他因素对机体影响, 使抵抗素作为独立因素作用于 HSC-T6, 探讨抵抗素对肝纤维化的可能作用机制。实验结果显示, 随着重组抵抗素浓度的增加, 纤维化谱 PCⅢ、HA、CIV、LN逐渐增加。与对照组比较, 差异具有统计学意义(P<0.05) (表3)。这表明随着重组抵抗素浓度的增加,肝纤维化程度加重。RT-PCR扩增产物电泳结果显示:与 A组比较, 随着加入抵抗素浓度的增加,TGFβ-1 mRNA及TNF-α mRNA表达水平升高, 且以 D组表达水平最高, 差异具有显著性(图 3和表3)。由此推测抵抗素可能通过TGFβ-1和TNF-α 诱导NAFLD肝纤维化发生发展。
有研究发现肝硬化者的血清抵抗素水平较健康者明显升高,且与肝脏炎症和纤维化程度呈正相关(Kakizaki et al, 2008; Pagano et al, 2006)。 Fu et al(2006)将重组人抵抗素加入到人和鼠的巨噬细胞,导致促炎因子TNF-α的分泌升高, 提示抵抗素具有促炎作用。TNF-α等炎症细胞因子通过正反馈调节激发抵抗素的生成, 即抵抗素与 TNF-α相互协同,促发炎症瀑布反应。TNF-α是最早发现的介导肝细胞损伤的脂肪因子, 在局部脂肪组织中的表达与肥胖程度成正相关(Fantuzzi, 2005)。肝脏是TNF-α重要的靶器官。Kitamura et al (2002)证实TNF-α是通过与受体的结合发挥生物学作用。已知TNF-α的受体是由不同基因编码的相对分子量为 5.5×104的TNF受体(TNF-Rp55)和相对分子质量为7.5×104的TNF受体(TNF-Rp75)。TNF-Rp55表达于近乎所有的体细胞中, 但 TNF-Rp75则主要表达于粒细胞和上皮细胞。Tomita et al (2006)研究发现, 在 MCD(methionine and choline deficient)喂养鼠中, Kuppfer细胞和内皮细胞中血管细胞黏附分子——1(VCAM-1)和VCAM -2的表达上调可导致TNF-α从kuppfer细胞释放增加, 表明TNF-Rp55是TNF-α在多种类型细胞中的主要信号受体。通过研究TNF-α/TNF-Rp55信号在肝纤维化过程中的病理生理作用, 认为TNF- Rp55介导的信号转导途径可调节 kuppfer细胞的活化, 并最终促进肝纤维化的进展, 而对TNF- Rp55受体的封闭作用可改善肝纤维化。TNF-α参与肝纤维化的可能机制有:1) 增加肝脏内的脂质合成; 2) 增加激素敏感性脂肪酶活性来促进脂肪动员, γ抑制脂蛋白脂肪酶的活性使脂肪组织贮存脂肪酸减少; 3) 血浆中的游离脂肪酸升高,而FFA的升高又可以通过溶酶体途径使TNF-α的表达增加, 形成恶性循环, 从而引起线粒体结构和功能异常、氧化应激、脂肪酸β氧化超载, 最终导致脂肪在肝脏中沉积; 4) 活化细胞外信号调节激酶ERK和JNK通路, 促进HSC产生ECM; 5) 可刺激HSC表达基质金属蛋白酶抑制剂 (TIMP -1), 减少ECM的降解。
Tian et al (2003)研究还发现, TNF-α还能间接诱导其他促纤维化因子的作用, 如IL-1和IL-6等。这些因子, 一方面促进局部炎症反应, 使肝组织不断受损;另一方面促进成纤维细胞和间质细胞的增殖和分化, 维持肝组织损伤与修复循环, 结果使更多的间质细胞参与并产生大量 ECM, 从而导致肝纤维化的发生和发展。
TGFβ-1是肝纤维化形成过程中的重要始动因子, 是目前已知最强的促肝纤维化细胞因子,TGFβ-1对HSC的活化是肝纤维化发病机制的中心环节(Gressner & Weiskirechen, 2006)。TGFβ-1 通过TGFβ/Smad信号传导通路促进 HSC激活, 转化为myofibroblast, 诱导活化的HSC收缩, 在HSC活化早期刺激ECM的合成与沉积, 造成恶性循环, 促使肝纤维化发生发展(Thenappan et al, 2010)。
综上所述, 抵抗素通过TNF-α参与的炎症机制以及 TGFβ-1对肝纤维化的作用诱导NAFLD纤维化的发生与发展。抑制肝脏慢性炎症或者阻止抵抗素促炎机制, 有可能成为抑制 NAFLD肝纤维化发生发展的治疗新思路。
Adams LA, Sanderson S, Lindor KD, Angulo P. 2005. The histological course of nonalcoholic fatty liver disease: a longitudinal study of 103 patients with sequential liver biopsies [J].J Hepatol,42(1): 132-138.
Castera L. 2008. Non-invasive diagnosis of steatosis and fibrosis [J].Diabetes Metab,36(6 pt 2): 674-679.
Fantuzzi G. 2005. Adipose tissue, adipokines, and inflammation [J].J Allergy Clin Immunol,115(5): 911-919.
Fu YC, Luo LH, Luo NL, Garvey WT. 2006. Proinflammatory cytokine production and insulin sensitivity regulated by overexpression of resistin in 3T3- L1 adipocytes [J].Nutr Metab,3: 28.
Gressner AM, Weiskirchen R. 2006. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-β as major players and therapeutic targets [J].J Cell Mol Med,10(1): 76-99.
Kakizaki S, Sohara N, Yamazaki Y, Horiguchi N, Kanda D, Kabeya K,Katakai K, Sato K, Takagi H, Mori M. 2008. Elevated plasma resistin concentrations in patients with liver cirrhosis [J].J Gastroenterol Hepatol,23(1): 73-77.
Kitamura K, Nakamoto Y, Akiyama M, Fujii C, Kondo T, Kobayashi K,Kaneko S, Mukaida N. 2002. Pathogenic roles of tumor Necrosis factor receptor p55-mediated signals in dimethylnitrosamine-induced murine liver fibrosis [J].Lab Invest,82(5): 571-583.
Lee SH, Ha JW, Kin JS, Choi EY, Park S, Kang SM, Choi D, Jang Y, Chung N. 2009. Plasma adiponectin and resistin levels as predictors of mortality in patients with acute myocardial infarction: data from infarction prognosis study registry [J].Coron Artery Dis,20(1): 33-39.
Neuschwander-Tetri BA, Caldwell SH. 2003. Nonalcoholic steatohepatitis:summary of an AASLD Single Topic Conference [J].Hepatology,37(5): 1202-1219.
Pagano C, Soardo G, Pilon C, Milocco C, Basan L, Milan G, Donnini D,FaggianD, Mussap M, Plebani M, Avellini C, Federspil G, Sechi LA,Vettor R. 2006. Increased serum resistin in nonalcoholic fatty liver disease is related to liver disease severity and not to insulin resistance[J].J Clin Endocrinol Metab,91(3): 1081-1086.
Szalowska E, Elferink MGL, Hoek A, Groothuis GMM, Vonk RJ. 2009.Resistin is more abundant in liver than adipose tissue and is not up-regulated by lipopolysaccharide [J].J Clin Endocrinol Metab,94(8):3051-3057.
Thenappan A, Li Y, Kitisin K, Rashid A, Shetty K, Johnson L, Mishra L.2010. Role of transforming growth factor β signaling and expansion of progenitor cells in regenerating liver [J].Hepatology,51(4):1373-1382.
Tian L, Huang YX, Tian M, Gao W, Chang Q. 2003. Downregulation of electroacupuncture at ST36 on TNF-α in rats with ulcerative colitis[J].World J Gastroenterol,9(5): 1028-1033.
Tomita K, Tamiya G, Ando S, Ohsumi K, Chiyo T, Mizutani A, Kitamura N,Toda K, Kaneko T, Horie Y, Han JY, Kato S, Shimoda M, Oike Y,Tomizawa M, Makino S, Ohkura T, Saito H, Kumagai N, Nagata H,Ishii H, Hibi T. 2006. Tumour necrosis factor α signalling through activation of Kupffer cells plays an essential role in liver fibrosis of non-alcoholic steatohepatitis in mice [J].Gut,55(3): 415-424.
Wang Q, Guan XQ. 2007. Improvement of induction method of non-alcoholic fatty liver model in rats [J].World Chn J Digestol,15(11):1219-1224. [王倩, 管小琴. 2007. 大鼠非酒精性脂肪肝造模方法的改进[J]. 世界华人消化杂志, 15(11): 1219-1224.]
Wells RG. 2008. Cellular sources of extracellular matrix in hepatic fibrosis[J].Clin Liver Dis,l2(4): 759-768.
Effects of resistin on hepatic fibrosis: Possible mechanisms in non-alcoholic fatty liver disease inin vitroandin vivo
YANG Yun-Peng, GUAN Xiao-Qin*, QI Ming-Mei, ZHU Liang-Rong
(Department of Pathology,Chongqing Medical University,Molecular Medicine and Cancer Research Center of Chongqing Medical University,Chongqing400016,China)
To investigate the effects and possible mechanisms of resistin on hepatic fibrosis in non-alcoholic fatty liver disease, this review used anin vivomodel utilizing Wistar rats with a high fat diet. Recombinant resistin was selected to play role in hepatic stellate cells in the HSC-T6 cell line. We observed the degrees of hepatic fi brosis,measured the levels of Liver fibrosis spectrum and detected expression levels of resistin mRNA and protein in liver tissue as well as the expression levels of TGFβ-1 and TNF-α mRNA in HSC-T6. The results showed that expression of resistin in rat liver tissue and the degree of hepatic fibrosis increased over time with a high fat diet. Along with the increased concentration of resistin and levels of fibrosis index, TGFβ-1and TNF-α also increased in HSC-T6 cells. Compared with the control group, significant differences were found between each group, suggesting resistin by proinflammatory cytokine TNF-α and TGF-β1 induced the occurrence and development of NAFLD in hepatic fibrosis.
Resistin; NAFLD; Hepatic fibrosis; TNF-α
R589.2;R575.5
A
0254-5853-(2012)04-0367-06
10.3724/SP.J.1141.2012.04367
2012-03-05;接受日期:2012-06-05
重庆市教委科学技术研究资助项目(KJ090327)
∗通信作者(Corresponding author),E-mail: guanxiaoqin2003@yahoo.com.cn
男, 硕士研究生。主要研究方向为肝脏病理。Email:929494606@qq.com

