尼氟灭酸对低氧性肺动脉高压大鼠肺动脉平滑肌细胞mCLCA mRNA 及MAPK 表达的影响
盛文超, 刘 建, 余维巍, 马海丽
1山东省潍坊市诸城市人民医院,诸城 262200
2华中科技大学同济医学院附属同济医院综合科,武汉 430030
低氧性肺动脉高压是肺心病发病机制的中心环节,以肺血管平滑肌细胞的增殖、肺血管的重构为主要病理特征。肺血管的重构主要包括远端肺动脉的肌化,血管内膜增生,肺小动脉丛状病变[1-2]。氯离子是体内最为丰富的阴离子,研究证实肺动脉平滑肌细胞(PASMCs)上存在钙激活性氯通道及容量激活性氯通道[3]。低氧可以激活钙激活性氯通道,氯离子外流致细胞膜去极化,使肺动脉平滑肌收缩[4-5];容量激活性氯通道持续不断地调节细胞的容量,推测该通道与细胞增殖有关[6]。肺动脉平滑肌的收缩及平滑肌细胞的增殖最终导致肺动脉高压的形成。
丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)属于丝氨酸/苏氨酸磷酸化激酶[7],MAPK 通路与细胞增殖、凋亡密切相关。研究表明,MAPK 通路可被低氧这一因素激活,在COPD 的发病过程中起重要的作用[8]。
尼氟灭酸(niflumic acid,NFA)是一种非甾体类消炎药物,为钙激活氯通道阻滞剂,近年常被用于研究氯离子通道,本实验用其研究选择性阻断氯离子通道对平滑肌细胞中钙激活氯离子通道蛋白(chloride channel calcium activated protein,mouse;mCLCA)mRNA 及MAPK 蛋白表达的影响。从而推测NFA 对低氧性肺动脉高压的形成是否存在一定的抑制作用。
1 材料与方法
1.1 实验材料
健康雄性SD 大鼠24只(购于华中科技大学同济医学院实验动物学部),体重160~300g。高糖DMEM 培养液(Gibco),胎牛血清(Gibco),NFA(Sigma),Trizol 试剂(Invitrogen),兔抗大鼠MAPK 单克隆抗体(武汉博士德公司),TransScript First-Strand cDNA Synthesis SuperMix(TransGen Biotech)。CO2培养箱(NUAIRE),超净工作台(CX-102型,安徽蚌埠净化设备厂),倒置相差显微镜,PCR 仪(PTC-200)。
1.2 溶液配制
NFA 溶液的配制:称取NFA 30mg溶解于50 μL DMSO 溶液中,配制含0.4 mol/L NaHCO3的5% 葡萄糖溶液,然后将NFA 溶液稀释于葡萄糖溶液中,使NFA 终浓度为3 mg/mL,且DMSO 终浓度<1%。
对照剂的配制:用含0.4 mol/L NaHCO3的5%葡萄糖溶液稀释DMSO,使DMSO 终浓度<1%。
1.3 低氧性肺动脉高压模型的建立
24只健康雄性SD 大鼠,随机分为对照组、低氧组、低氧+用药组,每组8只。参照文献[9]建立常压低氧肺动脉高压模型。对照组大鼠饲养于正常环境下,低氧组及低氧+用药组大鼠置于低氧箱中,调节氮气流量使氧气浓度保持在10%左右,每天缺氧8h,连续21d。低氧+用药组大鼠于缺氧前3d开始每天腹腔内注射配置好的NFA 溶液,剂量为3 mg/kg体重,低氧组每天腹腔内注射相同剂量的对照剂。实验过程中低氧组及低氧+用药组各有1只大鼠死亡。
1.4 右室肥厚指数的测量
缺氧培养21d后,将大鼠用10%的水合氯醛按0.5mL/100g体重腹腔注射麻醉。仰卧位固定,消毒皮肤,打开腹腔,腹主动脉放血法处死动物。迅速打开胸腔取出心脏,冲净血液,滤纸吸干表面水分,去掉左、右心房,游离右心室,然后用电子天平分别称右心室(RV)和左心室(LV)+室间隔(S)重量,计算右室肥厚指数(RVHI),RVHI=RV/(LV+S)。
1.5 肺小动脉结构的观察
右肺中叶用10%多聚甲醛固定48h,常规石蜡包埋切片,行苏木精-伊红染色,观察肺小动脉结构。
1.6 肺动脉平滑肌细胞的原代培养及鉴定
迅速将剩余肺组织取出,放入装有PBS的小烧杯中,用铝箔纸盖好,置于超净工作台。体视显微镜下无菌分离肺动脉及其分支,剥离外膜,将肺动脉干剪开,用弯镊的头部轻轻刮内膜,以除去内皮细胞,用含双抗的PBS(双抗∶PBS=1∶100)冲洗3、4次,用虹膜剪将组织剪成1mm×1 mm×1 mm 大小的组织块,用镊子夹入25 mL 的培养瓶中,并使其在瓶底均匀分布,组织块间距不大于0.5cm。加入含20%FBS的高糖DMEM 培养液2mL,翻转培养瓶,放入37℃,5%CO2培养箱中,瓶底向上。4~6 h后等组织块表面干涸并且贴附在瓶底后将培养瓶慢慢翻转,使培养液没过组织块,放入培养箱中继续培养,待细胞爬出后换液。原代细胞长满培养瓶后,用0.25%的胰酶消化,传代,取第3~10 代细胞用于实验[9]。
倒置相差显微镜下观察肺动脉平滑肌细胞形态。以荧光免疫组化抗α-SAM 方法鉴定细胞。
1.7 免疫细胞化学方法检测MAPK 蛋白的表达
将细胞爬片进行高温消毒处理,标记好正反面,放入24孔板中。各组取密度合适的肺动脉平滑肌细胞接种于爬片上,采用免疫细胞化学方法检测MAPK 的表达。即用预冷的95% 乙醇固定15 min,PBS漂洗。加入3%H2O2室温下5~10 min灭活内源性酶,PBS洗3次。滴加5%BSA 封闭液,室温下放置20 min,甩去多余液体,不洗。滴加兔抗大鼠MAPK 抗体(1∶100),4℃过夜,PBS漂洗。滴加生物素化羊抗兔IgG,37℃30min,PBS冲洗。滴加SABC,室温下20min,PBS冲洗。DAB显色,苏木精复染。脱水,透明,封片,显微镜下观察。每例标本在400倍显微镜下随机选定10个视野,每个视野通过彩色CCD 摄像机将图像输入计算机病理图像分析系统(MPIAS-2000),转化为10张数字图像。测量每张图片中阳性细胞的平均吸光度(A)值。取10张图像测量结果的平均值,对该例标本的蛋白表达进行定量[9]。
1.8 RT-PCR法检测mCLCA mRNA水平
各组细胞用Trizol一步法抽提总RNA,按照逆转录试剂盒说明书步骤,合成cDNA,测A260值。用PCR 扩增目的片段。PCR 的反应条件:mCLCA mRNA 引物(AF077303),上游引物为5′-ACTTCCGGTCTGATACCTAA-3′;下游引物为5′-TTGGCCAGAATTGCAATGTA-3′,产物长度为110 bp;β-actin为内参,上游引物为5′-GTCACCAACTGGGACGATA-3′,下游引物为5′-AGGTCTTTACGGATGTCAACG-3′,产物长度为654bp。循环参数:94℃变性30s,55℃退火30s,72℃延伸50s,循环35次。PCR 产物用2%琼脂糖凝胶电泳鉴定,用Image Tool3.0图像分析软件进行分析,测量各组mCLCA mRNA 与相应β-actin条带的吸光度值比。
1.9 统计学处理
2 结果
2.1 肺动脉平滑肌细胞的鉴定
肺动脉平滑肌细胞在倒置相差显微镜下,呈长梭形,胞核呈圆形,细胞出现典型的“峰-谷”形态,抗α-SMA 细胞免疫荧光染色,胞质呈绿色荧光,胞核不染色,证明为血管平滑肌细胞,见图1。
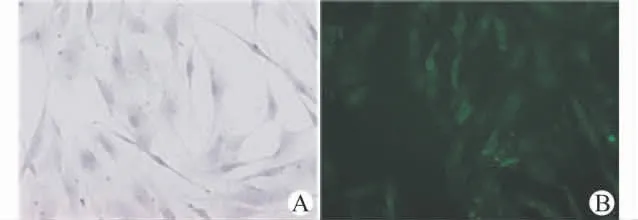
图1 肺动脉平滑肌细胞的鉴定(×200)Fig.1 Identification of pulmonary artery smooth muscle cells(×200)
2.2 肺小动脉结构的改变
各组肺组织苏木精-伊红染色后,镜下可见,与对照组相比低氧组肺小动脉管壁增厚,管腔狭窄,平滑肌细胞肥大、增生;低氧+用药组变化较低氧组为轻。见图2。
2.3 右室肥厚指数(RVHI)的比较
如表1所示,低氧+用药组RVHI较低氧组明显降低(P<0.05),且与对照组相比差异无统计学意义。
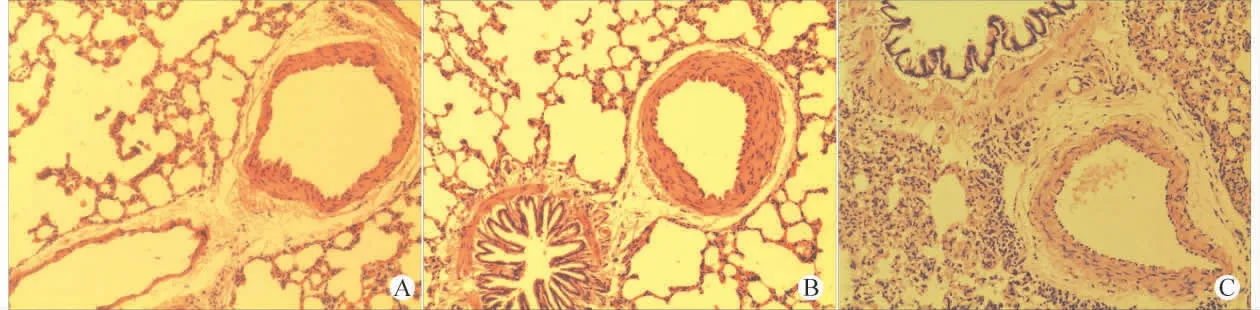
图2 各组肺动脉结构(苏木精-伊红染色,×200)Fig.2 Structures of the pulmonary artery in different groups(HE stainning,×200)
2.4 肺动脉平滑肌细胞MAPK 的表达
表1 各组右室肥厚指数的比较(±s)Table 1 Comparision of RVHI in different groups(±s)
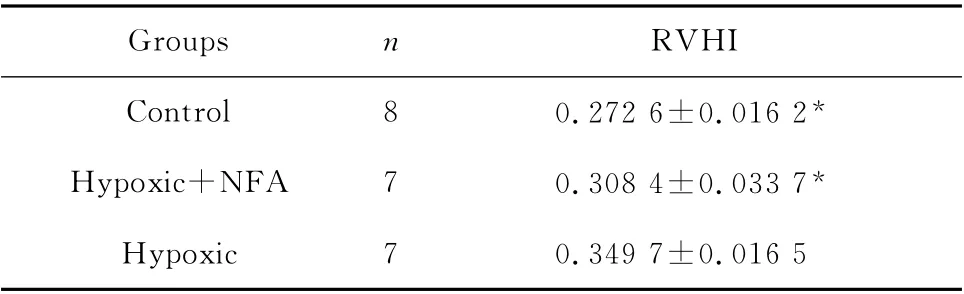
表1 各组右室肥厚指数的比较(±s)Table 1 Comparision of RVHI in different groups(±s)
*P<0.05 vs.hypoxic group
Groups n RVHI Control 8 0.272 6±0.016 2*Hypoxic+NFA 7 0.308 4±0.033 7*Hyp oxic 7 0.349 7±0.016 5
低氧+用药组MAPK 表达较低氧组明显降低(P<0.05),且与对照组相比差异无统计学意义,见图3、表2。
2.5 各组mCLCA mRNA的表达
低氧+用药组mCLCA mRNA 表达较低氧组明显降低(P<0.05),且与对照组相比差异无统计学意义,见图4、表2。

图3 各组PASMCs中MAPK 的表达(SABC显色,×200)Fig.3 The expression of MAPK in the PASMCs of different groups(SABC,×200)
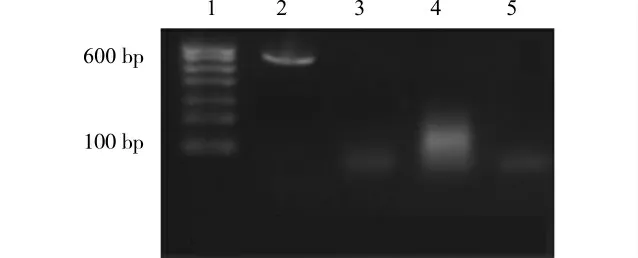
图4 RT-PCR检测各组mCLCA mRNA 的表达Fig.4 The expression of mCLCA mRNA in different groups tested by RT-PCR
表2 各组mCLCA mRNA 和MAPK 蛋白的表达(A 值,±s)Table 2 The expression of mCLCA mRNA and MAPK protein in different groups(Avalues,±s)

表2 各组mCLCA mRNA 和MAPK 蛋白的表达(A 值,±s)Table 2 The expression of mCLCA mRNA and MAPK protein in different groups(Avalues,±s)
*P<0.05 vs.hypoxic group
Groups n mCLCA mRNA MAPK p rotein Control 8 0.390 5±0.051 6*0.21±0.04*Hypoxic+NFA 7 0.753 9±0.026 9*0.44±0.02*Hyp oxic 7 0.502 1±0.100 4 0.30±0.06
3 讨论
低氧性肺动脉高压的形成是一个复杂的过程,低氧是发病的重要环节,肺动脉平滑肌细胞的收缩与增殖起着重要的作用[10]。研究表明,肺动脉平滑肌细胞上存在钙激活性氯通道和容量激活性氯通道。激活的钙激活性氯通道有较强的去极化作用,在调控血管张力和收缩性方面起重要作用。低氧可使肺动脉平滑肌细胞膜上钙通道开放,钙离子内流,胞内钙离子浓度升高,进一步激活细胞膜上钙激活性氯通道,氯离子外流,胞膜去极化,细胞收缩。低氧可以激活平滑肌细胞膜上的容量激活性氯通道[11],该通道的激活涉及MAPKs通路,与细胞增殖密切相关。
MAPKs存在于大多数细胞内,能将胞外的增殖信号传导至胞内或胞核内。MAPK 通路与细胞增殖、凋亡密切相关,其高表达可以作为细胞增殖的重要表现。低氧条件下,细胞内钙浓度升高,可引起MAPK 通路的激活,引起细胞增殖。
本研究发现,作为钙激活氯通道阻滞剂的NFA能够在低氧条件下使得右室肥厚指数较单纯低氧组显著降低,氯离子通道mCLCA mRNA 表达显著降低,标志增殖的通路MAPK 蛋白表达降低,但与正常对照组相比差异均无统计学意义。推测NFA 可能通过阻断氯通道,降低mCLCA mRNA 的表达,抑制肺动脉平滑肌细胞的收缩。同时负反馈调节钙浓度,从而阻断MAPK 通路的激活,抑制平滑肌细胞增殖,阻断肺动脉高压血管重构,进而阻止肺动脉高压的形成。由此我们推测,NFA 对低氧性肺动脉高压可能有一定治疗作用,为临床寻找治疗肺动脉高压药物提供了思路。
[1] Jeffery T K,Wanstall J C.Pulmonary vascular remodeling:a target for therapeutic intervention in pulmonary hypertension[J].Pharmacol Ther,2001,92(1):1-20.
[2] Stenmark R,Fagan K,Frid M G.Hypoxia-induced pulmonary vascular remodeling:cellular and molecular mechanisms[J].Circ Res,2006,99(7):675-691.
[3] Chen T Y.Structure and function of clc channels[J].Annu Rev Physiol,2005,67:809-839.
[4] Yuan X J.Role of calcium-activated chloride current in regulating pulmonary vasomotor tone[J].Am J Physiol,1997,272(5Pt 1)::L959-968.
[5] Haddad J J.N-methyl-D-aspartate(NMDA)and the regulation of mitogen-activated protein kinase(MAPK)signaling pathways:A revolving neurochemical axis for therapeutic intervention[J].Prog Neurobiol,2005,77(4):252-282.
[6] Jentsch T J,Stein V,Weinreich F,et a1.Molecular structure and physiological function of chloride channels[J].Physiol Rev,2002,82(2):503-568.
[7] 黄春香.MAPK 信号通路与乳腺癌的研究进展[J].中医学报,2010,1(1):36-39.
[8] Hopfer U.The novel WD-repeat protein Morg l acts as a molecule scaffold for hypoxia-inducible factor pmlyl-hydroxylase 3(PHD3)[J].J Biol Chem,2006,281(13):8645-8655.
[9] 薛全福,谢剑鸣,胡长贵,等.常压缺氧性大鼠肺动脉高压模型的建立[J].中华结核和呼吸杂志,1989,12(6):92-94.
[10] 周思静,金嫦娥,刘建,等.缺氧诱导因子-1 在肺癌组织中的表达及其与肺癌淋巴道转移关系的研究[J].华中科技大学学报:医学版,2010,39(3);331-335.
[11] 王健,冉丕鑫.肺动脉高压血管收缩与重塑的研究[J].中华结核和呼吸杂志,2007,30(9):645-648.

