不同时期血吸虫肝损伤模型小鼠肝脏组织病理学及肝功能的动态观察*
刘 萍, 王 密, 陆小丹, 唐望先
华中科技大学同济医学院附属同济医院肝病研究所,武汉 430030
血吸虫是我国主要的寄生虫疾病之一,主要通过寄生在钉螺中的尾蚴接触皮肤而感染,尾蚴在宿主体内发育为成虫,并持续排出大量的虫卵沉积在门脉系统,造成肝窦前阻塞,进而形成肉芽肿和胶原纤维的沉积。本研究观察血吸虫肝损伤模型小鼠不同时期肝脏组织病理学和肝功能的变化,以期为血吸虫肝损伤的研究提供理论依据。
1 材料与方法
1.1 实验动物与试剂
Balb/c小鼠,清洁级,6~8周龄,雄性,体重(22±2)g,由湖北省血吸虫防治所提供,在同济医院动物中心无菌房常规饲养。Masson染色试剂盒、伊红和苏木精染液购自武汉谷歌生物技术有限公司。无水乙醇、二甲苯和盐酸购自天津市广成化学试剂有限公司。中性树胶购自北京鼎国昌盛生物技术有限责任公司。谷丙转氨酶(alanine transaminase,ALT)和谷草转氨酶(aspartate transaminase,AST)试剂盒购自中生北控生物科技有限公司。肝纤维化指标透明质酸(hyaluronic acid,HA)、层粘连蛋白(laminin,LN)、Ⅲ型前胶原(precollagen Ⅲ,PCⅢ)、Ⅳ型胶原(collagen Ⅳ,Ⅳ-C)试剂盒购于上海海军医学研究所生物技术中心。
1.2 实验方法
1.2.1 模型制备 参考文献[1-2]制备血吸虫肝损伤模型,具体如下:暴露Balb/c小鼠腹部皮肤,将敷有(20±2)条尾蚴的盖玻片倒扣在小鼠的腹部皮肤,停留15min左右,去掉盖玻片,放至笼中常规饲养,分别在感染后的第1、3、6、9周各处死10只模型鼠,11周处死6 只。另随机选取6 只未感染的正常Balb/c小鼠作为正常组。取完整的肝脏、脾脏和两侧肾脏并称湿重,分别计算肝脏指数(肝脏湿重/体重)、脾脏指数(脾脏湿重/体重)和肾脏指数(双肾湿重/体重)。取同一部位的肝脏组织,以4%的多聚甲醛室温固定48h,制备病理学切片。
1.2.2 苏木精-伊红(HE)染色 组织切片于65℃烤箱放置1h 后,加入二甲苯脱蜡30 min,无水至70%的梯度乙醇脱水各5 min,自来水缓慢冲洗后伊红和苏木精分别染色10min和5min,1%盐酸乙醇分化,自来水缓慢冲洗,70%至无水的梯度乙醇各1min,二甲苯处理2次各10min,中性树胶封片,在OLYMPUS 显微镜下拍照。
1.2.3 Masson染色 组织切片脱蜡和脱水操作同HE染色。伊红染色15min,1%醋酸缓慢冲洗后苏木精染色10 min,1%醋酸缓慢冲洗后依次加入磷钼酸和苯胺蓝各作用10min,1%醋酸缓慢冲洗,自来水缓慢冲洗后以下操作同HE染色。
1.2.4 肝损伤及肝纤维化指标的检测 采用摘除眼球的方法收集小鼠全血,室温静置后,3 000r/min离心,15 min,取上层血清,-20℃保存。全自动生化仪检测血清ALT 和AST。放射性免疫方法检测血清中上述4项肝纤维化指标的含量。均按说明书严格操作。
1.3 统计方法
2 结果
2.1 大体观察
正常组和第1、3周模型鼠的肝脏表面光滑,呈粉红色,边缘较钝,质软,脾不大。第6周以后模型鼠的肝脏和脾脏开始增大,表面逐渐出现白色结节,肝脏呈暗红色或黑褐色,边缘锐利,质硬,门静脉增粗,肾脏大小无明显变化。与正常组相比,第6、9、11周模型鼠的肝脏指数和脾脏指数明显升高,差异具有统计学意义(P<0.05或P<0.01)。见表1。
表1 不同时期血吸虫肝损伤模型小鼠肝脏指数、脾脏指数和肾脏指数的变化(±s,%)Table 1 Changes in the liver,spleen and kidney indexes of mice schistosoma-induced liver damage models at different time points(±s,%)
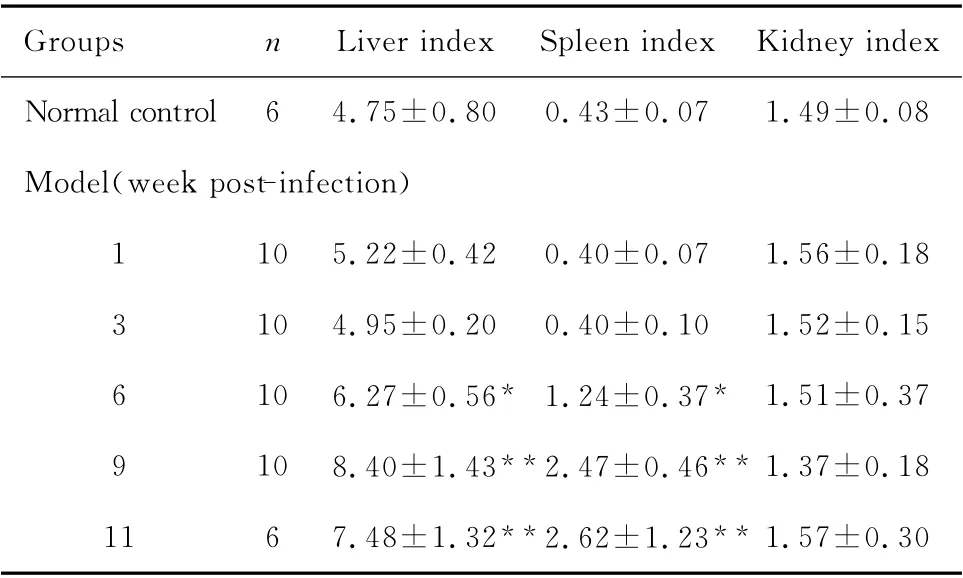
表1 不同时期血吸虫肝损伤模型小鼠肝脏指数、脾脏指数和肾脏指数的变化(±s,%)Table 1 Changes in the liver,spleen and kidney indexes of mice schistosoma-induced liver damage models at different time points(±s,%)
*P<0.05,**P<0.01 vs.normal control group
Groups n Liver index Spleen index Kidney index Normal control 6 4.75±0.80 0.43±0.07 1.49±0.08 Model(week post-infection)1 10 5.22±0.42 0.40±0.07 1.56±0.18 3 10 4.95±0.20 0.40±0.10 1.52±0.15 6 10 6.27±0.56* 1.24±0.37* 1.51±0.37 9 10 8.40±1.43**2.47±0.46**1.37±0.18 11 6 7.48±1.32**2.62±1.23**1.57±0.30
2.2 镜下观察
2.2.1 HE染色情况 正常组和第1、3周模型小鼠的肝小叶结构清晰。第1、3周模型小鼠的肝脏组织出现急性炎性细胞浸润,呈点状或灶状坏死;第6周出现围绕血管和汇管区的急性嗜酸性肉芽肿,可见虫卵在血管沉积,炎性细胞浸润;第9、11周逐渐形成慢性虫卵结节,大量虫卵在血管沉积,炎性细胞浸润明显,大片肝细胞出现嗜酸性坏死。见图1。
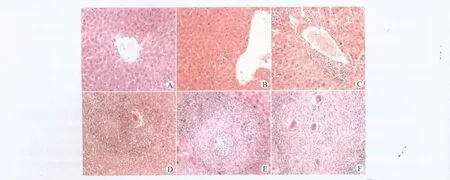
图1 不同时期血吸虫肝损伤模型小鼠肝脏组织的苏木精-伊红染色图(×200)Fig.1 HE staining of the liver tissue in mice schistosoma-induced liver damage models at different time points(×200)
2.2.2 Masson染色情况 胶原纤维被染成蓝色。正常组和第1、3周模型小鼠的肝脏组织仅组成血管的胶原纤维呈蓝色,肝小叶内及肝小叶间无胶原纤维的沉积。第6周模型小鼠在血管周围出现胶原纤维的沉积,血管内虫卵沉积,肝小叶结构尚存。第9和11周逐渐出现肝小叶间胶原纤维的沉积,肝小叶结构被破坏。见图2。
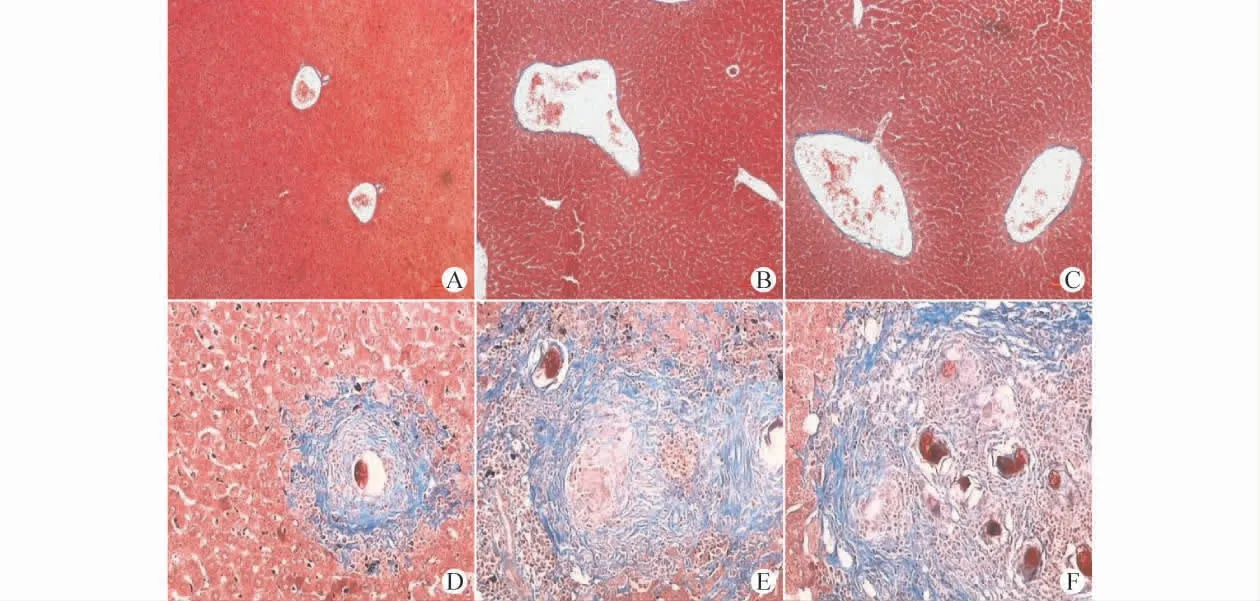
图2 不同时期血吸虫肝损伤模型小鼠肝脏组织的Masson染色图(×200)Fig.2 Masson staining of the liver tissue in the mice schistosoma liver damage models at different time points(×200)
2.3 肝功能检测结果
2.3.1 肝损伤指标 模型鼠血清中的ALT 和AST 在第6周达到高峰,而后下降,但仍高于正常组水平(均P<0.01)。见表2。
表2 不同时期血吸虫肝损伤模型小鼠血清中ALT和AST 的变化(±s,U/L)Table 2 Changes of serum ALT and AST levels in mice schistosoma liver damage models at different time points(±s,U/L)
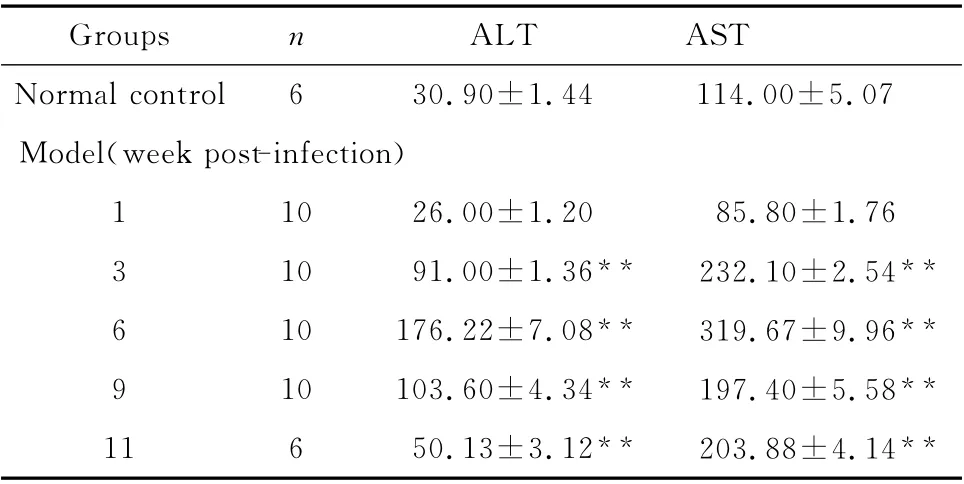
表2 不同时期血吸虫肝损伤模型小鼠血清中ALT和AST 的变化(±s,U/L)Table 2 Changes of serum ALT and AST levels in mice schistosoma liver damage models at different time points(±s,U/L)
**P<0.01 vs.normal control group
Groups n ALT AST Normal control 6 30.90±1.44 114.00±5.07 Model(week post-infection)1 10 26.00±1.20 85.80±1.76 3 10 91.00±1.36**232.10±2.54**6 10 176.22±7.08**319.67±9.96**9 10 103.60±4.34**197.40±5.58**11 6 50.13±3.12**203.88±4.14**
2.3.2 肝纤维化指标 模型鼠血清中的HA 和PCⅢ分别在第6 周和第3 周达到高峰(均P<0.01),而后下降,但仍高于正常组水平(均P<0.01);LN 在第1、3、9周明显升高,与正常组相比差异均有统计学意义(均P<0.01);Ⅳ-C 在第1周和第3周明显升高(均P<0.01),而后降至正常组水平。见表3。
2.3.3 肝损伤与肝纤维化指标的相关性分析 血清中的ALT、AST 水平与HA 含量呈正相关(r=0.32、0.29,均P<0.05),而与LN、PCⅢ和Ⅳ-C 则无明显相关性。
表3 不同时期血吸虫肝损伤模型小鼠血清中HA、LN、PCⅢ、Ⅳ-C的变化(±s,μg/L)Table 3 Changes of serum HA,LN,PCⅢandⅣ-C levels in mice schistosoma liver damage models at different time points(±s,μg/L)
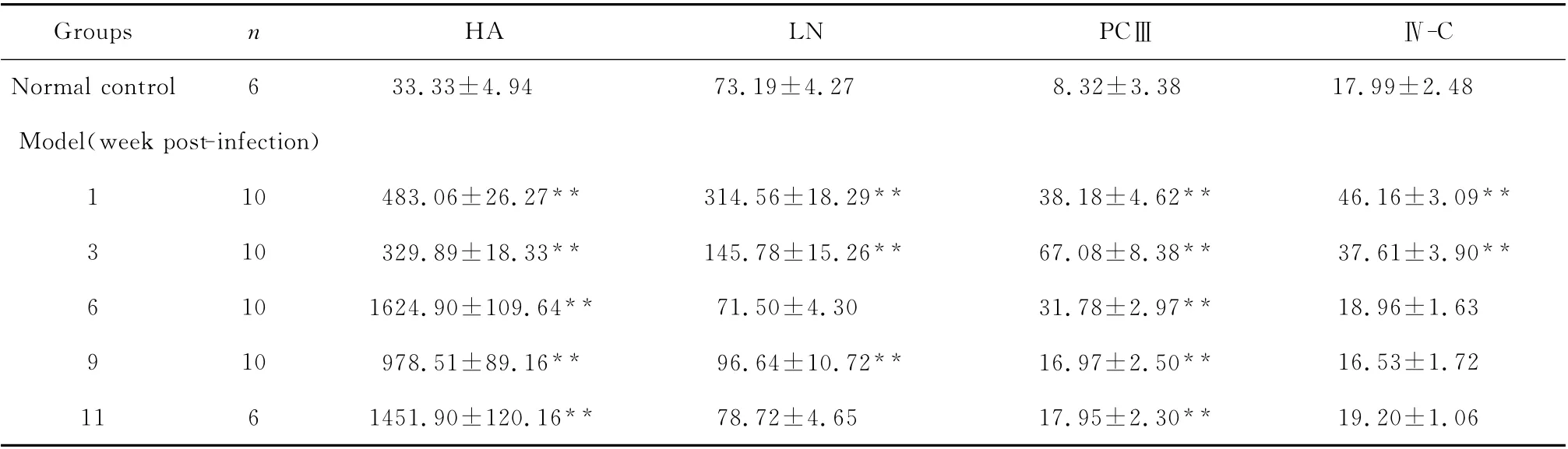
表3 不同时期血吸虫肝损伤模型小鼠血清中HA、LN、PCⅢ、Ⅳ-C的变化(±s,μg/L)Table 3 Changes of serum HA,LN,PCⅢandⅣ-C levels in mice schistosoma liver damage models at different time points(±s,μg/L)
**P<0.01 vs.normal control group
Groups n HA LN PCⅢⅣ-C Normal control 6 33.33±4.94 73.19±4.27 8.32±3.38 17.99±2.48 Model(week post-infection)1 10 483.06±26.27**314.56±18.29**38.18±4.62**46.16±3.09**3 10 329.89±18.33**145.78±15.26**67.08±8.38**37.61±3.90**6 10 1624.90±109.64**71.50±4.30 31.78±2.97**18.96±1.63 9 10 978.51±89.16**96.64±10.72**16.97±2.50**16.53±1.72 11 6 1451.90±120.16**78.72±4.65 17.95±2.30**19.20±1.06
3 讨论
血吸虫肝病患者在急性期可出现发热、肝区压痛和腹痛等症状,晚期主要与门静脉周围纤维化有关,临床上主要有肝脾肿大和腹水等症状。我们在实验中发现肝脏和脾脏在第6周开始增大,其表面出现虫卵白色结节的沉着,肝脏和脾脏指数达到了(6.27±0.56)%和(1.24±0.37)%,在第9周和第11周继续升高,肝脏指数分别达到(8.40±1.43)%和(7.48±1.32)%,脾脏指数分别达到(2.47±0.46)%和(2.62±1.23)%,与正常组(4.75±0.80)%和(0.43±0.07)%相比,差异均具有统计学意义。与正常小鼠比较,血吸虫肝损伤模型小鼠的肾脏则无明显变化,肾脏指数也与正常组持平,差异无统计学意义。表明在晚期血吸虫肝病中肝脏和脾脏是虫卵沉积和损害的主要脏器,与临床症状相符。
血吸虫肝病晚期的基本病变是由于虫卵沉着组织中而引起的虫卵结节和肝纤维化。本实验发现在尾蚴感染1周和3周后,在血管周围和肝组织内可见点状和灶状坏死,可能是尾蚴发育成的童虫和成虫释放的可溶性抗原激发了宿主的免疫应答,引起炎性细胞的浸润和肝细胞的部分坏死,是宿主的急性保护性炎症反应,此时尚无嗜酸性脓肿和肝纤维化的形成。据报道,尾蚴从感染宿主到发育为成虫并开始产卵需要24d,我们在实验的第1周和第3周没有发现虫卵的沉积,在第6周发现虫卵和胶原纤维的沉积,与文献报道一致[3]。
为了更好地观察血吸虫肝损伤模型小鼠不同时期肝功能的变化,我们检测了血清中转氨酶及肝纤维化指标的含量。在临床上ALT 和AST 常作为观察肝病患者疾病发展及预后的一个指标,是检测肝功能最敏感的指标之一,任何原因引起的肝损伤均可使其升高,但其增高幅度不一定与肝损伤的程度呈正比。有研究显示,血吸虫急性感染期血清中转氨酶明显高于正常人,而在慢性期和晚期则没有急性期升高那么明显[4]。本实验也发现血吸虫肝损伤模型小鼠血清中ALT 和AST 在第3、6 周升高明显,而后升高幅度逐渐下降。而病理学切片却显示从第6周肝脏组织出现严重的肝细胞嗜酸性坏死和纤维化增生,随着纤维化程度逐渐加重,ALT 和AST 的升高反而不太明显。此外,ALT、AST 与HA 呈正相关,但相关性较小。由此可见,ALT 和AST 的升高虽然能在一定程度上反映肝损伤和肝纤维化的程度,却存在一定的局限性,这与之前在病毒性肝炎的研究结论一致[5]。因此,在临床上要结合血清检验结果、病理学改变、患者的个体健康状况及影像学分析,对血吸虫肝损伤及纤维化的程度进行综合判断。
在临床上,目前主要用血清肝纤维化指标HA、LN、PCⅢ和Ⅳ-C作为反映肝纤维化程度的主要指标。有研究显示,肝纤维化时,Ⅲ型胶原的增生与肝纤维化不完全同步,在早期增生较快,在晚期呈下降趋势,表明在肝纤维化晚期Ⅲ型胶原的增生具有重要意义[4,6]。本实验发现在血吸虫感染的早期(前3周)PCⅢ升高最为明显,达(67.08±8.38)μg/L,晚期(6周以后)逐渐下降,但其值也在正常值的2倍之上。HA 是细胞外基质中蛋白多糖的主要成分,肝纤维化时在血液中的水平升高,测定血清中HA含量可反映肝功能改变情况,评估肝纤维化发展趋势及药物对肝纤维化的治疗效果[7]。有研究显示,肝病患者血清纤维化指标中HA 与肝纤维化程度最为符合[8-11]。本实验也发现HA 随着纤维化的进展逐渐升高,在晚期升高幅度较大,第6 周达到高峰,而后稍稍下降但仍然远远高于正常组。有研究表明Ⅳ-C在慢性乙肝发生纤维化的前期(S2 期之前)之前升高幅度最大[12],也有研究显示Ⅳ-C 在慢性乙肝纤维化分期的后期(S3和S4期)升高最为明显[13]。LN 在慢性乙肝纤维化分期各期之间无明显差异。在本实验中我们发现LN 和Ⅳ-C 在感染的早期(前3周)升高明显,但在发生纤维化的晚期(6周以后)则下降到正常水平。以上研究表明LN 和Ⅳ-C对于肝纤维化的早期诊断具有一定的意义[1-3]。
综上所述,ALT 及AST 可为血吸虫早期肝损伤的诊断提供参考,LN 和Ⅳ-C 有助于早期肝纤维化的诊断,HA 和PCⅢ是判断肝纤维化程度的敏感指标之一。本实验为临床上治疗不同时期的血吸虫肝损伤提供了诊断和治疗的理论依据,为血吸虫肝损伤模型的研究提供了思路。
[1] 张永,孙玉莉,王伟芹,等.柔肝抑纤饮联合二至丸对肝纤维化小鼠肝组织病理形态学和肝细胞超微结构的影响[J].中华中医药学刊,2009,27(12):2625-2627.
[2] 刘红艳,段瑞娴,郭燕,等.血吸虫肝纤维化小鼠肝组织中去甲肾上腺素及受体的表达[J].华中科技大学学报:医学版,2007,36(5):593-599.
[3] 陈兴宝,吴观陵,孙新,等.现代寄生虫病学[M].北京:人民军医出版社,2002:631-633.
[4] 乌文琳,黄育英,陈家林,等.日本血吸虫病肝纤维化的临床特点[J].中国血吸虫防治杂志,2006,18(6):422-426.
[5] 张妍琴,唐银江,王邵珺.慢性肝炎肝脏纤维化四项与ALT、AST的相关性研究[J].中国现代医生,2011,49(24):135-137.
[6] 陈家林,陶君,蔡卫民,等.晚期血吸虫病患者肝脾Ⅰ、Ⅲ型胶原含量的变化[J].中国寄生虫学与寄生虫病杂志,2003,21(6):323-325.
[7] 李岳生.血吸虫病诊断与治疗[M].北京:人民卫生出版社,2006:73-75.
[8] 李成忠,万谟彬,曾民德,等.非创伤性诊断指标优势组合对肝纤维化诊断价值的初步研究[J].中华肝脏病杂志,2001,9(5):261-263.
[9] Housset C,Guechot J.Hepatic fibrosis:physiopathology and biological diagnosis[J].Pathol Biol,1999,47(9):886-894.
[10] 蔡卫民,陶君,翁红雷,等.血清纤维化指标的影响因素分析[J].中华肝胆病杂志,2003,11(1):23-25.
[11] 贾中伟,罗庆礼,陆琼,等.血清透明质酸和层粘蛋白检测在日本血吸虫性肝纤维化程度判断的作用[J].安徽医科大学学报,2008,43(2):225-226.
[12] 刘仁才,刘龙秀,张德远,等.血清HA、LN、Ⅳ-C、hpcⅢ含量与慢性肝炎炎症活动度及肝纤维化程度的关系[J].中华传染病杂志,1999,17(2):122-123.
[13] 蔡卫民,郑敏,翁红雷,等.慢性肝炎患者血清纤维化指标的检测及其意义[J].中华内科杂志,2001,40(7):448-451.

