下调P55PIK 基因表达对乳腺癌MDA-MB-231细胞体外增殖和迁移能力的影响*
李 襄, 胡艺冰, 孙 黎, 曹小年, 王桂华, 丁庆庆, 吴亚群, 胡俊波
华中科技大学同济医学院附属同济医院 1分子医学中心 2甲乳外科 3肿瘤科, 武汉430030
磷脂酰肌醇-3-激酶(phosphoinositide-3-kinases,PI3Ks)是一类特异性磷酸化肌醇磷脂3 位羟基的激酶,参与了细胞生长、分化、凋亡、糖代谢和肿瘤发生等多项重要的生理及病理过程[1-3]。PI3Ks的分子克隆提示该激酶家族包括由多种亚基和亚型构成的3 种不同类型[4]。P55PIK 是1995年首次发现的IA 型PI3K 的调节亚基P85的异构体之一,可与PI3Ks的110kD 催化亚基形成稳定的复合物,调节其催化功能[5]。目前,PI3Ks催化亚基在与肿瘤发生和进展相关的一系列细胞学过程中的作用已被广泛研究,相反,对调节亚基在肿瘤发生中的作用的认识却非常有限。Zhang等[6]利用芯片技术研究人卵巢上皮癌中PI3K 家族成员的基因表达改变,发现与正常卵巢相比,P55PIK 基因mRNA 表达水平上调,且在肝癌、前列腺癌和乳腺癌中同样也可验证P55PIK mRNA 水平的上调。P55PIK 在癌症发生中的作用及其作为一个肿瘤治疗的潜在靶点正受到越来越广泛的关注,目前关于P55PIK 在乳腺癌中的作用尚未见报道。本实验采用RNA 干扰技术研究下调P55PIK 基因对乳腺癌细胞体外增殖和迁移能力的影响。
1 材料与方法
1.1 材料
人乳腺癌细胞株(MCF-7、MDA-MB-231、T47D)均购自中国科学院上海细胞研究所;四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)购自美国Sigma公司;Lipofectamine 2000购自Invitrogen公司;Opti-MEM 购自Gibco公司;Transwell-3422型小室购自美国Corning Costar公司。羊源性抗人P55PIK 抗体、GAPDH 及β-actin抗体均购自美国Santa Cruz公司;Pierce化学发光试剂盒购自Thermo Fisher Scientific公司。靶向P55PIK 基因的小干扰RNA 由广州瑞博公司合成,序列为:sense 5′-GGACUUGCUUUAUGGGAAAdTdT-3′;antisense 3′-dTdTCCUGAACGAAAUACCCUUU-5′。
1.2 细胞培养
MCF-7、MDA-MB-231、T47D 均采用含10%FBS(Gibco 公司)的DMEM/F12 细胞培养液(Gibco公司),常规培养于37℃、5%CO2的温箱中。
1.3 细胞转染
设空白对照组(以等体积的Opti-MEM 代替转染液,代表转染前水平)、阴性对照组(转染siRNANC,对P55PIK 无干扰作用)和siRNA-P55PIK 组(转染si-P55PIK,特异性干扰目的基因P55PIK 表达)。取对数生长期的MDA-MB-231细胞,消化制成单细胞悬液,接种入6 孔板,使细胞汇合度达50% 左右。用 Opti-MEM 液分别稀释 Lipofectamine 2000和siRNA 至所需浓度,室温静置5 min。将稀释后的siRNA 与Lipofectamine 2000小心混匀,室温静置20min,使形成稳定的siRNA-脂质体混合物。转染细胞弃去培养液,将上述混合物加入待转细胞。6h后,更换完全培养液继续培养。收集转染后48h细胞行体外实验或提取细胞总蛋白。
1.4 Western blot检测细胞P55PIK 蛋白的表达
收集细胞,提取总蛋白,取80μg蛋白行SDSPAGE分离蛋白,将蛋白质转移至甲醇激活的PVDF膜,5%BSA 封闭3h,一抗4℃孵育过夜,用含0.05% Tween20的TBS缓冲液(TBST)漂洗3次,每次10min;加入相应的辣根过氧化物酶标记的二抗,室温下反应1h;洗膜同前,曝光。
1.5 四甲基偶氮唑蓝(MTT)法测定细胞增殖
收集转染后48h 细胞,调整细胞密度为1×105/mL,取单细胞悬液100μL,接种入96孔板,每组设置4个复孔,分别在接种24、48、72、96及120h后,每孔加入MTT 10μL,于细胞培养箱中放置4h,吸去上清,加入DMSO 100μL/孔。用酶标仪测各组细胞在570nm 波长的吸光度值,绘制细胞生长曲线。
1.6 体外迁移实验
收集转染后48h 的各组细胞,重悬于0.1%BSA-无血清DMEM/F12培养液,调整细胞密度为2.5×105/mL,取单细胞悬液200μL 加入到Transwell小室上室内,下室加入600μL完全培养液,置37℃、5%CO2的细胞培养箱中培养24h。取出上室,弃除上室内液体,用棉签小心擦去上室膜面上未穿膜细胞,室温下用4%多聚甲醛固定15 min,0.01%结晶紫染色,400倍光学显微镜下计数穿膜细胞数,随即取5个视野,取平均值。每组实验设3个复孔,实验重复3次。
1.7 统计处理
使用SPSS 12.0软件对实验数据进行统计学分析,计量资料以均数±标准差(±s)表示,各组间比较采用单因素方差分析及两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 P55PIK 在3种乳腺癌细胞系中的基础表达
我们分析了3种不同乳腺癌细胞系MDA-MB-231、MCF-7和T47D 中P55PIK 蛋白的表达水平。通过Western blot检测,我们发现P55PIK 高表达于MDA-MB-231细胞中,在MCF-7中表达量次之,而在T47D 中呈低水平表达(图1)。我们选择P55PIK 蛋白高表达细胞株MDA-MB-231 进行RNA 干扰实验。
2.2 转染siRNA-P55PIK 显著下调MDA-MB-231 细胞中P55PIK 蛋白表达
提取转染后48h各组细胞中的总蛋白,West-ern blot检测P55PIK 蛋白的表达。我们发现,空白对照组和转染siRNA-NC 的阴性对照组细胞中P55PIK 蛋白的含量无明显差异,转染siRNAP55PIK 组细胞中P55PIK 蛋白表达水平显著降低,表明siRNA-P55PIK 有效降低了MDA-MB-231细胞中P55PIK 蛋白的表达(图2)。
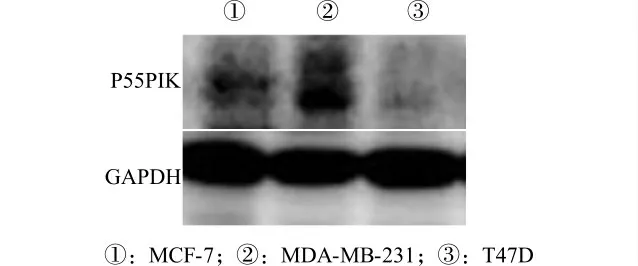
图1 P55PIK 蛋白在3种不同乳腺癌细胞系中的表达水平检测Fig.1 Detection of the expression level of P55PIK protein in 3 breast cancer cell lines

图2 siRNA-P55PIK 对MDA-MB-231细胞中P55PIK 蛋白表达水平的影响Fig.2 P55PIK protein expression levels in the three groups of MDA-MB-231cells
2.3 下调P55PIK 对MDA-MB-231细胞增殖的影响
MTT 实验显示转染siRNA-P55PIK 组MDAMB-231细胞吸光度(A)值在各检测时间点均低于空白对照组和阴性对照siRNA-NC 组,从第3天开始其细胞增殖差异具有统计学意义(P<0.01),各组细胞生长曲线见图3。siRNA-P55PIK 组细胞生长速度较空白对照组和阴性对照siRNA-NC 组降低,而空白对照组和siRNA-NC 组之间差异无统计学意义(P>0.05)。这些结果表明,下调P55PIK的表达可抑制MDA-MB-231细胞的生长。
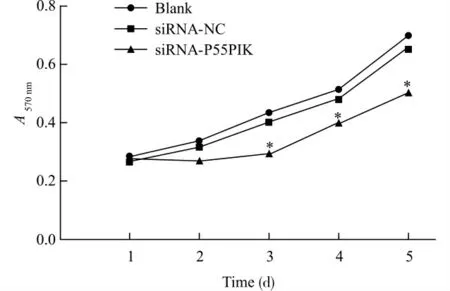
图3 MTT 法检测各组细胞的生长曲线Fig.3 The growth curves of cells in each group detected by MTT assay
2.4 下调P55PIK 对MDA-MB-231细胞体外迁移的影响
在400×的每高倍视野下,siRNA-P55PIK 组穿膜细胞数为(5.2±1.3),siRNA-NC 组和空白对照组穿膜细胞数分别为(18.6±3.8)和(18.4±4.3)。与其他两组相比较,siRNA-P55PIK 组穿膜细胞数明显减少(P<0.01),而siRNA-NC 组和空白对照组之间穿膜细胞数差异无统计学意义(P>0.05)(图4)。实验结果表明转染siRNA-P55PIK下调P55PIK 蛋白表达后MDA-MB-231细胞体外运动迁移能力明显减弱。

图4 下调P55PIK 对MDA-MB-231细胞体外迁移能力的影响(×400)Fig.4 Effect of down-regulation of P55PIK on the migration of MDA-MB-231cells in vitro(×400)
3 讨论
近年来我国乳腺癌的发病率呈逐年上升趋势,其发病率已位居女性恶性肿瘤发病首位。乳腺癌是一种复杂的异质性疾病,其发生是一个多步骤、多基因参与的复杂过程,涉及癌基因的激活和抑癌基因的突变、缺失、失活等多个环节,其具体分子机制尚不明确。大量基础研究及临床证据均提示PI3K 通路作为乳腺癌中最常见的突变通路,其过度激活在乳腺癌的发生、进展和治疗抵抗中发挥着重要的作用[7]。近年来,P55PIK 被发现在包括多形性胶质母细胞瘤、卵巢癌、前列腺癌、胃癌、肝癌和乳腺癌在内的多种恶性肿瘤中表达上调。下调P55PIK 基因的表达可诱发卵巢癌细胞凋亡,抑制胰岛素样生长因子2(IGF-2)诱导的多形性胶质母细胞瘤增殖,提示P55PIK 在促肿瘤发生中发挥作用[6-8]。
本研究中我们检测了3种不同乳腺癌细胞系中P55PIK 的表达水平,筛选出P55PIK 高表达乳腺癌细胞株MDA-MB-231。利用RNA 干扰技术将体外合成靶向干扰P55PIK 的siRNA 转染至MDA-MB-231细胞,在蛋白水平验证siRNA-P55PIK 能有效下调P55PIK 基因表达。MTT 实验显示下调P55PIK 后,MDA-MB-231细胞增殖显著降低。与本研究一致,Zhou等[9]在胃癌细胞系中干扰P55PIK基因表达发现胃癌细胞生长受抑制,细胞阻滞于G0/G1期。我们前期研究发现,在白血病细胞中高表达P55PIK可以促进肿瘤细胞的增殖。Soroceanu等[8]则在其研究中发现P55PIK参与介导了IGF-2在神经母细胞瘤中的促增殖作用。本实验在乳腺癌细胞模型中进一步验证了P55PIK 促进肿瘤细胞增殖的作用。Xia等[10]于2003年在其研究中发现,P55PIK 蛋白可通过其氨基端24个氨基酸(N24)与细胞周期调节蛋白Rb结合,通过调控Rb蛋白参与调节细胞周期。本课题组的研究进一步发现,P55PIK 蛋白可通过Rb依赖和非依赖途径调节细胞周期和细胞增殖[11],高表达P55PIK蛋白N 端24个氨基酸能抑制肝癌、结肠癌等多种癌细胞的增殖[12-14]。本实验首次观察了下调P55PIK 表达对乳腺癌细胞体外迁移能力的影响,应用Transwell迁移小室,我们发现下调P55PIK 表达明显降低了MDA-MB-231 细胞的体外运动迁移能力。P55PIK 在乳腺癌中促进细胞增殖和迁移的机制尚不清楚,将是我们下一步的研究内容。
本研究结果表明,P55PIK 是乳腺癌发生、发展过程中的一个促进因素,其直接或间接参与了乳腺癌细胞增殖、迁移等恶性生物学行为。对P55PIK研究的不断深入将对探讨乳腺癌发病机制、判断预后及治疗产生深远意义,阻断P55PIK 功能有望成为包括乳腺癌在内的多种恶性肿瘤治疗的新手段。
[1] Katso R,Okkenhaug K,Ahmadi K,et al.Cellular function of phosphoinositide 3-kinases:implications for development,homeostasis,and cancer[J].Annu Rev Cell Dev Biol,2001,17:615-675.
[2] Willems L,Tamburini J,Chapuis N,et al.PI3Kand mTOR signaling pathways in cancer:new data on targeted therapies[J].Curr Oncol Rep,2012,14(2):129-138.
[3] Dituri F,Mazzocca A,Giannelli G,et al.PI3Kfunctions in cancer progression,anticancer immunity and immune evasion by tumors[J].Clin Dev Immunol,2011,2011:947858.
[4] Vivanco I,Sawyers C L.The phosphatidylinositol 3-kinase AKT pathway in human cancer[J].Nat Rev Cancer,2002,2(7):489-501.
[5] Pons S,Asano T,Glasheen E,et al.The structure and function of p55PIK reveal a new regulatory subunit for phosphatidylinositol 3-kinase[J].Mol Cell Biol,1995,15(8):4453-4465.
[6] Zhang L,Huang J,Yang N,et al.Integrative genomic analysis of phosphatidylinositol 3′-kinase family identifies PIK3R3as a potential therapeutic target in epithelial ovarian cancer[J].Clin Cancer Res,2007,13(18Pt 1):5314-5321.
[7] Adams J R,Schachter N F,Liu J C,et al.Elevated PI3Ksignaling drives multiple breast cancer subtypes[J].Oncotarget,2011,2(6):435-447.
[8] Soroceanu L,Kharbanda S,Chen R,et al.Identification of IGF-2signaling through phosphoinositide-3-kinase regulatory subunit 3as a growth-promoting axis in glioblastoma[J].Proc Natl Acad Sci USA,2007,104(9):3466-3471.
[9] Zhou J,Chen G B,Tang Y C,et al.Genetic and bioinformatic analyses of the expression and function of PI3K regulatory subunit PIK3R3in an Asian patient gastric cancer library[J].BMC Med Genomics,2012,5(1):34.
[10] Xia X,Cheng A,Akinmade D,et al.The N-terminal 24amino acids of the p55gamma regulatory subunit of phosphoinositide 3-kinase binds Rb and induces cell cycle arrest[J].Mol Cell Biol,2003,23(5):1717-1725.
[11] Hu J,Xia X,Cheng A,et al.A peptide inhibitor derived from p55PIK phosphatidylinositol 3-kinase regulatory subunit:a novel cancer therapy[J].Mol Cancer Ther,2008,7(12):3719-3728.
[12] 孙黎,袁响林,王桂华,等.磷脂酰肌醇-3-激酶调节亚基N 末端24个氨基酸对肝癌细胞增殖的抑制[J].华中科技大学学报:医学版,2009,38(4):430-437.
[13] 王桂华,孙黎,罗学来,等.磷脂酰肌醇-3-激酶p55Nγ-N 末端24个氨基酸抑制结肠癌细胞增殖的作用[J].癌症,2008,27(10):1034-1038.
[14] 左学良,王桂华,蔡娟,等.磷脂酰肌醇3-激酶调节亚基p55PIK表达载体的构建及单克隆株的筛选[J].华中科技大学学报:医学版,2010,39(3):366-368.

