儿童慢性乙肝肝组织病理与相关标志物的研究
雷晓燕 王三萍 孙永红 袁 宏
中国属HBV 感染高流行区,一般人群的HBsAg 阳性率为9.09%,在围生期和婴幼儿时期感染HBV 者中,分别有90%和25% ~30%将发展成慢性感染[1],儿童慢性乙肝起病隐匿,无明显临床表现,且随儿童年龄增长,肝纤维化程度逐渐加重。肝活检为目前了解肝脏炎症状况及纤维化程度的金指标,但不易被家长接受,故探讨无创且有诊断价值的指标具有重要意义。国内外肝组织损害程度判断的无创性检查指标在成人中已做了大量的研究,4 项肝纤维化血清标志物,如血清透明质酸(HA)、层黏连蛋白(LN)、Ⅲ型前胶原(PC Ⅲ)和Ⅳ型胶原(CⅣ)为较敏感的反映肝损害程度的指标,肝纤维化的发生与病毒数量或病毒复制强弱无关。在儿科领域相关研究很少,本研究前期结果显示HBV 基因型和HBV 核内共价闭合环状DNA (HBV cccDNA),与乙肝的活动性、严重程度和病毒复制水平有一定关系。本文以肝活检作为反映肝脏炎症状况及纤维化程度的金指标,考察HBsAg 携带组和慢性乙肝组,HBV cccDNA 阳性与阴性,HBV 不同基因型,4 项肝纤维化血清标志物与肝炎症活动度和纤维化的相关性,以了解上述指标在乙肝诊断、治疗和预后中的价值。
1 方法
1.1 病例纳入标准 ①2008 年4 月至2011 年8 月于甘肃省人民医院儿科和兰州大学第一医院感染科门诊就诊和住院的乙肝及HBV 携带患儿;②HBV-DNA 阳性;③就诊前未行抗病毒治疗。
1.2 病例排除标准 ①其他肝炎病毒感染、自身免疫性肝病、药物性肝损害和酒精性肝损害等患儿;②就诊后根据病情需要进行肝穿刺,但患儿及其家长不同意进行肝穿刺,因而无法判断肝纤维化程度和炎症活动度的患儿。
1.3 对照组纳入标准 在甘肃省人民医院健康查体、年龄1 ~15 岁的儿童,无肝脾肿大、黄疸、肝炎接触史,并排除心、肾疾病,肝功能正常,HBsAg 阴性。
1.4 诊断标准 ①乙肝:符合2011 年《病毒性肝炎防治方案》中慢性乙肝的诊断标准[1];②HBV 病毒携带:是指感染了HBV,没有肝炎症状和体征,肝功能等各项检查正常,1年内连续随访3 次以上,血清ALT 和AST 均在正常范围。
1.5 伦理与知情同意 本研究为甘肃省自然基金项目(099RJYA001)中的一部分,得到了甘肃省人民医院伦理委员会的批准。HBV DNA 阳性患儿需行肝穿刺[2],并事先征得患儿及其家长同意。
1.6 实验室检测方法 肝组织病理学检查、HBV-DNA、HBV cccDNA、生化指标检测、HBV-DNA 基因分型方法同本文前期研究[3]。血清HA、LN、PCⅢ和CⅣ检测方法采用RIA 法检测,试剂盒由北方免疫中心提供,严格按试剂盒说明书专人操作。仪器使用西安262 厂生产的FJ22008PS 全自动免疫计数器。
1.7 分组考虑和依据 ①根据慢性乙肝诊断标准[1],将研究对象分为HBV 携带组和慢性乙肝组;慢性乙肝组进一步分为轻度、中度和重度亚组。轻度亚组:病情较轻,症状不明显或虽有症状、体征但ALT 或AST 轻度异常者(小于正常参考值2 倍);中度亚组:症状、体征、实验室检查介于轻度和重度之间;重度亚组:有明显或持续的肝炎症状,如乏力、纳差、腹胀等,可伴有肝病面容、肝掌及蜘蛛痣或肝脾肿大而排除其他原因,且无门静脉高压症状;实验室检查血清ALT 反复或持续升高,白蛋白降低或A/G 比例异常,丙种球蛋白明显升高,凡白蛋白≤32 g·L-1、胆红素>85.5 μmol·L-1、凝血酶原活动度60% ~40 %,3 项检测中有1项达上述数值者即归为重度亚组。②依据肝内胶原沉积对肝结构破坏范围、程度和对肝微循环影响的大小,将肝纤维化程度划分为S0~S4期;根据汇管区、汇管区周围炎症及小叶内炎症程度,将肝组织炎症活动度分为G0~G4级[1];考虑儿童肝纤维化程度≥S2期和肝组织炎症活动度≥G2级以上的比例较小,故肝纤维化程度分为S0、S1和S2~S4三个组,肝组织炎症活动度分为G0、G1和G2~G4三个组。③根据血清HBV cccDNA 的检测结果,分为HBV cccDNA 阳性组和阴性组。④根据前期相同病例HBV 基因分型的结果,分为B 基因型组和C 基因型组。
1.8 统计学方法 采用SPSS 12.0 软件进行统计分析。计量资料以±s表示,组间均数比较采用方差分析;计数资料的比较采用χ2检验。P <0.05 为差异有统计学意义。
2 结果
2.1 一般情况 46 例患儿进入本研究(图1)。男34 例,女12 例,年龄1 ~16 岁,平均年龄(11.8 ±3.7)岁。
2.2 慢性乙肝组和HBV 携带组肝纤维化血清标志物水平比较 表1 显示,HBV 携带组、对照组、慢性乙肝不同严重程度亚组年龄差异无统计学意义。随乙肝临床分度加重,血清HA、LN、PCⅢ和CⅣ呈升高趋势,以重度亚组上升最为明显;HBV 携带组HA、PCⅢ与对照组比较差异有统计学意义;轻度亚组与对照组比较HA 升高差异有统计学意义。

图1 研究对象纳入、排除及分组流程图Fig 1 Inclusion process for children with CP
2.3 慢性乙肝临床分度与肝炎症活动度、纤维化分级HBV 携带组:G015 例(75.0%),G14 例(20.0%),G21 例(5.0%);S016 例(80.0%),S13 例(15.0%),S21 例(5.0%)。轻度乙肝亚组:G04 例(30.8%),G17 例(53.8%),G22 例(15.4%);S06 例(46.2%),S17 例(53.8%),S21 例(7.7%)。中度乙肝亚组:G02 例(25.0%),G13 例(37.5%),G22 例(25.0%),G31 例(12.5%);S03 例(37.5%),S14 例(50.0%),S21 例(12.5%)。重度乙肝亚组:G11 例(20.0%),G22 例(40.0%),G32 例(40.0%);S12 例(40.0%),S21 例(20.0%),S32 例(40.0%)。随着乙肝临床分度加重,≥G2和≥S2期的构成比呈升高趋势。
2.4 肝纤维化血清标志物与肝炎症活动度、纤维化分级相关性 随肝炎症活动度和纤维化分级增加,血清HA、LN、PCⅢ和CⅣ均呈升高趋势,差异均有统计学意义(表2)。
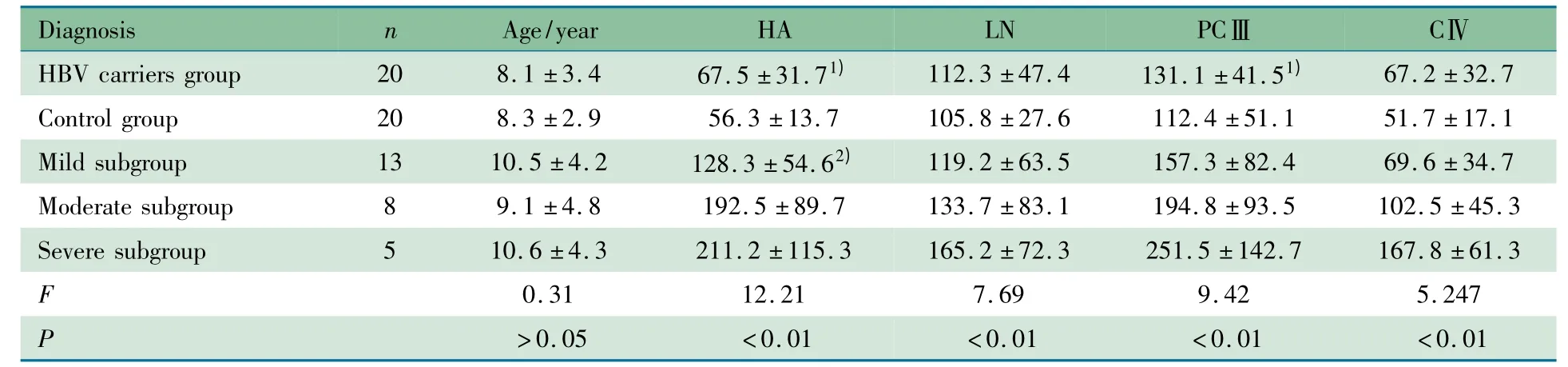
表1 46 例乙型肝炎病毒感染患儿不同临床分度肝纤维化血清标志物水平比较Tab 1 Levels of serum fibrosis markers with different grades of 46 HBV-DNA positive chidren with chronic hepatitis B

表2 肝炎症活动度、纤维化与血清肝纤维化标志物的相关性Tab 2 Correlation of HA、LN、PCⅢ、CⅣlevels with serum fibrosis markers
2.5 血清HBV cccDNA 与肝炎症活动度、纤维化分级相关性 血清HBV cccDNA 阳性组与阴性组在肝组织炎症活动度<G2级分别为82.9%(29/35)和81.8%(9/11),两组差异无统计学意义(P=0.963);血清HBV cccDNA 阳性组与阴性组在肝组织纤维化<S2期分别为88.5%(31/35)和81.8%(9/11),两组差异无统计学意义(χ2=2. 31,P =0.736)。
2.6 不同HBV 基因型与肝炎症活动度、纤维化分级的相关性 46 例肝组织活检患儿中,B 基因型17 例(36.9%),C 基因型26 例(56.5%),B/C 混合型2 例,非B/C 型1 例。
17 例HBV B 基因型患儿肝脏炎症活动度G0~G2期分别为58.8%(10 例)、35.3%(6 例)和5.9%(1 例);26 例HBV C 基因型患儿G0~G3期分别为30.7%(8 例)、42.3%(11 例)、15.1%(4 例)和11.5%(3 例);两组炎症分级差异有统计学意义(χ2=14.38,P =0.036)。肝纤维化分级:17 例HBV B 基因型患儿S0~S2期分别为65.3%(11 例)、29.4%(5 例)和5.9%(1 例);26 例HBV C 基因型患儿S0~S3期分别为42.3%(11 例)、38.4%(10 例)、11.5%(3例)和7.7%(2 例),两组纤维化程度差异有统计学意义(χ2=23.93,P=0.002)。
3 讨论
近年国内外文献报道[4]血清HA、LN、PCⅢ和CⅣ等指标可作为肝纤维化的敏感血清标志物,在临床诊断中具有重要价值。谢士斌等[5]研究显示HA 是反映肝纤维化最敏感的指标,可作为早期肝硬化的诊断指标,敏感度和特异度高;CⅣ在肝纤维化早期即升高,联合检测对肝纤维化可提高检测率,是肝纤维化无创检测的发展趋势。国外研究表明[6],联合多项肝纤维化标志物可较准确预测S2~S4期肝纤维化。本研究检测了46 例慢性乙肝患儿4 项肝纤维化血清标志物水平,随着乙肝程度的加重,血清HA、CⅣ、LN、PCⅢ水平逐渐升高,尤其中度以上乙肝有明显的升高,轻度亚组HA 有明显的升高。进一步分析显示随着肝炎症活动度和纤维化分级的加重,肝纤维化血清标志物水平逐渐升高,尤以G2或S2以上明显。HBV 携带组HA、PCⅢ与对照组比较差异有统计学意义。以上结果表明血清HA、ⅣC、LN、PCⅢ水平与慢性肝炎发展的阶段性以及肝纤维化程度一致,与江冬梅等[7]研究基本一致。慢性肝炎早期,基质合成和降解代谢处于相对平衡状态,尚无造成细胞外基质在肝脏中沉积,缺乏客观评价指标,但血清HA、CⅣ和LN 水平有一定程度的增高。但随着慢性乙肝严重程度加重,血清HA、CⅣ、LN 持续高水平增加,说明肝纤维化血清标志物可更早反映肝脏损害程度。
传统的观点认为,ALT 水平升高是肝脏存在坏死炎症的标志,而ALT 正常的HBV 感染者,则无或仅有轻度的肝组织学炎症,并对抗病毒药物不敏感。但最近有研究表明,部分ALT 水平正常的慢性HBV 携带者肝活检时,仍可存在显著的肝组织坏死炎症和纤维化[8,9]。本研究显示HBV携带者ALT 正常,20 例行肝组织活检,其中5 例存在G1~G2级炎症改变,4 例存在S1~S2期纤维化。且HBV 携带组血清HA、PCⅢ较对照组有不同程度增高,可能与HBV 携带者病毒复制有关,虽然ALT 水平正常,但病理活检提示部分病例存在肝组织炎症和纤维化,可能是导致肝纤维化血清标志物轻度升高的原因。结合肝纤维化血清标志物及ALT 等指标综合判断更具有意义。
HBV 基因型分布呈一定的地域性,东南亚地区慢性HBV 感染者以B、C 基因型为主,但流行主导基因型各地存在一定差异。在中国HBV 基因型以B、C 型为主,北方地区以C 型为主,南方以B 型为主,国内外研究显示HBV 基因型与临床表现、预后、治疗应答均有一定关系,提示不同基因型具有不同的致病性,在以B、C 基因型为优势的地区,C 基因型具有较强的致病能力,预后差。C 基因型在严重的肝病以及原发性肝癌的患者中所占比例显著高于其他基因型。慢性乙肝患者HBV 基因型中C 型比例明显高于B 型与B/C 型,且肝脏病理变化较B 基因型与B/C 基因型严重[10]。本研究显示C 基因型组肝炎症活动度及纤维化程度较B 基因型组更严重,提示HBV 基因B、C 分型与肝组织病理改变有关,故HBV 基因型测定对判断肝损害的程度,疾病严重程度,指导治疗及评估预后具有重要价值。
ccc DNA 的存在是肝细胞内持续HBV 感染的特征。本课题组前期研究提示124 例患儿HBV DNA 均为阳性,随着病情加重,HBV cccDNA 检出率增加,提示HBV cccDNA 可反映临床严重程度[3]。本研究显示,HBV cccDNA 与肝纤维化、炎症活动度无显著的相关性。慢性乙肝患儿肝脏损伤为病毒长期复制引发的针对病毒抗原的一系列免疫应答反应[11]。肝脏损伤受病毒复制水平、宿主免疫功能、免疫遗传的异质性、非特异性炎症应答等因素的影响。肝纤维化的程度、肝细胞坏死程度与肝脏炎症持续时间有关,尽管HBV 的复制不能直接、完全反映肝脏损害及炎症程度,但可导致肝组织炎症,可能与肝组织炎症及纤维化具有间接关系。
总之,目前单一指标较难反映乙肝的炎症活动度及纤维化程度,血清HBV cccDNA 水平与其无显著的相关性,血清HA、LN、PCⅢ和CⅣ,HBV 基因分型与肝炎症活动度、纤维化程度有较好的相关性,临床可结合病毒复制水平、ALT、肝纤维化血清标志物及HBV 基因分型综合判断肝损害程度,以确定治疗时机。
[1]中华医学会传染病与寄生虫学分会,病毒学分会.病毒性肝炎防治方案. Chin J Hepatol(中华肝脏病杂志),2000,8(1):324-329
[2]Zhang HF(张鸿飞),Yang XJ,Chen JM,et al. 小儿肝穿刺活体组织检查511 例临床应用. Chin J Pediatr(中华儿科杂志),1998,7(1):31-33
[3]Sun YH(孙永红),Lei XY,Yang JL,et al. Research on serum HBV cccDNA and genotype of virus in children with chronic hepatitis B. Chin J Epidemiol(中华流行病学杂志),2011,32(12):1247-1249
[4]Mayerat C,Mantegani A,Frei PC. Does hepatitis B virus(HBV) genotype influence the clinical outcome of HBV infection. J Viral Hepat,1999,6(4):299-304
[5]Xie SB (谢仕斌),Yao JL,Zheng RQ,et al. Accurate diagnosis of stages of hepatic fibrosis by measuring levels of serum hyaluronic acid,procollagen type Ⅲ,and collagen typeⅣ. Chin J Hepatol(中华肝脏病杂志),2001,9(6):334-336
[6]Patel K,Gordon SC,Jacobson I,et al. Evaluation of apanel of on invasive serum markers to differentiate mild from moderate to advanced liver fibrosis in chronic hepatitis C patients. J Hepatol,2004,41(6):935-942
[7]Jiang DM(江冬梅),Zhou JQ,Zhang XL,et al. Determination and clinical significance of four serum markers of liver fibrosis in children with chronic hepatitis. Chin J Pediatr(中华儿科杂志),2001,39(9):78-80
[8]Kim HC,Nam CM,Jee SH,et al. Normal serum aminotransferase concentration and risk of mortality from liver diseases:prospective cohort study. BMJ,2004,328(7446):983-989
[9]Wang C,Deubner H,Shuhart M,et al. High prevalence of significant fibrosis in patients with immunotolerance to chronic hepatitis B infection. Hepatology,2005,42(S):573A
[10]Zhong CF(钟崇芳),Hao W,Li Z et al.Relationship between the histology and genotype of hepatitis B virus DNA in chronic hepatitis B patients. World Chinese Journal of Digestology(世界华人消化杂志),2007,15(16):1859-1864
[11]Chen CJ,Yang HI,Su J,et al. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA,2006,295(1):65-73

