诱导型一氧化氮合酶、环氧合酶-2与乳腺癌淋巴管生成的关系及其临床意义
黄玉钿 张 声 郑 曦 吴钦穗 黄双月
(福建医科大学附属福州市第一医院病理科,福建 福州 350009)
淋巴道转移是乳腺癌最重要的生物学行为之一,新近研究表明〔1〕,癌的淋巴道转移不是一个被动的过程,癌间质淋巴管的生成与癌细胞的转移密切相关。诱导型一氧化氮合酶(iNOS)〔2,3〕和环氧合酶(COX)-2〔4,5〕与肿瘤的侵袭转移密切相关,我们采用原位杂交法检测90例乳腺浸润性导管癌组织和30例乳腺良性病变组织中iNOS和COX-2的mRNA表达情况,另以免疫组化法检测乳腺癌组织中VEGF-C表达和淋巴管内皮透明质酸受体-1(LYVE-1)标记的淋巴管密度(LVD),分析iNOS、COX-2与乳腺癌淋巴管生成的关系,探讨两者在乳腺癌淋巴道转移中的作用机制及其临床意义。
1 材料与方法
1.1 材料 收集2000至2006年存档的乳腺浸润性导管癌石蜡包埋组织90例,患者均为女性,年龄30~80岁,并以30例乳腺纤维腺瘤组织作为对照组,所有病例均有完整临床资料,术前均未接受过放化疗或免疫治疗。乳腺癌组织病理学分级采用Bloom-Richardson系统Nottingham改良方案〔6〕;患者临床分期按照TNM分期法(UICC,2003版)。
1.2 主要试剂与方法 iNOS和COX-2的mRNA寡核苷酸探针及原位杂交试剂盒购自武汉博士德生物公司,兔抗人多克隆抗体VEGF-C为美国Zymed公司产品(工作浓度为1∶150),兔抗人多克隆抗体LYVE-1为英国Abcam公司产品(工作浓度为1∶100),Elivision免疫组化试剂盒购自福州迈新生物公司。寡核苷酸探针原位杂交检测和Elivision免疫组化检测严格按照试剂盒步骤进行,均设立阳性及阴性对照。
1.3 结果判断 iNOS、COX-2原位杂交检测结果和VEGF-C免疫组化检测结果的判定均采用半定量法:先将特异性定位于乳腺癌细胞质的染色按着色深浅打分:0分为无色、1分为淡黄、2分为棕黄、3分为棕褐;再将阳性细胞所占百分比打分:0分为阴性、1分为≤10%、2分为11% ~50%、3分为≥51%,两种得分乘积≥3分为阳性表达。采用免疫组化检测LYVE-1,其标记的LVD按照Schoppmann的方法〔7〕,LYVE-1阳性染色定位于淋巴管内皮细胞质,染成棕黄色的单个内皮细胞或内皮细胞簇形成无肌性或纤维性管腔结构均可计数为1个微淋巴管;在低倍镜下选取5个微淋巴管密集区,然后在高倍镜视野(HPF,×200)下计数微淋巴管的数目,取其平均值作为LVD(个/HPF)。
1.4 统计学处理 采用SPSS11.0统计软件分析,计数资料比较采用χ2检验;计量资料比较采用t检验。
2 结果
2.1 iNOS和COX-2 mRNA在乳腺癌中的表达情况 iNOS和COX-2 mRNA阳性表达位于乳腺癌细胞质上(见图1),两者在乳腺癌组织中的表达阳性率分别为66.7%(60/90),68.9%(62/90),在良性对照组中阳性率分别为3.3%(1/30),6.7%(2/30),两者在良恶性乳腺肿瘤中的表达差异均有统计学意义(P<0.01)。iNOS mRNA表达与乳腺癌肿瘤大小、临床分期呈正相关(P<0.05),在不同病理分级、年龄、有/无腋窝淋巴结转移的分组中表达差异无统计学意义(P>0.05),见表1。乳腺癌COX-2 mRNA表达与病理分级、淋巴结转移、分期呈正相关(P<0.05),在不同肿瘤大小、年龄分组中表达差异无统计学意义(P>0.05),见表1。乳腺癌中iNOS mRNA阳性组的COX-2 mRNA阳性表达率为76.7%(46/60),而iNOS mRNA阴性组的COX-2 mRNA阳性率为53.3%(16/30),iNOS和COX-2的mRNA阳性表达呈正相关(P<0.05)。
2.2 乳腺良恶性肿瘤组织中LVD和VEGF-C蛋白表达的差异 LYVE-1阳性定位于乳腺癌间质淋巴管内皮细胞质(见图1),LYVE-1标记的乳腺癌LVD为(8.03±2.26)个/HPF,乳腺纤维腺瘤LVD为(1.86±0.97)个/HPF,差异显著(P<0.01)。VEGF-C蛋白表达于乳腺癌细胞质上(见图1),乳腺癌VEGF-C蛋白表达阳性率为47.8%(43/90),乳腺纤维腺瘤VEGF-C阳性率为6.7%(2/30),差异显著(P<0.01)。
2.3 iNOS mRNA在乳腺癌组织中的表达与LVD和VEGF-C蛋白表达的关系 乳腺癌iNOS阳性组LVD与iNOS阴性组LVD差异具有统计学意义(P<0.01)。乳腺癌iNOS阳性组VEGF-C蛋白表达阳性率与iNOS阴性组VEGF-C阳性率差异具有统计学意义(P<0.05),见表2。
2.4 COX-2 mRNA在乳腺癌组织中的表达与LVD和VEGF-C蛋白表达的关系 乳腺癌COX-2阳性组LVD与COX-2阴性组LVD差异具有统计学意义(P<0.01)。乳腺癌COX-2阳性组VEGF-C蛋白表达阳性率与COX-2阴性组VEGF-C阳性率差异无统计学意义(P>0.05),见表2。
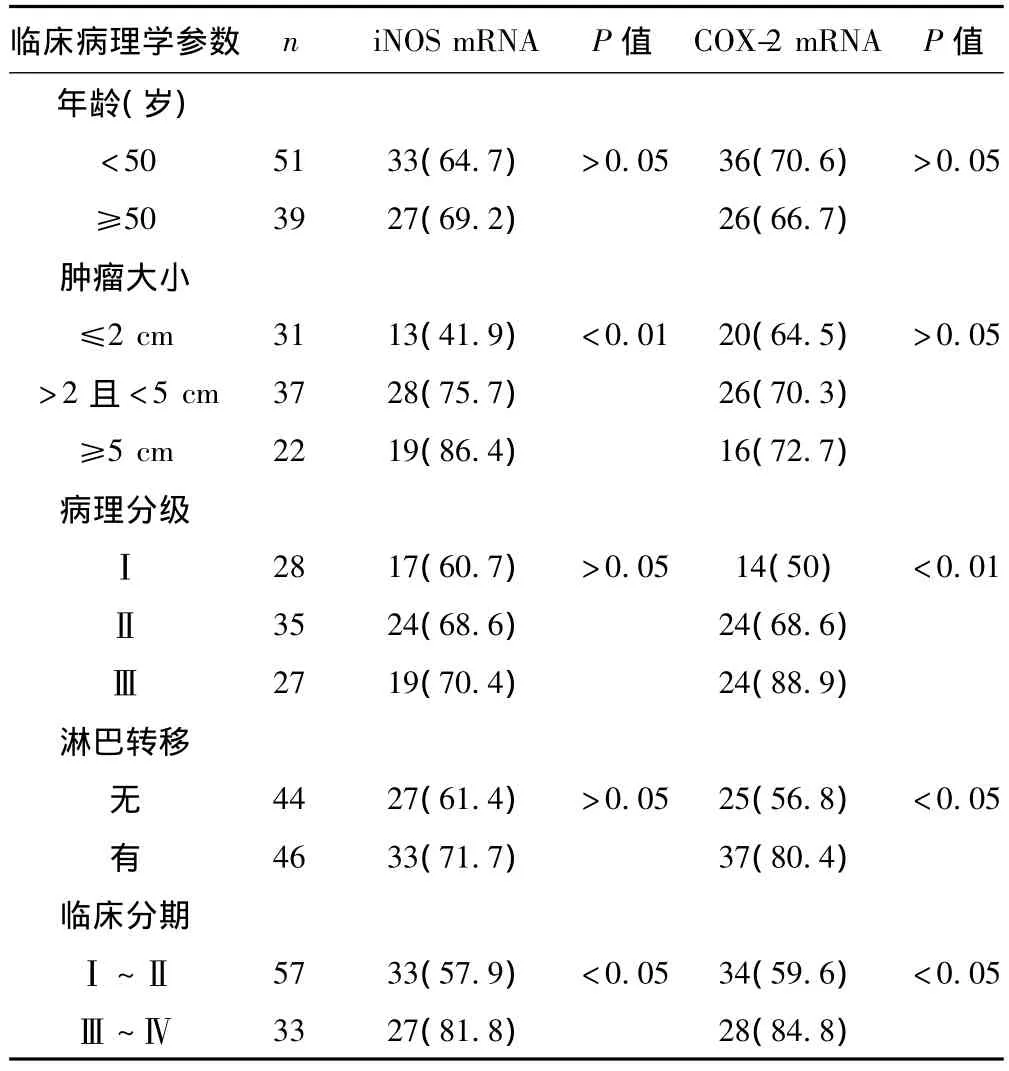
表1 iNOS和COX-2 mRNA与乳腺癌患者临床病理学参数的关系〔n(%)〕

表2 乳腺癌中iNOS和COX-2 mRNA与LVD及VEGF-C蛋白表达的关系
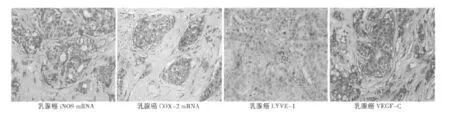
图1 乳腺癌iNOS mRNA、COX-2 mRNA、LYVE-1、VEGF-C的表达(×400)
3 讨论
iNOS是NO合成的关键酶,在正常生理条件下各组织细胞的iNOS活性几乎不表达,当遇到细胞因子、致癌剂等因素时,无活性的单体聚合成二聚体从而获得合成NO的能力;iNOS合成的NO浓度可导致氮氧自由基如N2O3的形成,后者可使胺硝化形成亚硝胺,诱发DNA突变从而引发肿瘤〔3〕。本研究结果表明乳腺癌中iNOS mRNA阳性率较良性组显著提高,且iNOS mRNA阳性率随乳腺癌肿瘤大小和分期的上升而增高,提示iNOS在乳腺癌的生长侵袭过程中起促进作用。
COX-2是催化花生四烯酸转化为前列腺素(PGs)的重要限速酶,在正常组织中无表达,当受到各种生长因子、癌基因等因素刺激时COX-2得以迅速合成,COX-2的催化产物PGs能引起前致癌物发生环氧化反应成致癌物,启动肿瘤的发生〔5〕。本研究显示乳腺癌COX-2 mRNA阳性率较良性组显著提高,COX-2 mRNA阳性率与乳腺癌分级、淋巴结转移和分期呈正相关,提示COX-2能显著提高乳腺癌细胞的侵袭转移能力。iNOS和COX-2在正常条件下不表达,均需一定的病理因素诱导生成,本研究结果还显示,乳腺癌组织中iNOS和COX-2两种基因的mRNA阳性率呈正相关,表明在致癌因素的诱导下,两者的转录合成具有协同作用,共同促进乳腺癌的发生发展。
LYVE-1是特异性表达于淋巴管内皮细胞上的CD44糖蛋白同系化合物,在血管内皮细胞上无表达,已有研究表明〔8〕,以LYVE-1标记乳腺癌间质内淋巴管并计算淋巴管密度(LVD)能有效反映乳腺癌的淋巴管生成水平,本研究结果显示,乳腺癌LVD水平较乳腺纤维腺瘤显著提高。VEGF-C基因定位于人染色体4q34,是重要的淋巴管内皮细胞特异性调节因子,能促进淋巴管的生成〔9〕。本研究显示,乳腺癌组织中VEGF-C表达阳性率明显高于良性对照组。以上关于LVD和VEGF-C的研究提示,淋巴管生成在乳腺癌的发生发展过程中扮演重要角色;本研究显示iNOS与乳腺癌组织LVD水平呈正相关,且iNOS表达与VEGF-C呈正相关,提示iNOS能显著提高乳腺癌组织VEGF-C的表达,VEGF-C的上调能使其与淋巴管内皮上的特异性受体VEGFR-3的结合得以增强〔10〕,刺激淋巴管内皮细胞生长,维持淋巴管的完整性,促进淋巴管生成,提高乳腺癌LVD水平,进而促使癌细胞通过淋巴管向周围淋巴结转移。研究结果还显示COX-2与乳腺癌LVD水平呈正相关,但与VEGF-C无明显相关,COX-2与iNOS均能提高乳腺癌的淋巴管生成水平,关于COX-2促淋巴管生成的途径有待进一步研究,但两者均有望作为抗乳腺癌淋巴管生成的靶点应用于乳腺癌的临床治疗。
1 Stacker SA,Achen MG.From anti-angiogenesis to anti-lymphangiogenesis:emerging trends in cancer therapy〔J〕.Lymphat Res Biol,2008;6(3-4):165-72.
2 Tatemichi M,Ogura T,Esumi H.Impact of inducible nitric oxide synthase gene on tumor progression〔J〕.Eur J Cancer Prev,2009;18(1):1-8.
3 Hiraku Y,Kawanishi S,Ichinose T,et al.The role of iNOS-mediated DNA damage in infection-and asbestos-induced carcinogenesis〔J〕.Ann N Y Acad Sci,2010;1203(1):15-22.
4 Urakawa H,Nishida Y,Naruse T,et al.Cyclooxygenase-2 overexpression predicts poor survival in patients with high-grade extremity osteosarcoma:a pilot study〔J〕.Clin Orthop Relat Res,2009;467(11):2932-8.
5 Wu WK,Sung JJ,Lee CW,et al.Cyclooxygenase-2 in tumorigenesis of gastrointestinal cancers:an update on the molecular mechanisms〔J〕.Cancer Lett,2010;295(1):7-16.
6 Meyer JS,Alvarez C,Milikowski C,et al.Breast carcinoma malignancy grading by Bloom-Richardson system vs proliferation index:reproducibility of grade and advantages of proliferation index〔J〕.Mod Pathol,2005;18(8):1067-78.
7 Schoppmann SF,Bayer G,Aumayr K,et al.Prognostic value of lymphangiogenesis and lymphovascular invasion in invasive breast cancer〔J〕.Ann Surg,2004;240(2):306-12.
8 Kato T,Prevo R,Steers G,et al.A quantitative analysis of lymphatic vessels in human breast cancer,based on LYVE-1 immunoreactivity〔J〕.Br J Cancer,2005;93(10):1168-74.
9 Voss M,Steidler A,Grobholz R,et al.The lymphatic system and its specific growth factor vascular endothelial growth factor C in kidney tissue and in renal cell carcinoma〔J〕.BJU Int,2009;104(1):94-9.
10 Matsuura M,Onimaru M,Yonemitsu Y,et al.Autocrine loop between vascular endothelial growth factor(VEGF)-C and VEGF receptor-3 positively regulates tumor-associated lymphangiogenesis in oral squamoid cancer cells〔J〕.Am J Pathol,2009;175(4):1709-21.

