枸杞菊花水提液对老年大鼠晶状体抗氧化能力的影响
章海风 陈 敏 路新国 燕宪涛 丁连翠 吴志嵩 (扬州大学营养系,江苏 扬州 225127)
寻求有效的抗氧化物质拮抗晶状体的氧化损伤,延缓晶状体的氧化损伤的发生、发展,将成为预防年龄相关性视功能障碍的重要手段之一。根据前期的文献统计分析发现,枸杞子和菊花都具有明目,抗氧化抗衰老之功效,也是中医眼科方剂中高频用药〔1〕。我们采用自然衰老大鼠模型,研究枸杞子和菊花的混合提取液对年龄相关性晶状体氧化损伤的直接保护作用,以期为年龄相关性视功能障碍的预防和治疗提供新的途径。
1 材料与方法
1.1 样品液制备 枸杞菊花水提液制备:市售宁夏枸杞、汞菊按1∶1称重,除杂后60℃干燥箱中干燥3 h,冷却后,中药粉碎机粉碎。固液比1∶10,80℃水浴浸提3 h,过滤,滤液再加5倍蒸馏水同法浸提2 h,合并滤液,滤液于旋转蒸发仪中浓缩,最后用蒸馏水调整至0.4 g/ml,按人与大鼠用药比设置0.5(3.5倍)、1.0(7倍)、2.0 g/kg(14倍)(生药/大鼠体重)等低、中、高三个剂量组。4℃保存。明目地黄丸样品液制备:明目地黄丸粉碎后按人用药量7倍加入双蒸水,80℃水浴溶解2 h,作为阳性对照组。4℃保存。
1.2 试剂与仪器 丙二醛(MDA)、过氧化氢酶(CAT)、总抗氧化能力(T-AOC)及蛋白定量(双缩脲法)测试盒均购自南京建成生物工程研究所;宁夏枸杞、贡菊、明目地黄丸购自扬州市四望亭大药房;冰醋酸、无水乙醇等试剂购自扬州双博化工公司;电子天平,赛多利斯科学仪器(北京)有限公司;DGF30/7-IA型电热鼓风干燥箱,南京实验仪器厂;中草药粉碎机,天津市泰斯特仪器有限公司;优普超纯水系统;数显恒温水浴箱HH-8,国华电器有限公司;旋转蒸发器RE-52B,上海亚荣生化仪器厂;超速高速冷冻离心机,贝克曼库尔特公司;低速离心机;Spectrumlab 755s紫外可见分光光度计,上海棱光技术有限公司;PHS-3C PH计,上海精科仪器有限公司;裂隙灯显微镜(江苏省苏北人民医院眼科中心)。
1.3 动物分组及实验方案 56只清洁级SD大鼠〔许可证号为SCXK(苏)2008-0004〕,其中3~4个月龄大鼠16只,雌雄各半,为青年对照组;20~22个月龄老年大鼠40只,雌雄各半。裂隙灯显微镜下排除眼疾个体,适应性饲养1 w后采用随机分组法分成7组,每组8只,雌雄各半:青年中剂量组,青年阴性对照组(生理盐水),老年阴性对照组(生理盐水),干预低、中、高剂量组,明目地黄丸组。饲养于扬州大学医学院动物房。饲养条件:环境温度22℃ ~27℃,相对湿度50% ~70%,昼夜明暗交替时间12 h/12 h。每组动物喂以标准饲料。采用灌胃给药方式。给药剂量1 ml/100 g(体重),每天上午给药1次,共30 d。30 d后对所有大鼠进行裂隙灯显微镜检查,拉颈椎处死大鼠,立即摘取眼球,分离晶状体,称重后加入9倍预冷生理盐水匀浆,所有操作都在冰浴上进行。匀浆液平均分成两份,一份用于CAT、MDA测定,一份低温离心后,收集上清液,用于TAOC测定。
1.4 方法 晶状体蛋白含量测定采用双缩脲法,晶体T-AOC测定采用比色法,MDA测定采用硫代巴比妥酸法,CAT测定采用紫外分光法,所有操作严格按照试剂盒说明书进行。
1.5 统计学方法 采用SPSS 17.0软件,多组均数进行方差齐性检验和单因素方差分析和两两比较采用Scheffe法。
2 结果
2.1 一般情况 30 d饲养后,各组进食量和体重均无显著差异(P>0.05),但从外表观察,干预高剂量组和明目地黄丸组的大鼠皮毛较为稀疏,无光泽,个别大鼠出现脱毛现象,可能是年龄较大的个体差异。
2.2 各组大鼠晶状体MDA含量 各组大鼠晶状体MDA含量见表1。老年组大鼠晶状体MDA含量明显高于青年组;青年中剂量用药组MDA含量明显低于青年阴性对照组(P<0.01);与老年阴性对照组相比,老年干预低、中、高剂量组和明目地黄丸组的MDA含量明显降低(P<0.01),三个剂量组之间的MDA含量梯度差异显著(P<0.01),但干预高剂量组与明目地黄丸组无显著差异(P>0.05)。见表1。
2.3 各组大鼠晶状体T-AOC、CAT活性 青年药物组T-AOC、CAT活性显高于青年空白组(P<0.01);与老年阴性对照组相比,老年低、中、高剂量组和阳性对照组的T-AOC和CAT活性显著升高(P<0.01);与低剂量组相比,中、高剂量组的T-AOC、CAT活性明显较高(P<0.00),但中、高剂量组和阳性对照组之间无显著差异(P>0.05);青年空白组T-AOC、CAT活力明显高于老年阴性对照组(P<0.01)。见表1。
表1 各组MDA、T-AOC、CAT含量比较( s,n=8)
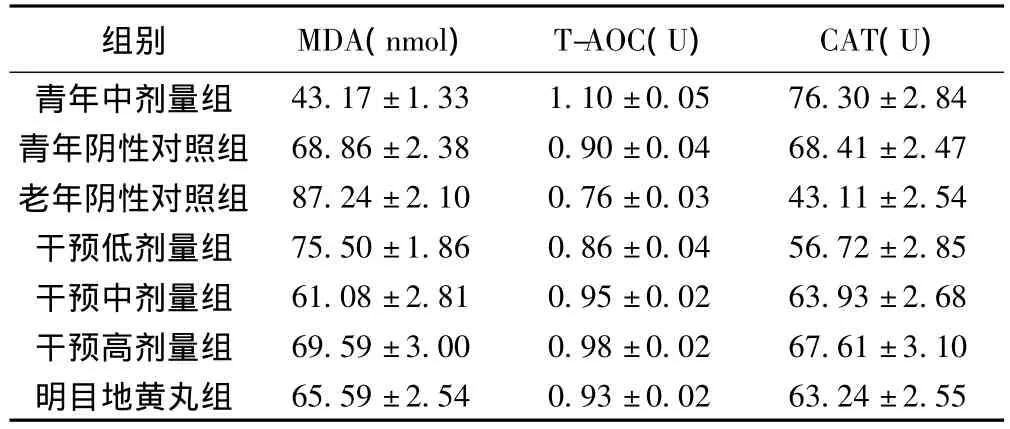
表1 各组MDA、T-AOC、CAT含量比较( s,n=8)
组别 MDA(nmol)T-AOC(U)CAT(U)43.17±1.33 1.10±0.05 76.30±2.84青年阴性对照组 68.86±2.38 0.90±0.04 68.41±2.47老年阴性对照组 87.24±2.10 0.76±0.03 43.11±2.54干预低剂量组 75.50±1.86 0.86±0.04 56.72±2.85干预中剂量组 61.08±2.81 0.95±0.02 63.93±2.68干预高剂量组 69.59±3.00 0.98±0.02 67.61±3.10明目地黄丸组青年中剂量组65.59±2.54 0.93±0.02 63.24±2.55
3 讨论
老龄生物可随年龄递增而出现全身各器官系统的退行性改变,其机制之一是老龄生物组织和细胞的抗氧化能力下降。近年研究表明白内障等眼疾的发生与脂质过氧化物有关,氧自由基诱发的脂质过氧化物是晶状体衰老的病理基础。机体受氧化损伤与否,不仅取决于致病因素的强弱,更重要的是机体内是否存在完善的抗氧化防御机制。眼组织中也存在抗氧化防御系统,如超氧化物歧化酶(SOD)、CAT、过氧化物酶等。这些抗氧化物质可维持着晶状体的透明,延缓白内障的发生发展。但当长期与光接触、衰老等原因引起晶状体组织抗氧化防御功能不足时,则可能发生氧化损伤,进而形成白内障。
MDA是自由基攻击生物膜中多不饱和脂肪酸引发脂质过氧化作用所形成的脂质过氧物。MDA的量可反映机体内脂质过氧化的程度,间接反映细胞损伤的程度。同时,脂质过氧化产物又可进一步引起细胞损伤。研究发现,大鼠晶状体MDA含量自出生后1个月起处于低水平上升过程,3个月至12个月基本稳定,自12个月开始急剧上升,表明晶状体氧化损伤婴幼儿、少年、青中年程度大致相当,自中年起始氧化损伤进行性急剧加重〔2〕。Yildirim等〔3〕测定30个AMD患者与60个健康者红细胞的CAT活性和MDA血浆水平,AMD患者CAT活性显著低于健康者,MDA水平高于健康者,与本实验结果相一致。有资料显示,枸杞及菊花中有效成分能有效清除自由基,减少脂质过氧化物的形成。如枸杞中的枸杞多糖具有调节机体免疫、抗肿瘤等功能〔4~6〕。菊花中所含黄酮类化合物,如槲皮素、芹菜素、木樨草素、芦丁等具有较强的抗氧化防衰老的功效〔7〕。单铁英等〔8〕研究认为枸杞多糖可有效抑制其表达,显著改善实验性食管癌大鼠细胞免疫功能障碍。胡春等〔9〕也研究发现,菊花提取物对生物膜的超氧阴离子自由基损伤具有明显保护作用,主要是通过直接进入细胞膜的甘油酯后而起保护作用。汪朝阳等〔10〕研究表明枸杞多糖对氧化损伤大鼠晶状体上皮细胞的凋亡有抑制作用。祁明信等〔11〕研究发现菊花可能通过Ca2+、cAMP和cGMP信号传导系统及其相互作用调节生物学效应,防护晶状体上皮细胞氧化损伤及减少细胞凋亡的细胞和分子生物学机制。本实验结果显示,枸杞菊花提取液组大鼠鼠晶状体中MDA含量显著降低,充分说明了该提取成分具有拮抗过氧化损伤的作用,可有效延缓老年晶状体的氧化损伤。
自由基是生物体正常代谢过程中不断产生的损害自身的毒性产物。其中氧自由基可以引发脂类发生过氧化反应,但由于正常机体中存在着天然的自由基清除剂和抗氧化系统,使自由基的产生和清除处于动态平衡,保持机体不受自由基的损害。如细胞内存在清除氧自由基的体系,即在需氧代谢细胞中都含有CAT,它可能促使超氧化物阴离子变为H2O2和氧分子,清除氧自由基保护细胞免受损伤。通过试验看出,枸杞菊花提取液可以提高大鼠晶状体中CAT的活性,同时能够防止膜脂的过氧化,2.0 g/kg的枸杞菊花提取液对大鼠晶状体中T-AOC活力有显著提高作用,说明该提取液对老年大鼠的晶状体过氧化损伤有一定的预防作用。
本实验结果表明枸杞和菊花的水提液能通过降低过氧化物(MDA)水平,提高CAT活性和T-AOC活性来增强晶状体的抗氧化系统,可延缓晶状体老化损伤,不仅可减慢晶状体弹性的下降,也可预防白内障的发生。
1 章海风,陆红梅,路新国.治疗视疲劳方用药特点探析〔J〕.中国中医基础医学杂志,2011;17(2):1368-70.
2 卢 艳,赵可浩,李 林,等.增龄大鼠晶状体老化过程中脂质过氧化及抗氧化能力变化〔J〕.眼科新进展,2008;28(4):241-4.
3 Yildirim O,Ates NA,Tamer L,et al.Changes in antioxidant enzyme activity and malondialdehyde level in patients with age-related macular degeneration〔J〕.Ophthalmologica,2004;218:202-6.
4 Gon GH,Shen P,Jin I,et al.Therapeutic effects of Lyciunl barbarum polysaccharide(LBP)on irradiation or chemotherapy-induced myelosuppressive mice〔J〕.Cancer Biother Radiopharm,2007;20(2):155.
5 Gan I,Zhan GSH,Yan GX,et al.Immunomodulation and antitumor activity by a polysaccharide-protein complex from lycium barbarum〔J〕.Int Immunol Pharmacol,2006;4(4):563.
6 古 赛,蒋小黎.枸杞多糖治疗酒精性脂肪肝大鼠的实验研究〔J〕.重庆医学,2007;36(1):60.
7 张晓媛,段立华,赵 丁.菊花化学成分及药理作用的研究〔J〕.时珍国医国药,2008;19(7):1702-4.
8 单铁英,乔俊红,杨书良,等.枸杞多糖对实验性食管癌大鼠外周血细胞免疫功能的影响〔J〕.时珍国医国药,2010;21(4):1016-7.
9 胡 春,丁霄霖.菊花提取物对人红细胞膜的保护作用研究〔J〕.食品科学,1996;17(2):7.
10 汪朝阳,黄秀榕,祁明信,等.枸杞多糖对氧化损伤大鼠晶状体上皮细胞凋亡的调控〔J〕.眼视光学杂志,2003;5(2):69-71.
11 祁明信,黄秀榕,严 京,等.菊花防护晶状体上皮细胞氧化损伤及信号转导机制的实验研究〔J〕.福建中医学院学报,2008;18(6):26-9.

