啤酒中胺类物质的系统分析
郑金珠,刘翻,孙元社,唐涛,张维冰,李彤
(1.齐齐哈尔大学, 黑龙江 齐齐哈尔 161000; 2.上海市功能性材料化学重点实验室,华东理工大学, 上海 200237; 3.大连依利特分析仪器有限公司, 辽宁 大连 116023;4.辽宁大连依利特分析仪器工程技术研究中心, 辽宁 大连 116023)
随着人们物质生活水平的提高,啤酒已经成为餐桌上不可缺少的一部分,其中的胺类物质与其质量密切相关[1],故啤酒中胺类物质的种类和数量对于区分不同种类不同品牌的啤酒以及辨别假冒伪劣产品具有重要的参考价值。啤酒中还可能有含强致癌性的亚硝胺类化合物[2,3],控制其在啤酒中的含量对人们的身体健康具有重要意义。
胺类物质的检测方法包括薄层色谱法、离子色谱法、毛细管电泳、电化学法、气相色谱法、高效液相色谱法等[4,5],卓平等人[6]采用高效液相色谱法同时测定水产品中10种生物胺,检测限为μg/g。但啤酒中许多胺类物质含量极低,常规方法很难进行直接分离和检测,激光诱导荧光检测器(LIFD)作为目前灵敏度最高的检测技术之一[7],在痕量物质检测方面具有无可比拟的优势[8],刘春凤等人[9]采用FITC衍生激光诱导荧光法与毛细管电泳偶联法检测啤酒中的14种生物胺,结果显示不同种类的啤酒中生物胺的种类和含量均不相同。
本文以FITC为衍生试剂,对啤酒进行衍生,以HPLC-LIFD系统对啤酒中胺类物质进行分析,同时采用真空低温蒸馏结合GC-FID法对啤酒中4种不能用FITC衍生的挥发性的亚硝胺类化合物进行了测定,发展了啤酒中胺类物质的高灵敏度和高选择性的分析方法,并使用该方法考察了市场上多种啤酒中胺类物质种类和含量的差异。
1 实验部分
1.1 主要仪器与试剂
仪器:激光诱导荧光检测器(大连依利特分析仪器有限公司);GC7890Ⅱ气相色谱仪配备氢火焰离子化检测器(上海天美科学仪器有限公司)。
试剂:异硫氰酸荧光素(FITC )(98%,Sigma);N-亚硝基二乙胺(NDEA,98.5%)、N-亚硝基二丁胺(NDBA,98.5%)、N-亚硝基哌啶( NPIP,99%)和N-亚硝胺吡咯烷(NPYR,98.5%)均购自Fluka公司;实验用水均为milli-Q过滤超纯水;啤酒样品均于市场购买。
1.2 样品前处理
1.2.1 衍生过程(HPLC-LIFD法)
量取5μmoL/L的FITC 60μL,加入340μL 50mmol/L磷酸钠缓冲溶剂(pH=11),然后与100μL啤酒样品混合均匀,避光衍生6h后加入500μL水,直接进样分析。
1.2.2 真空低温蒸馏(GC-FID法)
参照GB/T 5009.26-2003[10]中真空低温蒸馏法,同时加大前处理量后对啤酒中亚硝胺类物质进行提取和富集:量取150mL啤酒,超声脱气后加入8mL氢氧化钠溶液(1mol/L),在真空度约为53KPa下蒸馏至约10mL,再将真空度调至约95KPa,直至近干。然后往馏出液中加入8mL盐酸(0.1mol/L)并混匀,用40mL二氯甲烷萃取三次,合并120mL萃取液用无水硫酸钠除水后移入旋转蒸发仪中,在(37±2)℃水浴下旋蒸浓缩至约5mL,再氮吹定容至0.5mL备用。
1.3 色谱条件
1.3.1 HPLC-LIFD
色谱柱:ODS2 5μm(4.6mm×150mm);流动相:A10mmoL/L乙酸铵(pH=8.0~8.5),B乙腈,梯度洗脱程序:0~10min,6%~15%B;15~25min,15%~17% B;15~25min,17%~40%B;进样量20μL,室温下分析。
1.3.2 GC-FID
采用TM-1毛细管色谱柱(0.53 mm×30m×0.1μ m),初温60℃,保持3min,10℃/min升至280℃保持5min;进样口温度250℃; 检测器温度250℃;载气:氮气,流速8mL/min;进样量1μL。
2 结果与分析
2.1 HPLC-LIFD分析
2.1.1 方法建立
FITC衍生胺类物质时,一般需12h以上[11],而Ming Du等人[12]研究发现FITC衍生生物胺时6h即达到平衡。以某品牌啤酒A为样品,考察了FITC衍生时间分别为6、12、24、36、60h样品在选定色谱条件下出峰情况。结果显示衍生6h色谱峰峰数最多,而峰高变化无规律。综合考虑出峰数量与峰高,选择衍生时间为6h。
为得到更多样品信息,各色谱峰尽量在整个色谱图中分布均匀,对梯度条件进行了优化,在优化条件下以啤酒A为样品连续进样5次,考察方法稳定性,结果表明该方法重复性良好。
2.1.2 实际啤酒样品分析
市购11种不同品牌和同一品牌不同系列的啤酒样品进行检测,用FITC按照1.2.1方法进行衍生后,按照优化后的色谱条件进样分析,对啤酒中胺类物质的种类和相对含量进行考察,以峰高值1mV为积分阈值,计算样品色谱图中色谱峰数量。
实验结果表明,11种啤酒样品色谱峰在色谱图中的分布具有一定趋势:在5min~10min和15~23min大部分胺类物质的含量较低,10min~15min之间含量较高。同时不同啤酒样品色谱图中色谱峰数和峰高值差异较大。
图1为某品牌啤酒B的四个系列分析色谱图,从图中可以看出,样品B1-B4出峰数量和峰高均有一定差异。四种系列啤酒的出峰数分别为44、42、40和47。样品B1的1号色谱峰和2号色谱峰高值远高于其它三种,而在10min~15min样品B2色谱峰峰高值高于其它两种。
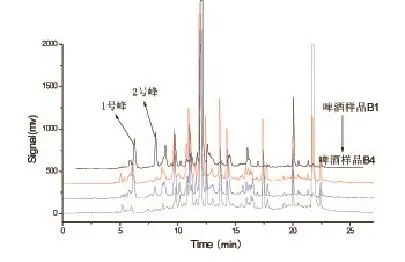
图1 某品牌啤酒样品B 4种系列检测色谱图(色谱条件见1.3.1)
图2为4种不同品牌啤酒C-F,色谱峰数分别为51、38、38和48,样品D的1号峰高值高于其它三种。而在10~20min之间,样品C的峰高值高于其它三种。
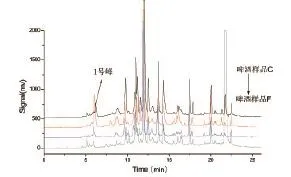
图2 4种不同品牌啤酒检测结果(色谱条件见1.3.1)

图3 3种不同品牌啤酒检测结果(色谱条件见1.3.1)
图3为3种不同品牌啤酒样品G-I,色谱峰峰数分别为40、49和53,其中样品I的1号峰和2号峰峰高值远低于其它两种,而在10~15min之间样品H色谱峰峰高值远高于其它两种。
2.2 GC-FID分析N-亚硝基类化合物
2.2.1 方法建立
N-亚硝基类化合物具有强致癌性,不能用FITC衍生[13],其分析一般使用灵敏度较高的热能分析仪、质谱或氮磷检测器[14-16]。本文采用灵敏度较低但使用更普遍的FID检测器。
在1.3.2色谱条件下,NDEA、NDBA、NPIP和NPYR4种化合物在14min内全部出峰,且与杂质达到基线分离。同时以标准品对该方法进行了论证。结果表明4种化合物在0.005-0.1mg/mL范围内具有良好的线性关系,方法检出限达到μg/L。且方法稳定,加标浓度为0.05mg/mL、0.08mg/mL、0.1mg/mL时,4种物质回收率均在70~90%之间;加标浓度为0.08mg/mL时,平行5次实验,NDEA、NDBA、NPIP、NPYR回收率RSD值分别为3.50%、2.27%、5.72%和7.56%。
2.2.2 实际样品分析
以上述方法对超市购买3种不同品牌啤酒样品进行分析,结果显示(见图4),3种啤酒中NPIP和NPYR均未检出,样品K中NDEA及NDBA的含量分别为20.00μg/L和29.55μg/L,样品J含有22.01μg/L的NDEA。
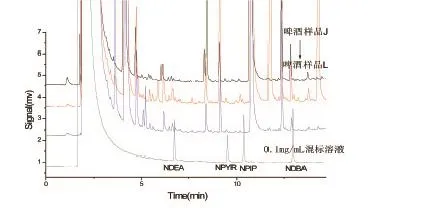
图3 3啤酒样品中4种亚硝胺测定结果(色谱条件见1.3.2)
3 结 论
使用HPLC-LIFD与GC-FID结合,发展了一种啤酒中胺类物质的系统分析方法。以FITC为衍生试剂,对啤酒中含有-NH2和-NH-基团的胺类物质直接进行衍生,HPLC-LIFD分析,对市场上11种啤酒进行了分析。结果表明不同品牌啤酒中胺类物质的种类、数量及含量均存在一定差异,以峰高值1mV为积分阈值,出峰数从38至53之间不等。同时使用真空蒸馏GC-FID法对啤酒中4种具有特殊结构的亚硝胺类物质进行了分析,综合评价啤酒总胺类物质的组成,在分析的3种啤酒其中两种中检测到微量亚硝胺类物质。该方法灵敏度高,稳定性高,适用于啤酒及其它食品中胺类物质的分析,特别是痕量胺类物质的分析。对于食品中胺类物质的研究、假冒伪劣产品的辨别和产品质量监控具有重要的参考价值。
[1]韩小江,张嘉捷,朱岩。浙江大学学报,2009,36(6): 687
[2]Andrade R, Reyes F G R, Rath S. Food Chemistry, 2005, 91: 173
[3]Yurchenko S, Molder U. Food Chemistry, 2007,100: 1713
[4]张剑,钟其顶,熊正河等。啤酒科技,2010,7: 80-85
[5]Onal A. Food Chemistry, 2007, 103: 1475
[6]卓平,刘辰,陈迪等,分析测试学报,2006,25(4): 59
[7]Ramsay L M, Dickerson J A, Dada O, et al. Anal Chem, 2009,81(5): 1741
[8]Katzenmeyer J B, Eddy C V, Arriaga E A. Anal Chem,201082(19): 8113
[9]刘春凤,李崎,啤酒科技,2007,113: 58-61
[10]GB/T 5009,26-2003. 食品中N-亚硝胺类的测定方法
[11]翟其曙,汤晓庆,胡效亚等,化学进展,2006,18(6): 791
[12]Du M, Flanigan V, Ma Y. Electrophoresis, 2004, 25: 1497- 1498
[13]幸苑娜,王欣,陈泽勇等,分析测试学报,2011,30(5):503-504
[14]陶燕飞,黄红林,张桃芝,分析测试学报,2003,5(22):82- 83
[15]Grebel J E, Young C C, Suffet(Mel)I H. Journal of Chromatography A, 2006, 1117: 11
[16]SÁNCHEZ B J, BALLESTEROS E, GALLEGO M. Agric Food Chem. 2007, 55: 9758

