二维应变超声心动图评价干细胞移植对心肌梗死大鼠左心室局部收缩功能的影响
廖书生 阮琴韵 林美燕 鄢 磊 苏津自 林茂海
心肌梗死后功能心肌细胞的丢失和瘢痕组织形成最终导致心功能不全。骨髓间充质干细胞(Mesenchymal stem cells,MSCs)移植技术可使干细胞在瘢痕组织内分化为有功能的心肌细胞,从而可能改善心脏收缩功能。精确评价局部心肌功能的改善是心肌梗死模型MSCs移植研究的关键之一。源于斑点追踪技术的二维应变超声心动图(2-dimensional strain echocardiography,2DSE)使局部心肌功能的精确评价成为可能[1,2]。本研究应用2DSE观察 MSCs移植后局部心肌功能的变化,旨在探讨该技术在大鼠心肌梗死模型MSCs移植研究中的应用价值。
资料与方法
1.实验动物及分组:选用40只雄性SD大鼠,8~10周龄,体质量250~300g。采用随机分组方法分为心肌梗死组14只、MSCs治疗组16只、空白对照组10只。心肌梗死组和MSCs治疗组建立心肌梗死模型,对照组只进行假手术。
2.超声仪器:采用GE VIVID7 Dimension彩色多普勒超声诊断仪,配备10S探头(频率5.4~11.8MHz)、二维应变分析软件(EchoPAC 7.0)。
3.MSCs的分离、纯化、培养、鉴定及DAPI标记:取SD大鼠股骨和胫骨,用DMEM培养液冲洗骨髓腔获取骨髓干细胞,利用Percoll密度梯度离心法分离纯化 MSCs,悬浮于含10%胎牛血清的DMEM培养液内,置于37℃、含5%的CO2的饱和湿度培养箱内静置培养,细胞长满时用0.05%的胰酶消化后传代。采用流式细胞仪对MSCs细胞进行鉴定。取3~5代传代的MSCs,DAPI标记后备移值。
4.动物模型建立:采用改良的 Pfeffer[3]方法结扎大鼠左冠状动脉前降支制作心肌梗死模型,以结扎后左室前壁颜色变白和心电图相应导联出现ST段抬高作为判断模型成功的标准。MSCs治疗组于心肌梗死模型构建后15 min,在缺血部位心肌直接注射DAPI标记好的传代MSCs(100微升/只);心肌梗死组和空白对照组在相应部位只注射无胎牛血清DMEM培养基(100微升/只)。
5.超声心动图检查:分别于术前1天、术后1周和术后4周进行超声心动图检查,采用GE VIVID7 Dimension彩色多普勒超声诊断仪,选用10S高频探头,经胸获取大鼠左室乳头肌水平短轴切面,连续记录3个完整心动周期的二维动态图像并存入机载的硬盘,深度为2~3cm,帧频>200帧/秒。于左室乳头肌水平短轴切面测量左心室舒张末期和收缩末期内径(LVIDd、LVIDs),计算舒张末期和收缩末期左心室容积(LVEDV、LVESV)、左心室短轴缩短率(FS),应用Teichholtz公式计算左心室射血分数(LVEF)。将存储的图像导入EchoPAC 7.0工作站进行分析,采用ASE推荐的16节段法,获取左心室短轴乳头肌水平前壁的收缩期峰值径向应变和应变率(SR、SrR)、周向应变和应变率(SC、SrC)。
6.心导管整体心功能指标测定:各组大鼠在术后4周超声检查后24h内行心导管检查,实时记录心电图和压力图,测量以下参数:主动脉收缩压(SBP)、舒张压(DBP),左心室收缩末压(LVSP)和舒张末压(LVEDP),左心室压力最大上升和下降速率(±dp/dtmax),心率(HR)。
7.组织病理学检查与免疫组化检测:移植后4周,超声及心导管检查后取出心脏标本,在原梗塞部位切取心肌组织,一部分标本行冷冻切片(厚约3~5μm),用荧光显微镜观察移植的DAPI标记的细胞分布;另一部分标本做石蜡切片,行免疫组织化学染色。
8.统计学方法:采用SPSS 11.5统计软件进行数据的统用配对t检验,多组均数比较采用方差分析,p<0.05为差异有统计学意义。
结 果
1.MSCs的培养、鉴定及DAPI标记结果:经过培养的MSCs贴壁生长,传代3代后细胞呈均一的长梭形,呈放射状或栅栏样生长。流式细胞仪检测细胞均一性好、纯度高,其中 CD31、CD34、CD45表达阴性,而CD29、CD90表达阳性。MSCs细胞DAPI标记24h后,用荧光显微镜观察MSCs的胞核发出明亮蓝色荧光。
2.超声心动图结果:(1)常规超声心动图指标:与术前24h相比,术后1周、术后4周心肌梗死组和MSCs治疗组左心室明显增大(P <0.05),LVEF、FS显著降低(p<0.05);术后4周,MSCs治疗组LVEF、FS较心肌梗死组略高,但差异无统计学意义(P>0.05)(表1)。(2)二维应变超声心动图:与术前24h相比,术后1周、术后4周心肌梗死组和MSCs治疗组左心室前壁2DSE应变及应变率指标(SR、SrR、SC、SrC)均显著性降低(P <0.05);术后4周,MSCs治疗组的径向应变与应变率(SR、SrR)较术后1周增高,且高于心肌梗死组术后4周相应指标,差异均有统计学意义(p<0.05);但术后4周心肌梗死组和MSCs治疗组的周向应变与应变率(SC、SrC)差异无统计学意义(P>0.05)。对照组2DSE各指标术后1周、术后4周与术前24h均无显著性差异(表2、图1)。
表1 大鼠常规超声心动图指标
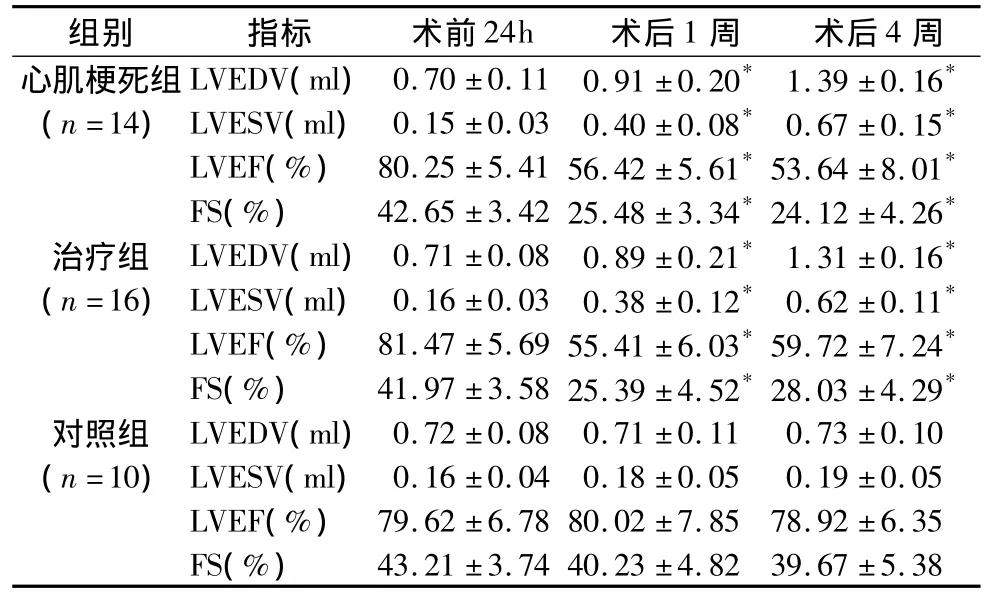
表1 大鼠常规超声心动图指标
与术前24h相比,*p<0.05;LVEDV.左心室舒张末期容积;LVESV.左心室收缩末期容积;LVEF.左心室射血分数;FS.左心室短轴缩短率
组别 指标 术前24h 术后1周 术后4周心肌梗死组LVEDV(ml)0.70 ±0.11 0.91 ±0.20*1.39 ±0.16*43.21 ±3.74 40.23 ±4.82 39.67 ±5.38(n=14)LVESV(ml)0.15 ±0.03 0.40 ±0.08*0.67 ±0.15*LVEF(%) 80.25 ±5.41 56.42 ±5.61*53.64 ±8.01*FS(%) 42.65 ±3.42 25.48 ±3.34*24.12 ±4.26*治疗组 LVEDV(ml)0.71 ±0.08 0.89 ±0.21*1.31 ±0.16*(n=16)LVESV(ml)0.16 ±0.03 0.38 ±0.12*0.62 ±0.11*LVEF(%) 81.47 ±5.69 55.41 ±6.03*59.72 ±7.24*FS(%) 41.97 ±3.58 25.39 ±4.52*28.03 ±4.29*对照组 LVEDV(ml)0.72 ±0.08 0.71 ±0.11 0.73 ±0.10(n=10)LVESV(ml)0.16 ±0.04 0.18 ±0.05 0.19 ±0.05 LVEF(%) 79.62 ±6.78 80.02 ±7.85 78.92 ±6.35 FS(%)
表2 3组大鼠不同阶段左心室前壁2DSE指标
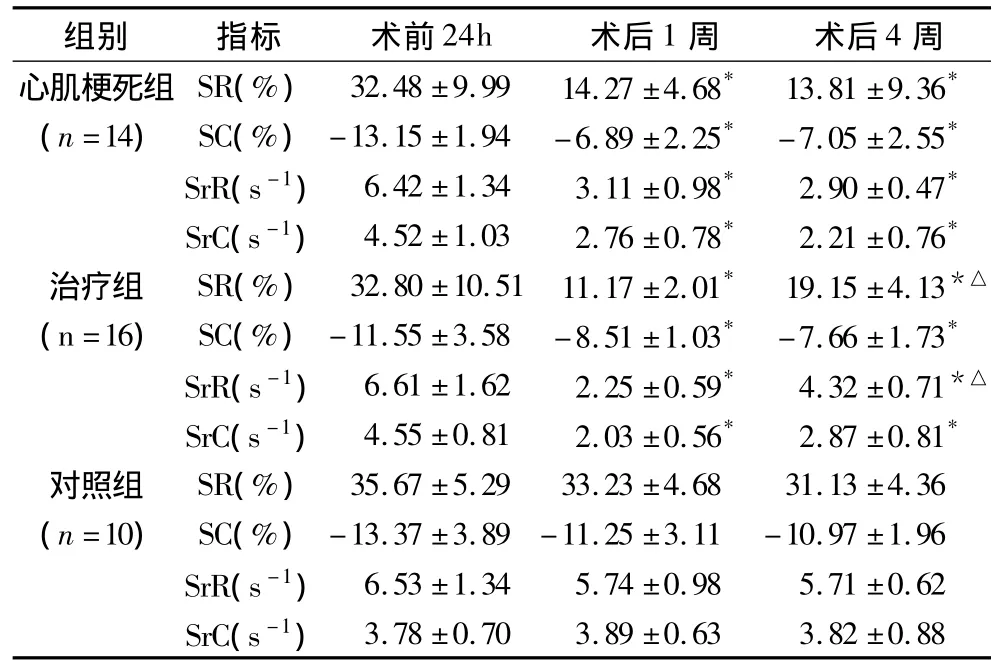
表2 3组大鼠不同阶段左心室前壁2DSE指标
术后1周、术后4周与术前相比,*p<0.05;术后4周与术后1周相比,△p<0.05;SR.收缩期峰值径向应变;SC.收缩期峰值周向应变;SrR.收缩期峰值径向应变率;SrC.收缩期峰值周向应变率
组别 指标 术前24h 术后1周 术后4周心肌梗死组 SR(%) 32.48 ±9.99 14.27 ±4.68* 13.81 ±9.36*3.78 ±0.70 3.89 ±0.63 3.82 ±0.88(n=14) SC(%) -13.15 ±1.94 -6.89 ±2.25* -7.05 ±2.55*SrR(s-1) 6.42 ±1.34 3.11 ±0.98* 2.90 ±0.47*SrC(s-1) 4.52 ±1.03 2.76 ±0.78* 2.21 ±0.76*治疗组 SR(%) 32.80 ±10.51 11.17 ±2.01* 19.15 ±4.13*△(n=16) SC(%) -11.55 ±3.58 -8.51 ±1.03* -7.66 ±1.73*SrR(s-1) 6.61 ±1.62 2.25 ±0.59* 4.32 ±0.71*△SrC(s-1) 4.55 ±0.81 2.03 ±0.56* 2.87 ±0.81*对照组 SR(%) 35.67 ±5.29 33.23 ±4.68 31.13 ±4.36(n=10) SC(%) -13.37 ±3.89 -11.25 ±3.11 -10.97 ±1.96 SrR(s-1) 6.53 ±1.34 5.74 ±0.98 5.71 ±0.62 SrC(s-1)
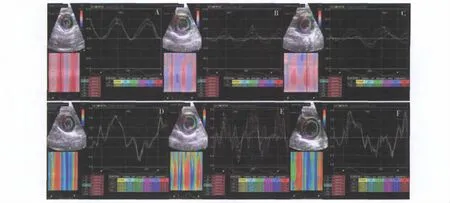
图1 MSCs治疗组术前、术后1周和术后4周的典型2DSE曲线A、B,C、D和E、F分别为术前、术后1周、术后4周的2DSE径向应变、径向应变率曲线;B、E显示术后1周径向应变和应变率较术前显著降低;C、F显示术后4周径向应变和应变率较术后1周增高
3.心导管左心功能测定结果:各组心率差异无统计学意义。与对照组比较,治疗组和心肌梗死组的左心室血流动力学指标LVSP、+dp/dtmax、-dp/dtmax均显著降低(P均 <0.05),LVEDP显著增高(p<0.05);与心肌梗死组相比,治疗组LVSP、+dp/dtmax显著增高(P均<0.05),而LVEDP显著降低(p<0.05)(表3)。
表3 各组的左心室血流动力学指标比较

表3 各组的左心室血流动力学指标比较
心肌梗死组、治疗组与对照组相比,#p<0.05;治疗组与心肌梗死组相比,#p<0.05;LVSP:左心室收缩末压;LVEDP:左心室舒张末压;+dp/dtmax:左心室压力最大上升速率;-dp/dtmax:左心室压力最大下降速率
组别 n LVSP(mmHg) LVEDP(mmHg) +dp/dtmax(mmHg/s) -dp/dtmax(mmHg/s) HR(次/分)心肌梗死组 14 72.37 ±1.06# 28.35 ±3.51# 1732.57 ±192.35# -1571.08 ±252.82#1956.58 ±163.24 463 ±25 433±16治疗组 16 83.43 ±8.26#* 22.54 ±3.34#* 2113.86 ±246.44#* -1688.32 ±208.09# 451 ±14对照组 10 112.34 ±10.23 15.67±2.38 2587.29±178.39 -
4.组织学结果:移植4周后,MSCs治疗组心肌组织切片显示心肌梗死区可见DAPI标记阳性的细胞,呈岛状或散在分布,心肌梗死组和空白对照组无DAPI标记阳性的细胞。治疗组DAPI核染色阳性的部分移植细胞可见肌钙蛋白(Tn-I)表达阳性(图2)。
讨 论
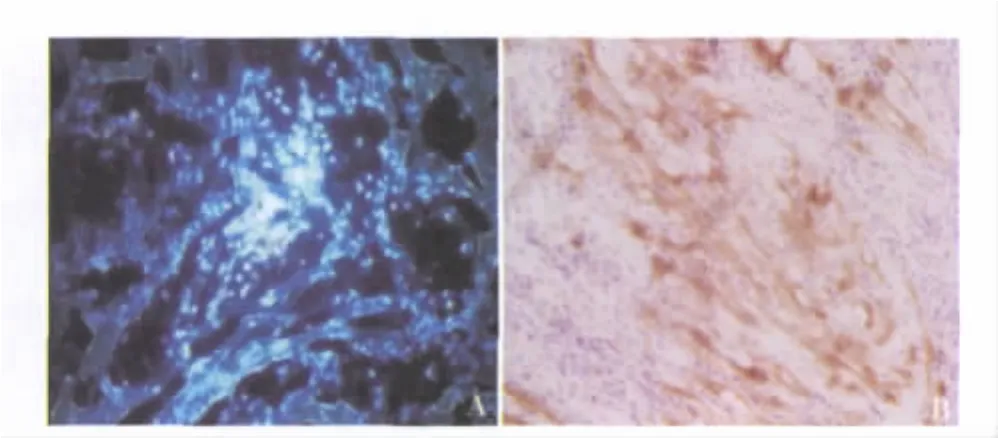
图2 MSCs治疗组大鼠心肌组织学检查(×200)
关于干细胞移植后心功能改善的确切机制目前还不清楚。一些学者认为,心肌梗死后心肌组织的微环境可以诱导干细胞的迁移和分化,周围心肌微环境可提供干细胞特定分化所需的成心肌生长因子,促使干细胞分化成心肌细胞,即所谓的“环境诱导分化”理论[4]。本研究发现,注射 MSCs后心肌梗死区有DAPI标记阳性的MSCs归巢,并且向心肌样细胞转化(DAPI标记阳性的移植细胞有肌钙蛋白表达)。多数学者认为[5,6],在各种因子趋化下 MSCs归巢至梗死心肌周边,分化为心肌样细胞和血管内皮细胞,心肌样细胞具有肌纤维的收缩性,与宿主心肌细胞形成偶联而同步收缩,增强了心肌的收缩力,同时新生血管增加了梗死局部血流,从而达到改善心脏功能。心导管检测结果也显示,MSCs治疗组的血流动力学各指标比心肌梗死组明显改善,包括左心室收缩压、最大上升速率的升高和舒张末压明显降低,表明MSCs移植可以改善左心室整体收缩功能。近期研究[7]证实MSCs在体内特定微环境下可分化为心肌细胞和血管内皮细胞并能有效改善心功能,Berry等[8]人也发现将MSCs移植到大鼠梗死心肌可以改善心肌重塑、增强心肌收缩。
超声心动图是无创监测MSCs移植后心功能变化的主要手段之一,既往着重于左心室整体功能(如LVEF)的评价[9]。但局部心肌功能可能比整体心室功能更直接地反映MSCs移植后心肌功能的改善,2DSE技术的问世使小动物模型局部心肌功能的评价成为可能[10,11]。本研究结果表明,术后1周心肌梗死组和MSCs治疗组左心室前壁2DSE的应变及应变率指标均较术前显著性降低,但两组间各指标差异无统计学意义。这可能是MSCs在移植1周后尚未分化为有功能的心肌细胞,Toma等[12]研究也表明MSCs移植1周之后部分移植细胞才开始出现与宿主心肌相似的形态结构。术后4周,MSCs治疗组左心室前壁峰值径向应变和应变率(SR、SrR)较术后1周增高,且高于心肌梗死组术后4周相应指标,差异均有统计学意义(p<0.05),说明MSCs移植治疗4周后大鼠局部心肌收缩功能有所改善。但是,本研究模型中MSCs治疗组的周向应变指标(SC、SrC)在术后4周并见明显改善,这可能与本研究所观察的时间不够长以及样本量不足有关。新分化的心肌细胞在4周内尚未使局部心肌纤维层重塑,不足以使心肌在各种方向上的收缩功能(包括周向收缩功能)都得到改善。这些都有待于进一步的研究来证实。
本研究结果显示,MSCs移植4周后整体心功能指标LVEF、FS较心肌梗死组略高,但差异无统计学意义。这与以往的研究结果有所不同,这和本研究观察时间较短,移植的干细胞对整体心功能的改善较轻微有关;另一方面,由于大鼠心尖四腔心、二腔心切面的获取困难而无法使用Simpson's双平面法计算LVEF值,在一定程度上影响测值的准确性。因此,对于大鼠心肌梗死模型的研究,应用2DSE观察局部心肌功能的变化来判断干细胞移植治疗的疗效比LVEF等指标更合适、可靠。Hartmann等人研究也表明,2DSE在评价大鼠抗肿瘤治疗后心肌功能变化方面比传统超声心动图指标有更好的敏感性,能更早地发现局部心肌功能的变化。
由于无法获取满意的大鼠心尖四腔心切面,本研究未能了解MSCs移植后心肌梗死大鼠心肌纵向收缩功能变化情况。另外,由于观察的时间较短,对MSCs移植远期疗效尚不得而知。
1 Sun JP,Niu J,Chou D,et al.Alterations of regional myocardial function in a swine model of myocardial infarction assessed by echocardiographic 2-dimensional strain imaging[J].JAm Soc Echocardiogr,2007,20(5):498 -504
2 Migrino RQ,Zhu X,Pajewski N,et al.Assessment of segmental myocardial viability using regional 2-dimensional strain echocardiography[J].J Am Soc Echocardiogr,2007,20(4):342 -351
3 Pfeffer M A,Braunwald E.Ventricular remolding after myocardial infarction:experimental observations and clinical implications[J].Circulation,1990,81(4):1161 -1172
4 Kraitchman DL,Heldman AW,Atalar E,et al.In vivo magnetic resonance imaging of mesenchymal stem cells in myocardial infarction[J].Circulation,2003,107(3):2290 -2293
5 Chang MG,Tung L,Sekar RB,et al.Proarrhythmic potential of mesenchymal stem cell transplantation revealed in an in vitro coculture model[J].Circulation,2006,113(8):1832 -1841
6 Gronthos S,Zannettino AC,Hay SJ,et a1.Molecular and cellular characterization of highly purified stromal stem cells derived from human bone marrow [J].JCell Sci,2003,116(5):1827 - 1835
7 Kraitchman D,Tatsumi M,Gilson WD,et al.Dynamic imaging of allogeneic mesenchymal stem cells trafficking to myocardial infarction[J].Circulation,2005,112(4):1451 -1461
8 Berry MF,Engler AJ,Woo YJ,et al.Mesenchymal stem cell injection after myocardial infarction improves myocardial compliance[J].American Journal of Physiology - Heart&Circulatory Physiology,2006,290(6):2196-2203
9 宋兆峰,李晓平,王晓荣,等.超声心动图评价干细胞移植对心肌梗死大鼠左心室的影响[J].中华超声影像学杂志,2007,16(1):65-68
10 林美燕,阮琴韵,廖书生,等.二维应变超声心动图评价大鼠心肌收缩应变与梗死面积的相关性[J].福建医科大学学报,2009,43(6):467-470
11 Popovic B,Benejam C,Bian J,et al.Speckle - tracking echocardiography correctly identifies segmental left ventricular dysfunction induced by scarring in a rat model of myocardial infarction[J].Am J Physiol Heart Circ Physiol,2007,292(2):2809 -2816
12 Toma C,Pittenger MF,Kevin S,et al.Human mesenchymal stem cells differentiate to a cardiomyocyte phenotype in the adult murine heart[J].Circulation,2002,105(1):93 -98

