多发性骨髓瘤中缺氧诱导因子-1α和VEGF的表达及相关性研究
姚军萍,汪兴洪,苏贵平
(皖南医学院附属弋矶山医院 血液内科,安徽 芜湖 241001)
多发性骨髓瘤(multiple myeloma,MM)目前仍属难以治愈的疾病,严重威胁中老年人生命健康。近年来MM发病率有逐年增高趋势。迄今为止,MM病因及发病机制仍未充分阐明,可能是多种因素综合作用的结果。缺氧诱导因子-1(Hypoxia inducible factor 1,HIF-1)是缺氧条件下广泛存在于哺乳动物和人体内的一种转录因子,近年来很多研究发现HIF-1能够调控细胞周期和凋亡,控制细胞增殖和转移,参与肿瘤新生血管生成[1,2]。有研究表明,该因子可调节多种靶基因如血管内皮生长因子(vascular endothelial growth factor,VEGF)、红细胞生成素的表达。HIF-1可在基因水平上直接调控VEGF的表达,是恶性肿瘤诱导新生血管形成的主要调控因子之一。本研究旨在考察初诊MM患者骨髓组织中HIF-1α、VEGF蛋白的表达情况,并分析两者的相关性,探讨其在MM发病机制中的作用,为进一步开展MM基因靶向治疗提供相关的理论依据。
1 材料与方法
1.1 标本来源 实验对象及分组:MM组40例,为皖南医学院附属弋矶山医院血液内科2009年1月~2011年10月间的住院患者,男26例,女14例,年龄40~82(62.65±9.84)岁。全部病例均符合2007年张之南等主编的《血液病诊断及疗效标准》中的MM的诊断标准。经血清免疫固定蛋白电泳法确定其异常免疫球蛋白(M蛋白)的类型。其中IgG型24例((IgG-κ型17例,IgG-λ 型7例),IgA 型10例(IgA-κ 型5例,IgA-λ 型5例),轻链型6例(κ 轻链型1例,λ轻链型5例)。对照组取我院骨科手术切除的非恶性肿瘤患者的髂骨制为标本。男13例,女7例,年龄43~89(63.20±11.25)岁。
1.2 试剂 HIF-1αAb-4鼠单克隆抗体(美国Neo-Markers公司),鼠抗人VEGF单克隆抗体(武汉博士德生物技术有限公司),链霉素抗生物素蛋白-过氧化物酶(S-P)免疫组化试剂盒(北京中杉生物公司),DAB显色剂(北京中杉生物公司)。免疫组织化学染色所需的常规试剂均由皖南医学院附属弋矶山医院病理科提供。
1.3 方法
1.3.1 活检切片制作 采用B65-01型骨髓活检针于髂后上棘局麻后取骨髓活检组织块2.5 mm×(10~15 mm)之间的新鲜组织,-80℃丙酮固定2 h,HAM846包埋液按A液、B液顺序滴加,待凝固后用莱卡切片机切取3 μm厚度的切片60℃烘烤2 h,使用多聚赖氨酸涂抹的玻璃片贴片。
1.3.2 免疫组织化学染色 应用链霉素抗生物素蛋白-过氧化物酶(S-P)免疫组织化学染色法检测HIF-1α和VEGF在MM组和对照组中的表达。具体操作步骤按说明书进行。用PBS替代一抗作阴性对照,已知阳性片作阳性对照。
1.3.3 结果判断 HIF-1α阳性染色主要表现为细胞核或细胞核及部分细胞质内呈现棕色或棕黄色颗粒。VEGF阳性染色主要表现为细胞质内呈现棕色或棕黄色颗粒。参照过氧化物酶染色方法评分标准,对阳性细胞的数量以及染色强度进行评分①阳性细胞数:无阳性细胞数为0分;阳性细胞数<25%为1分;阳性细胞数25% ~50%为2分;阳性细胞数>50%为3分。②染色强度:无染色为0分;黄色为1分;棕黄色为2分;棕褐色为3分。①+②即为细胞得分,3~6分为阳性。
1.4 统计学分析 采用SPSS 16.0软件包进行统计学处理,计数资料用率表示,采用χ2检验;计量资料使用均数±标准差表示,采用t检验进行分析;双变量资料采用等级相关分析。以α=0.05为检验水准。
2 结果
2.1 HIF-1α在MM组和对照组骨髓组织中的表达HIF-1α在MM中的阳性表达率为72.50%(29/40),其阳性表达主要位于细胞核,部分细胞质内呈现棕色或棕黄色颗粒;HIF-1α在对照组骨髓组织中有7例呈弱阳性表达,阳性着色位于细胞核,未见有强阳性表达。HIF-1α在MM中的表达与对照组相比差异有统计学意义(χ2=7.813,P <0.01)。
2.2 VEGF在MM组和对照组骨髓组织中的表达VEGF在MM中的阳性表达率为67.50%(27/40),其阳性表达主要位于细胞质;VEGF在对照组骨髓组织中有6例呈阳性表达,阳性着色位于细胞质,未见有强阳性表达。VEGF在MM中的表达与对照组相比差异有统计学意义(χ2=7.576,P<0.05)。
2.3 HIF-1α和VEGF在 MM中表达的相关性HIF-1α和VEGF在MM中表达呈中等强度的正相关性(rs=0.529,P <0.01)。见表1。
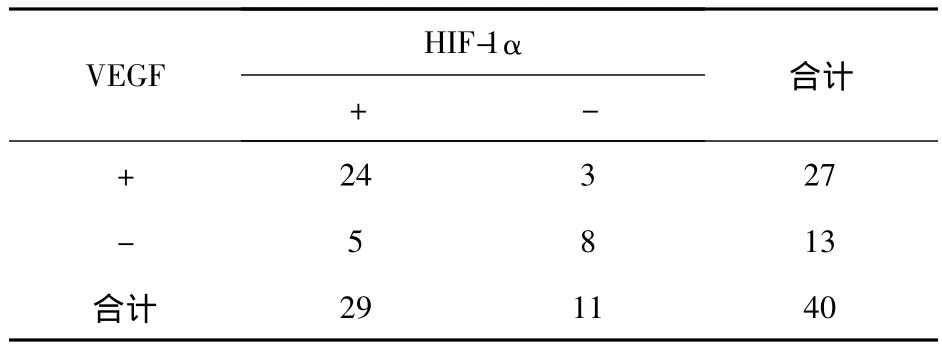
表1 初诊MM患者骨髓组织中HIF-1α和VEGF表达的相关性Tab 1 HIF-1α and VEGF expression in newly diagnosed MM patients
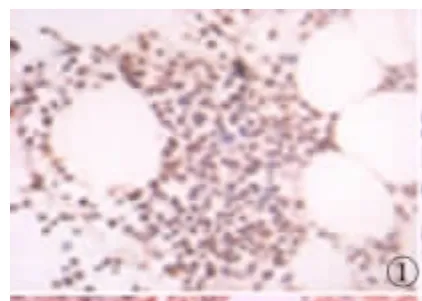
图1 HIF-1α在MM组中的表达(SP×400)Fig 1 Expression of HIF-1α in MM(SP×400)
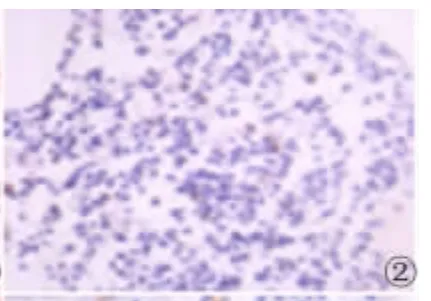
图2 HIF-1α在对照组中的表达(SP×400)Fig 2 Expression of HIF-1α in control group(SP×400)
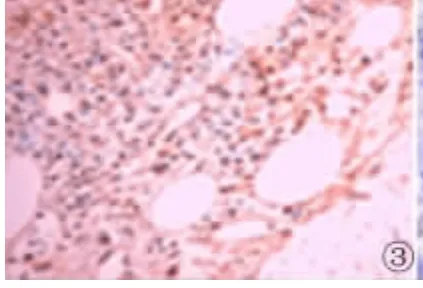
图3 VEGF在MM组中的表达(SP×400)Fig 3 Expression of VEGF in MM(SP×400)
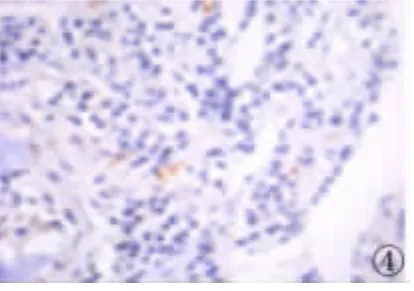
图4 VEGF在对照组中的表达(SP×400)Fig 4 Expression of VEGF in control group(SP×400)
3 讨论
HIF-1α是在大多数实体瘤中过度表达的一种转录因子,在肿瘤细胞适应缺氧、能量代谢、肿瘤血管生成、侵袭和转移中起重要作用[3]。文献报道[4,5],HIF-1α 在许多肿瘤组织中高表达。既往对HIF-1α的研究主要集中于实体瘤,而随着骨髓造血微环境概念的提出及相关研究的深入,人们对血液肿瘤骨髓造血微环境的关注日益密切。本研究中发现初诊MM患者的骨髓活检切片过度表达HIF-1α蛋白,HIF-1α蛋白在骨髓瘤细胞的胞核中表达阳性棕色颗粒;对照组骨髓组织切片中HIF-1α蛋白表达少,染色淡。40例初诊MM患者骨髓组织中HIF-1α表达阳性率为72.50%,而对照组中仅7例表达阳性。两组比较有差别(Fisher's exact Test P<0.01)。这与Asosingh等[6]研究发现相似,在MM的异常骨髓微环境中,存在HIF-1α的高表达。HIF-1α可能是参与MM骨髓造血微环境形成的重要转录调控因子。
在生理情况下,健康人的组织细胞中均可检测出VEGF以及VEGF mRNA的表达。但除胚胎发育、外伤愈合、月经期间之外,其表达甚微,并且仅能维持正常血管密度和整体渗透功能[7]。现有大量实验研究证明:在许多肿瘤组织中VEGF呈高表达,并且其水平的高低与肿瘤的某些生物学行为有密切关系[8]。本研究结果显示初诊MM患者的骨髓活检切片过度表达VEGF蛋白,40例初诊MM患者骨髓组织中VEGF表达阳性率为67.50%,与对照组比较有差别,这一结果与周慷等[9]的研究结果一致,在MM中存在VEGF的高表达。VEGF可诱导肿瘤血管生成,促进了MM的发生发展。
VEGF作为最常见且强力的促血管新生因子,在恶性血液系统疾病中起着重要的作用。它可从3个方面促进肿瘤细胞的生长:内皮细胞依赖式的旁分泌途径、内皮细胞依赖式的血管新生途径及内皮细胞非依赖式的自分泌途径[10,11]。研究表明,VEGF是参与肿瘤新生血管形成的主要调控因子[12],能特异地结合血管内皮细胞,促进内皮细胞生长,增加血管通透性,从而诱导血管生成。而HIF-1则在基因水平上直接调控VEGF的表达,是恶性肿瘤诱导新生血管形成的主要调控因子之一。缺氧是其表达量增加的最重要机制,在缺氧时HIF-1能够启动VEGF的转录,并且可增加VEGF的稳定性[13]。本研究中发现 HIF-1α蛋白的表达率与VEGF蛋白的表达率在初诊MM患者骨髓组织中无显著差别,同时HIF-1α蛋白的表达与VEGF蛋白的表达呈正相关性,即在HIF-1α蛋白高表达的病例,VEGF蛋白亦有高表达的趋势。在MM发生、发展过程中,提示可能存在着HIF-1α过表达,进而引起VEGF过度表达,促进血管新生。
肿瘤细胞的快速生长所造成的缺氧环境可诱导HIF-1α的表达,而 HIF-1α又可调节其下游基因VEGF基因的表达而促进血管形成和肿瘤的生长[14]。目前,HIF-1α在临床方面的研究还处于初级阶段,其与肿瘤临床病理特征的关系还不十分明了,HIF-1α在肿瘤治疗方面的研究仍处于实验室研究阶段,作用于VEGF靶点的抗肿瘤药物已在临床应用,并取得一定疗效。而作用于HIF-1α靶点的治疗策略正在实验室和临床试验的研究之中,它极有可能成为肿瘤治疗的新靶点。
[1]KONDO K,KLCO J,NAKAMURA E,et al.Inhibition of HIF is necessary for tumor suppression by the von Hippel-Lindau protein[J].Cancer Cell,2002,1(3):237 -246.
[2]ZHONG H,DE MARZO AM,LAUGHNER E,et al.Over expression of hypoxia-inducible factor 1a in common human cancers and their metastases[J].Cancer Res,1999,59(22):5830 -5835.
[3]KOUKOURAKIS MI,GIATROMANOLAKI A,SIVRIDIS E,et al.Lactate dehydrogenase-5(LDH-5)overexpression in non-smallcell lung cancer tissues is linked to tumour hypoxia,angiogenic factor production and poor prognosis[J].Br J Cancer,2003,89(2):877-885.
[4]吴欣爱,孙燕,樊青霞,等.乏氧诱导因子1α在食管鳞癌中的表达及其与化疗疗效的关系[J].中华医学杂志,2007,87(25):1783-1785.
[5]QUINTERO M,MACKENZIE N,BRENNAN PA,et al.Hypoxiainducible factorl(HIF-1)in cancer[J].Eur J Surg Oncol,2004,30(5):465-468.
[6]ASOSINGH K,DE RAEVE H,DE RIDDER M,et al.Role of the hypoxic bone marrow microenvironment in 5T2MM murine myeloma tumor progression[J].Haematologica,2005,90(6):810 -817.
[7]崔大明,牛晓明.血管内皮生长因子与抗肿瘤研究进展[J].复旦学报(医学版),2006,33(4):566 -568.
[8]KATO Y,ASANO K,MOGI T,et al.Clinical significance of circulaxing vascular endothelial growth factor in dogs with mammarg gland tumors[J].VetMed Sci,2007,69(1):77 -80.
[9]周慷,邓建川,娄世锋,等.多发性骨髓瘤 survivin与VEGF表达的相关性及临床意义[J].肿瘤防治研究,2009,36(7):593-595.
[10]DE BONT ES,NEEFJES VME,ROSATI S,et al.New vessel formation and aberrant VEGF/VEGFR signaling in acute leukemia:Does it matter[J].Leuke Lymph,2002,43(10):1901 -1909.
[11]TANAKA Y,ABE M,HIASA M,et al.Myeloma cell-osteoclast interaction enhances angiogenesis together with bone resorption:a role for vascular endothelial cell growth factor and osteopontin[J].Clin Cancer Res,2007,13(3):816 -823.
[12]周哲,谷小虎.原发胃癌中VEGF检测与临床病理因素的相关性研究[J].实用肿瘤学杂志,2006,20(2):103-105.
[13]ZIEMER LS,KOCH CJ.Hypoxia and VEGFmRNA expression in human tumors[J].Neoplasia,2001,3(6):500 -508.
[14]程艳香,濮德敏,刘嵘,等.低氧诱导因子1α对子宫颈癌细胞生物学行为的影响[J].中华妇产科杂志,2007,42(8):551-554.

