思茅松大配子体DNA的提取及ISSR反应体系的建立
王曙光,杨文武,普晓兰
(西南林业大学,云南昆明 650224)
思茅松[Pinus kesiya var.langbianensis(A.Chev.)Gaussen]主要分布于云南省普洱市及相邻地区,是云南省重要的材脂两用树种。思茅松个体之间松脂产量存在很大的变异,产脂力最高可相差39倍以上(楼浙辉和舒洪岚,2002)。这种产脂力的差异在我国的其它采脂树种马尾松、油松中也是普遍现象,但天然林分中,高产脂树木的比例不到20%(李明,2003)。要提高松树的产脂量,建立高产优质采脂基地是松脂产业发展的必然选择。因此,对高产脂力思茅松进行早期选择,为思茅松高产脂林和用材林的定向培育提供基础种源,对提高平均松脂产量及林分生产力,具有十分重要的生产实际意义。
分子标记辅助选择育种(Marker Assist Selection简称MAS),是利用分子标记构建的遗传图谱使选择直接基于DNA水平上,通过在分子水平上分析与目标基因紧密连锁的分子标记的基因型来判别目标基因是否存在来进行早期选择和对隐性基因的选择,可为林木生长、抗性、材性等主要性状的早期测定提供依据,由于不受其它基因效应和环境因素的影响,大大提高了早期测定的精确度和可靠性。这将有助于克服林木世代长所带来的局限性,提高选择效果,缩短育种周期,加速育种进程,对生长周期长的林木具有重要意义(刘勋成等,2005)。
简单重复序列间区标记技术(inter-simple sequence repest,ISSR)是由加拿大蒙特利尔大学的Zietkiewicz等(1994)首次提出的,是一种在PCR中直接使用微卫星序列进行DNA扩增的分子标记技术,具有快速、高效的特点。并且具有很好的多态性和稳定性,可同时提供多位点信息和揭示不同微卫星座位个体间变异的信息。本文以产自云南省的思茅松为研究对象,通过提取思茅松胚乳基因组DNA,建立并优化ISSR-PCR扩增的条件,为思茅松的分子辅助育种提供技术基础。
1 材料和方法
1.1 试验材料
本研究的材料采自云南普洱市景谷县,于40℃烘箱中烘干球果,取出种子,冰箱保存备用。使用时,将种子浸于75% 的酒精溶液烧杯中,置于常温48 h,取出后用蒸馏水洗涤,用灭过菌镊子剥离种皮并小心去掉胚,只留下胚乳,放入-20℃冰箱中备用。
1.2 思茅松胚乳DNA的提取
采用改良SDS法和改良CTAB法提取思茅松胚乳DNA,对所得DNA进行浓度、纯度及ISSR-PCR检测,筛选出适合思茅松胚乳DNA提取的方法并用于思茅松胚乳DNA的提取。
1.3 DNA纯度、浓度和产率的检测
1.3.1 紫外分光光度计检测
本试验以TE为空白,在不同提取方法所得DNA随机选取5个样本,每个样品取4 μL DNA用TE稀释成400 μL,将待测的 DNA应用 ULTROSPEC2000紫外分光光度计测定,分别测出OD260、OD280和OD260/OD280的值,每个样本测5次后求得平均值,通过对比三者的大小,比较、分析两种方法的优劣。
1.3.2 DNA琼脂糖凝胶电泳检测
0.8 %琼脂糖凝胶(含终浓度为0.5 μg·mL-1的溴化乙锭),取6 μLDNA样品与4 μL溴酚蓝混合,用8 μL点样后电泳,1×TAE缓冲液,电泳电压8 V·cm-1,电泳时间2 h。凝胶自动成像系统扫描,照相,对照分析比较。
1.3.3 DNA的PCR扩增检测
以7号样为模板从购自上海生物工程公司的31个引物中进行引物初步筛选及复筛,从而建立相应的反应程序。PCR扩增反应参照前人的工作(吕艳芳等,2003,刘彤等,2006),扩增结果用1.6%琼脂糖凝胶电泳检测,根据所得谱带的条带数目和清晰程度,确定两种方法所提取的DNA质量的优劣。
1.4 ISSR-PCR扩增条件及反应体系稳定性检测
虽然ISSR技术具有重复性高、操作简单和检测多态性十分敏感等优点,但不同植物、不同试验条件的PCR扩增的最适条件仍需优化,以确定各主要影响因子的最适用量及最佳组合。
用单因子分析法分别对思茅松ISSR-PCR反应体系中的模板DNA用量,Taq DNA聚合酶用量(大连宝生生物有限公司),Mg2+浓度,dNTP浓度、引物浓度(上海生物工程公司合成)以及退火温度等进行优化,确定适用于本试验的思茅松的反应体系。
运用已经优化好的PCR反应体系和程序,从购自上海生物工程公司的30个引物中筛选出10个出条带清晰、稳定性高、多态性好的引物,对思茅松不同产脂量的10个样本进行PCR扩增,以确定DNA提取方法及所建立的ISSR-PCR扩增体系的可行性。
2 结果与分析
2.1 不同方法提取DNA结果比较分析
2.1.1 紫外分光光度计检测结果
试验中由SDS法和CTAB法所获得DNA中各随机选取5个样本进行紫外分光光度检测(表1)。
结果显示所有样品的 OD260/OD280值均高于1.6,说明无蛋白质污染,即两种方法在除去蛋白质上效果相似。在DNA浓度上,SDS法总体浓度较CTAB法高,CTAB法仅个别样品获得高浓度的DNA,个体产率差异大,具有不稳定性。主要是由于CTAB法提取步骤较多,损失的DNA量相应增加,导致总体产率偏低,也可能和种子的个体差异存在一定的相关性。此外,CTAB法耗时较长。
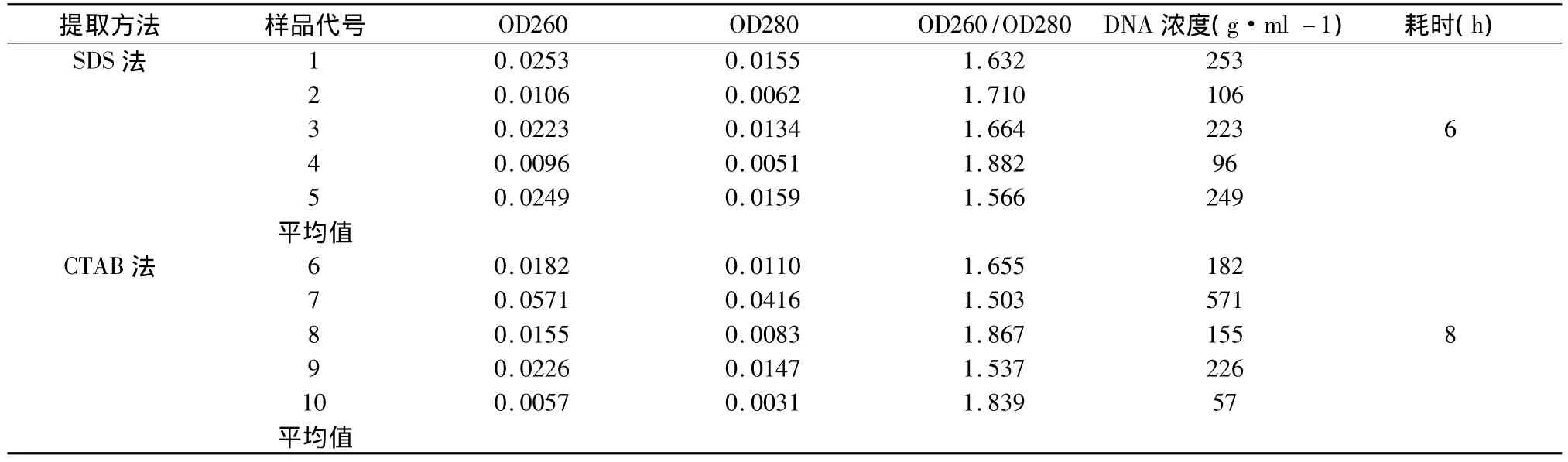
表1 SDS法和CTAB法提取的基因组DNA紫外分析结果
3.1.2 DNA琼脂糖凝胶电泳检测结果
从两种方法所得DNA中各随机选取5个样本进行琼脂糖凝胶电泳,结果如图1所示。
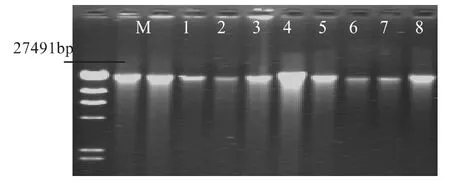
图1 SDS法和CTAB法提取DNA效果图比较
其中1号~5号为SDS法所得DNA,6号 ~10号为CTAB法提取
从图1可看出,种子胚乳DNA经SDS法和CTAB法提取均能得到较清晰迁移条带,但存在不同程度的降解。在去除杂质方面,SDS法点样孔中存在轻微的EB吸收,说明有多糖污染;而CTAB法提取DNA条带电泳速度慢于SDS法,则可能由于多糖的粘连性所导致,同样存在多糖污染。从带的亮度和宽度上看,两种方法在产率上都存在较大差异,就总体产量而言SDS法高于CTAB法,与紫外分光光度计检测结果相符。
3.1.3 DNA的PCR扩增分析
以7号样为模板进行引物初筛,结果见图2。
从图2中可看出,仅有少量引物能得到条带,且都模糊不清背景条带较重,说明该反应体系不适合用于思茅松ISSR-PCR扩增,需对反应体系及条件进行优化以期得到较好的扩增结果。图中7号点样孔所用引物获得条带最多且最为清晰,选用该引物(即(GA)8)作为后续条件优化的引物。
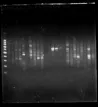
图2 ISSR-PCR引物初筛效果图
根据引物初步筛选的结果,筛选出到有扩增产物的引物,再用4个样品对初筛有扩增产物的引物进行多态性复筛,所得结果如图3所示:

图3 ISSR-PCR引物复筛效果图
从图3中可看出,各引物所得条带数、清晰度及多态性各不相同,我们从中挑选出4个条带清晰、多态性好的引物对不同样品进行扩增,以确定所建体系的实用性。所选4个引物基本信息如下:
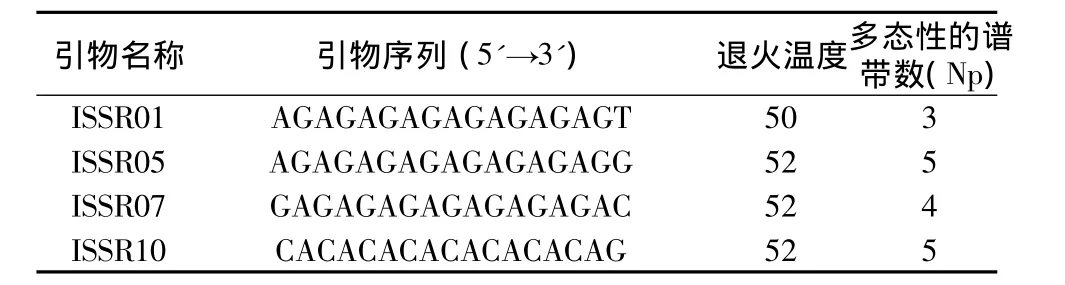
表2 ISSR引物及其退火温度
对通过SDS法和CTAB法两种方法所得DNA以初选(GA)8引物进行ISSR-PCR扩增,结果如图4所示:
从图4中可看出,两种方法均可得到清晰的DNA条带,但CTAB法在进行PCR扩增时出现较多的缺带,因此SDS法效果更佳。
图4 不同提取方法所得DNA ISSR-PCR效果图
3.2 思茅松ISSR-PCR扩增条件的优化结果
3.2.1 DNA模板对反应体系的影响
适宜的模板量是保证特异性扩增的前提,模板量过多会增加非特异性的扩增形成背景,从而降低特异性扩增效率。本试验在20 μL反应体系中加入DNA 的量分别为:20 ng、30 ng、40 ng和50 ng。

图5 DNA模板浓度梯度比较
从图5中可看出,当DNA量为50 ng时,扩增条带多,但同时出现弥散现象,带型模糊,条带彼此间难以分清,说明模板浓度过高引起非特异性扩增增加,影响条带计数。DNA量为20 ng时扩增条带减少。DNA量为30 ng和40 ng时均能获得清晰可辨、样式相同的带型,说明模板的最适用量存在一个区间,在该区间内模板浓度变化对扩增结果影响不大。试验中由于模板质量存在一定差异,为保证每次都能得到清晰的条带,本次试验选用较高的模板浓度,即 40 ng·20 μL-1。
3.2.2 引物浓度对ISSR-PCR反应体系的影响
引物浓度是影响ISSR-PCR结果的重要变量之一,浓度过低不能产生有效扩增以检测出所有ISSR位点,浓度过高会引起错配和非特异性扩增形成背景使条带不清晰,且可增加引物之间形成二聚体的几率(林萍,张含国,2005)。本试验设定0.5 μmol·L-1、0.6 μmol·L-1、0.7 μmol·L-1和 0.8 μmol·L-1等4个梯度进行扩增,结果如图6所示:
图6 引物浓度梯度对比
由图6知,当引物浓度为0.5 μmol·L-1~0.6 μmol·L-1时,反映稳定、带型好、条带清晰;随着引物浓度升高到0.7 μmol·L-1时,虽条带数目增多,但大片段条带不清晰。为了减少非特异性扩增,加强试验的可重复性,试验在确保产量的前提下,采用了较低的引物浓度,即20 μL反应体积中加入引物浓度为 0.6 μmol·L-1。
3.2.3 Mg2+浓度对ISSR扩增结果的影响
Mg2+浓度对PCR扩增的特异性和产量有显著的影响,Mg2+作为Taq酶的辅助因子,不仅影响Taq酶的活性,还能与反应液中的dNTP、模板DNA及引物结合,影响引物与模板的结合效率、模板与PCR产物的解链温度以及产物的特异性和引物二聚体的形成(姜静,杨传平,2003)。本试验设定1 mmol·L-1.0、1 mmol·L-1.5、2 mmol·L-1.0 mmol·L-1和2.5 mmol·L-1等4个浓度梯度进行扩增,所得结果如图7所示:
图7 Mg2+浓度梯度实验
由图7可见,当其浓度在1.0 mmol·L-1,1.5 mmol·L-1,2.0 mmol·L-1和 2.5 mmol·L-1时均能得到清晰的条带,但其浓度过高或过低扩增带都较少,浓度过低降低了Taq DNA聚合酶的活性使产物减少;浓度过高引起与反应液中的dNTP、模板DNA及引物结合,同样使条带减少。Mg2+浓度在2.0 mmol·L-1时条带多、带型好且条带清晰容易区分,经多次试验结果稳定。所以确定2.0 mmol·L-1为Mg2+最佳反应浓度。
3.2.4 Taq DNA聚合酶浓度对ISSR扩增结果的影响
Taq酶的用量直接影响扩增的质量和实验成败,酶用量过高不仅增加成本,还会造成非特异性的扩增产物;浓度过低则会使酶过早地消耗完,合成效率下降而使扩增产物量减少(李鹏等,2008)。本试验设定0.5 U、0.75 U、1 U和1.25 U等4个浓度梯度进行PCR扩增,结果如图8所示:
图8 Taq DNA聚合酶浓度对比
试验结果表明,Taq DNA聚合酶单位为0.5 U~0.75 U时酶量过低,产物的合成效率低,条带数量少;Taq DNA聚合酶单位为1.0 U时可以得到清晰的条带,无非特异扩增;当其用量升高到1.25 U时出现非特异扩增而使条带粘连在一起。因此,在思茅松胚乳ISSR-PCR试验中,确定Taq DNA聚合酶的用量为1 U,经多次试验验证扩增结果稳定。
3.2.5 dNTPs浓度对ISSR扩增结果的影响
dNTPs是反应的原料,其浓度与PCR扩增效率有密切关系,浓度过高,会导致聚合酶错误地掺入,影响扩增的特异性和准确性,同时还会与Taq DNA聚合酶竞争Mg2+,使反应体系中的Mg2+总量下降,从而影响聚合酶的活性;浓度过低,会因dNTP过早消耗而使产物单链化,影响扩增效果(余艳等,2003)。本试验设置了 0.1 mmol·L-1、0.2 mmol·L-1、0.3 mmol·L-1、0.4 mmol·L-1等 4 个浓度梯度,扩增结果如图9所示:

图9 dNTPS浓度梯度实验
试验结果表明,在0.1 mmol·L-1~0.4 mmol·L-1范围内均可以扩增出条带,但浓度过高或过低条带都较少且模糊,不利于多态性分析。当dNTPs浓度在0.20 mmol·L-1时条带多且最为清晰,经多次试验表明结果稳定性好。所以dNTPs的用量确定为 0.2 mmol·L-1。
3.3 思茅松ISSR-PCR反应扩增体系的建立
通过上述单因子试验确定了思茅松ISSR-PCR反应体系中各影响因子的最适浓度,将各影响因素综合建立思茅松 ISSR-PCR反应体系为:模板DNA40 ng,引物(20 μmol· L-1)0.6 μL,MgCl2(2.5 mmol·L-1)1.6 μL,TaqDNA 聚合酶(5 U·μL-1)1 U,NTPs(2.5 mmol·L-1)1.6 μL,10 ×PCR buffer2 μL,ddH2O14.5 μL。
3.4 ISSR-PCR反应体系稳定性检验
利用引物的筛选结果,并结合刘娜等(刘娜,2009)在云南松胚乳中优化的ISSR-PCR反应体系中的热循环程序,即94℃预变性5 min,94℃变性45 s,52℃退火 45 s,72℃ 延伸 60 s,72℃ 终延伸 10 min,循环35次,用上述筛选出的引物对所有供试样品进行扩增,从而对上述优化的ISSR-PCR反应体系进行稳定性检验。采取同一引物对不同样品及同一样品采用不同引物检测其扩增效果。如图10、11和12所示:
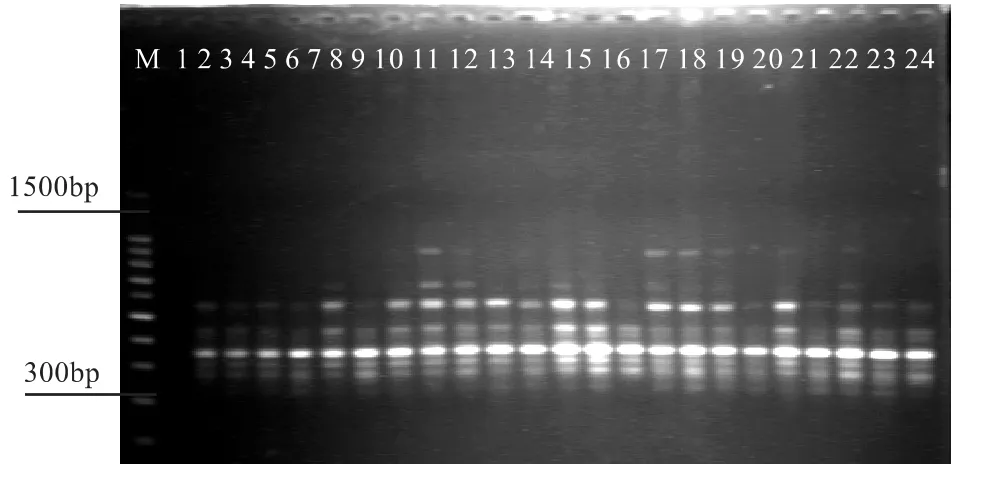
图10 ISSR10引物对1号高产脂1号~24号样扩增效果图

图11 ISSR10引物对7号低产脂1号~24号样扩增效果图
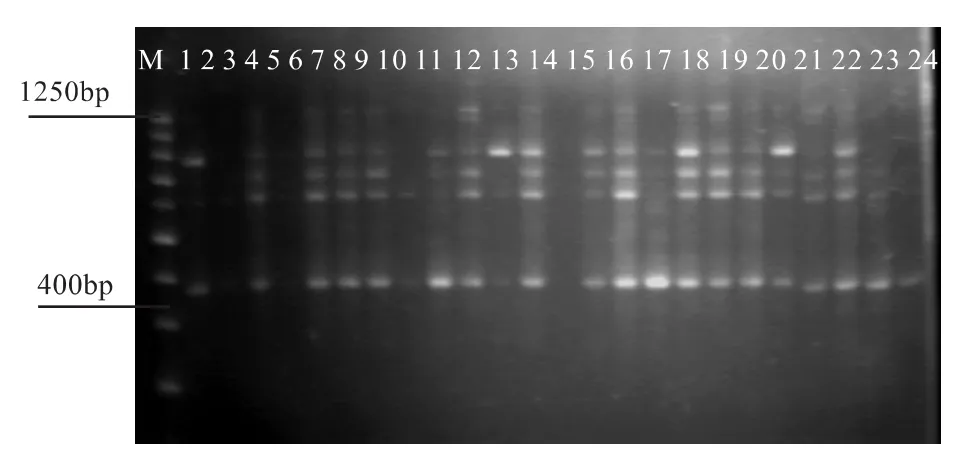
图12 ISSR7引物对7号低产脂1号~24号样扩增效果图
从图10、11和12可看出,无论是同一引物对不同样品还是同一样品采用不同引物的扩增都能得到条带清晰、多态性好的扩增产物。对于个别样品的条带缺失,则可能由于引物的原因引起,与扩增体系无关。试验结果表明所建反应体系适合思茅松ISSR-PCR扩增,可用于其遗传图谱的构建。
4 结论
通过采取SDS和CTAB两种方法对思茅松胚乳进行DNA提取并比较。结果表明,CTAB法所得DNA纯度较高但产量较低;两种方法在去除蛋白质、多糖等杂质污染上效果相似且都存在一定的降解;将两种方法所得DNA进行PCR扩增,显示SDS法优于CTAB法。通过优化模板DNA用量,Taq DNA聚合酶浓度,Mg2+离子浓度,dNTP浓度、引物浓度等影响因子,确定思茅松ISSR-PCR反应体系为:在 20 μl的反应体系中,模板 DNA(ng·20 μL-1)40 ng,引物(20 μmol·L-1)0.6 μL,MgCl2(25 mmol·L-1)1.6 μL,TaqDNA 聚合酶(5 U·μL-1)1 U,dNTPs(2.5 mmol·L-1)1.6 μL,10 ×PCR buffer 2 μL,ddH2O 14.5 μL。通过筛选出的 4个引物对所建体系进行验证,结果均表明所建体系稳定性高,所得条带清晰、多态性好,可用于思茅松ISSR-PCR扩增。
[1]李明.思茅松高产脂良种的开发利用[J].云南林业,2003,24(5):20~22.
[2]李鹏,汪阳东,陈益存,等.油桐ISSR-PCR反应体系的建立[J].林业科学研究,2008,21(2):194 ~199.
[3]刘娜,王昌命,普晓兰.云南松胚乳DNA的提取和ISSR-PCR反应体系的建立[J].西南林学院学报,2009,29(2):.
[4]刘彤,郝雨,周志强.天然山地樟子松遗传多样性研究的ISSRPCR反应体系的优化[J].东北林业大学学报,2006,34(5):20~22.
[5]刘勋成,李玉媛,陈少瑜.不同榉树种源遗传多样性的ISSR分析[J].西部林业科学,2005,34(2):43~47.
[6]楼浙辉,舒洪岚.松树高产脂遗传改良的研究进展[J].江西林业科技,2002(5):40~41.
[7]吕艳芳,等.五针松胚乳ISSR-PCR反应体系的建立[J].植物研究,2003,23(4):429 ~432.
[8]余艳,陈海山,葛学军.简单重复序列区间ISSR引物反应条件优化与筛选[J].热带亚热带植物学报,2003,3(1):15~19.
[9]ZIETKIEWICZ E,RAFALSKI A,LABUDA D Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification [J].Genomics,1994,20(2):176 ~183.

