老年原发性高血压合并糖尿病患者凝血纤溶功能变化的研究*
王丽莉 肖广辉 诸葛欣 陈翊玲 杜卫京
血栓栓塞性并发症是致原发性高血压患者死亡的主要原因之一。内皮功能不全、血小板聚集和凝血系统活化以及纤溶活性的下降可以导致严重的心血管并发症的发生,但具体机制还不明确[1]。糖尿病是高血压的危险因素之一,本文通过观察老年原发性高血压合并2型糖尿病患者血浆血管性血友病因子(von Willebrand’s factor,vWF)、纤维蛋白原(fibrinogen,Fbg)、凝血酶原片段1+2(prothombin fragment 1+2,F1+2)、组织型纤溶酶原激活剂(tissue-type plasminogen activator,t-PA)及其抑制物内皮细胞型纤溶酶原激活物抑制剂1(plasminogen activator inhibitor,PAI-1)水平的变化,探讨老年原发性高血压合并2型糖尿病患者凝血、纤溶功能的改变,以期早期预防血栓栓塞性并发症的发生。
1 对象与方法
1.1 研究对象 2009年10月—2010年10月就诊于我院的老年高血压患者100例,其中单纯高血压患者(高血压组)50例,高血压合并2型糖尿病患者(合并症组)50例。高血压诊断符合1999年世界卫生组织/国际高血压联盟(WHO/ISH)关于原发性高血压治疗指南确定的标准,即未服用抗高血压药物情况下,收缩压(SBP)≥140 mm Hg(1 mm Hg=0.133 kPa)和(或)舒张压(DBP)≥90 mm Hg及正在服用抗高血压药物者。2型糖尿病诊断符合1999年世界卫生组织2型糖尿病诊断和分类标准。排除标准:(1)继发性高血压、血栓性疾病,严重心、肾功能不全,严重肝脏疾病及其他慢性疾病患者。(2)正在接受调脂药物、抗凝及抗血小板聚集等药物、血管紧张素转换酶抑制剂(ACEI)、血管紧张素Ⅱ1型受体拮抗剂(ARB)。(3)服用格列齐特、胰岛素增敏剂、双胍类药物及其他影响凝血、纤溶功能药物者。另选取门诊体检者30例为对照组,经询问病史、体检、心电图、胸片及其他实验室检查均为正常者。
1.2 方法 研究对象均空腹12 h后于上午9:00前稍静息后取肘正中静脉血5 mL,采用CLAUSS凝固法测定Fbg含量,应用酶联免疫吸附抗体夹心法测定血浆vWF、F1+2、t-PA及PAI-1水平,试剂盒由上海太阳生物技术公司生产。采用全自动生化分析仪检测糖化血红蛋白(HbA1c)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL)、高密度脂蛋白胆固醇(HDL)及三酰甘油(TG)水平。
1.3 统计学处理 采用SPSS 17.0软件包统计分析,计量资料以均数±标准差(±s)表示,多组均数比较应用单因素方差分析,进一步两两比较采用SNK-q检验,计数资料比较用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 3组一般资料比较 3组间年龄、性别、体质量指数(BMI)、血TC、LDL及HDL差异均无统计学意义(P>0.05)。3组间收缩压(SBP)、舒张压(DBP)、TG和HbA1 c差异有统计学意义(P<0.05)。合并症组的TG、SBP、DBP、HbA1c均高于对照组,高血压组的SBP和DBP均高于对照组,合并症组的HbA1c高于高血压组,差异均有统计学意义(P<0.05或P<0.01),见表1。
2.2 3组凝血和纤溶功能比较 3组血浆vWF、Fbg、F1+2、t-PA和PAI-1水平差异均有统计学意义(P<0.01)。高血压组、合并症组的血浆vWF、Fbg、F1+2及PAI-1水平均高于对照组,t-PA均低于对照组;合并症组的血浆F1+2和PAI-1水平均高于高血压组,t-PA水平低于高血压组,差异有统计学意义(P<0.05或P<0.01),见表2。

Table 1 Comparison of general data between three groups表1 3组一般资料比较
Table 2 Comparison of coagulation and fibrinolysis index between three groups表2 3组凝血和纤溶指标比较 (±s)
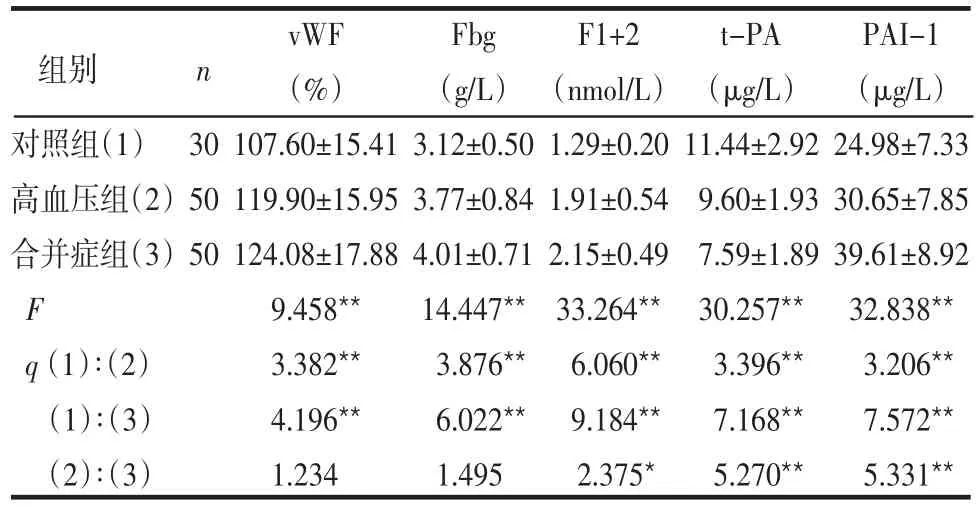
Table 2 Comparison of coagulation and fibrinolysis index between three groups表2 3组凝血和纤溶指标比较 (±s)
*P<0.05,**P<0.01
组别 n对照组(1)高血压组(2)合并症组(3)F q(1)∶(2)(1)∶(3)(2)∶(3)30 50 50 vWF(%)107.60±15.41 119.90±15.95 124.08±17.88 9.458**3.382**4.196**1.234 Fbg(g/L)3.12±0.50 3.77±0.84 4.01±0.71 14.447**3.876**6.022**1.495 F1+2(nmol/L)1.29±0.20 1.91±0.54 2.15±0.49 33.264**6.060**9.184**2.375*t-PA(μg/L)11.44±2.92 9.60±1.93 7.59±1.89 30.257**3.396**7.168**5.270**PAI-1(μg/L)24.98±7.33 30.65±7.85 39.61±8.92 32.838**3.206**7.572**5.331**
3 讨论
高血压并发症和死亡的主要原因是靶器官动脉血栓形成所致的血流状态紊乱。血栓形成是血管内皮细胞、血小板、凝血及纤溶系统等多种因素改变的结果。
血浆vWF由血管内皮细胞和血小板合成并分泌,其通过结合血小板膜糖蛋白Ib(GPIb)受体促进血小板向内皮损伤部位聚集,被认为是血管内皮损伤的标志物[2]。Fbg是由肝脏产生的,由α、β和γ3条蛋白链通过二硫键连接形成的大分子蛋白[3],它能增加血浆和全血黏度从而促进血栓形成。Fbg水平是心血管疾病的独立危险因素[4]。Tabak等[5]研究表明原发性高血压患者中Fbg水平升高,但是升高的Fbg水平是高血压的危险因素还是高血压的结果目前还不明确。有研究发现,Fbg水平可以预测2型糖尿病患者静息性心肌缺血的发生[6]。F1+2是凝血过程中由因子Ⅹa复合物水解凝血酶原后形成的多肽片段,对判断血栓形成危险度有重要的参考价值[1]。本研究中,高血压合并糖尿病组、高血压组的血浆vWF、Fbg及F1+2水平均高于对照组,高血压合并糖尿病组的血浆F1+2水平高于高血压组,提示原发性高血压患者存在着凝血系统的活化,而高血压合并糖尿病患者凝血系统的改变更为明显。
t-PA和PAI-1是纤溶系统功能主要的调节成分,两者平衡是防止血栓形成的重要条件。tPA由血管内皮中小而致密的颗粒合成并储存,Ⅹa因子、凝血酶、激肽和儿茶酚胺以及P物质等可以刺激其释放[7]。PAI-1由内皮细胞和脂肪组织产生,血管紧张素Ⅱ和血管紧张素Ⅳ可以刺激内皮细胞产生PAI-1[8]。纤溶功能障碍表现为t-PA水平降低和PAI-1水平升高[9]。Giannarelli等[10]研究表明在高血压患者中,肾上腺素刺激tPA释放的下降可能是通过减少一氧化氮介导的,这种纤溶功能受损可能会导致更多的心血管事件的发生。糖尿病患者中PAI-1水平升高,而PAI-1抑制了纤溶酶原向纤溶酶的转换,导致纤溶活性下降,进一步导致了高凝状态的发生[11]。一项18年的长期研究发现HbA1c与PAI-1水平呈正相关,与t-PA水平呈负相关,提示了血糖在纤溶功能调节中的作用[12]。本研究中3组血浆t-PA、PAI-1水平差异有统计意义。高血压合并糖尿病组、高血压组与对照组比较,血浆t-PA水平明显下降、PAI-1水平明显升高,高血压合并糖尿病组与高血压组比较,血浆t-PA水平明显下降、PAI-1水平明显升高,表明原发性高血压患者存在着纤溶功能的紊乱,而高血压合并糖尿病患者纤溶功能的紊乱更为显著。高血压合并糖尿病患者t-PA水平下降、PAI-1水平升高与其内皮功能不全、高糖以及胰岛素抵抗有关[13]。
综上,老年原发性高血压合并糖尿病患者存在着血管内皮损伤、凝血系统的活化以及纤溶活性的下降,这些改变与心脑血管并发症的发生发展密切相关,在这些患者中应定期监测上述指标,给予必要干预,预防血栓栓塞性并发症的发生。
[1]Małyszko J,Tymcio J.Thrombin activatable fibrinolysis inhibitor and other hemostatic parameters in patients with essential arterial hypertension[J].Pol Arch Med Wewn,2008,118(1-2):36-41.
[2]Spiel AO,Gilbert JC,Jilma B.Von willebrand factor in cardiovascular disease:focus on acute coronary syndromes[J].Circulation,2008,117(11):1449-1459.
[3]Guthold M,Liu W,Sparks EA,et al.A comparison of the mechanical and structural properties of fibrin fibers with other protein fibers[J].Cell Biochem Biophys,2007,49(3):165-181.
[4]Corrado E,Rizzo M,Coppola G,et al.An update on the role of markers of inflammation in atherosclerosis[J].J Atheroscler Thromb,2010,17(1):1-11.
[5]Tabak O,Gelisgen R,Uzun H,et al.Hypertension and hemostatic/fibrinolytic balance disorders[J].Clin Invest Med,2009,32(6):E285-E292.
[6]Guardado-mendoza R,Jimenez-ceja L,Pacheco-carrasco MF,et al.Fibrinogen is associated with silent myocardial ischaemia in type 2 diabetes mellitus[J].Acta Cardiol,2009,64(4):523-530.
[7]Oliver JJ,Webb DJ,Newby DE.Stimulated tissue plasminogen activator release as a marker of endothelial function in humans[J].Arterioscler Thromb Vasc Biol,2005,25(12):2470-2479.
[8]Remková A,Kratochvíl'ová H,Durina J.Impact of the therapy by renin-angiotensin system targeting antihypertensive agents perindopril versus telmisartan on prothrombotic state in essential hypertension[J].J Hum Hypertens,2008,22(5):338-345.
[9]Brown NJ.Blood pressure reduction and tissue-type plasminogen activator release[J].Hypertension,2006,47(4):648-649.
[10]Giannarelli C,Virdis A,De NF,et al.Tissue-type plasminogen activator release in healthy subjects and hypertensive patients:relationship with beta-adrenergic receptors and the nitric oxide pathway[J].Hypertension,2008,52(2):314-321.
[11]Coagulation DS,Function P.Andfibrinolysis associated with syndromes of insulin resistance[J].Coron Artery Dis,2005,16(8):473-476.
[12]Seljeflot I,Larsen JR,Dahl-jørgensen K,et al.Fibrinolytic activity is highly influenced by long-term glycemic control in type 1 diabetic patients[J].J Thromb Haemost,2006,4(3):686-688.
[13]Stegenga ME,Van CD,Dessing MC,et al.Effect of acute hyper glycaemia and/or hyperinsulinaemia on proinflammatory gene expression,cytokine production and neutrophil function in humans[J].Diabet Med,2008,25(2):157-164.

