不同因素致亚健康大鼠血液生化、血气电解质指标的影响
王德军,陶 涛,朱科燕,屠 珏,潘颖颖,艾秀峰,肖 慧,潘永明,陈民利
(浙江中医药大学动物实验研究中心/比较医学研究中心,杭州 310053)
亚健康是处于健康与疾病之间可相互转化的中间状态,一般存在一些轻微的早期生化改变,并无器质性损害,临床上通常会表现出不适、活力降低等生理状态[1]。据统计,我国已有超过7亿的人群处于亚健康状态,占全国总人数的60% ~70%,且该比例有继续上升的趋势[2]。目前临床上用于亚健康状态的诊断和评估方法有许多种,但主要分为以下三类:症状标准诊断法、量化诊断法、MDI健康评估法[3]。而量化诊断法中的一种常规的检查方式,即体液微观筛查技术,就是对血液代谢性指标,心肌酶谱等生化指标进行检测。由于亚健康状态的诱因有众多,如疲劳、不良生活方式、工作压力等,不同因素诱导产生的亚健康状态的临床症状与实验室检测指标均有所不同[4]。因此,本文采用热水游泳、睡眠剥夺和束缚等单因素或多因素方式建立亚健康状态大鼠,观察亚健康状态大鼠的血液生化、血气电解质指标的变化,为进一步了解不同成因对临床亚健康状态形成的影响机制奠定基础。
1 材料和方法
1.1 实验动物
雄性SPF级Wistar大鼠,体重为(150~170)g,60只,购自上海斯莱克实验动物有限公司[SCXK(沪)2007-0005],饲养于浙江中医药大学动物实验研究中心屏障系统内[SYXK(浙)2008-0115],环境温度为(23±1)℃,相对湿度为50% ~65%,饲喂全价营养颗粒饲料,自由饮水。
1.2 主要仪器与试剂
7020日立全自动生化分析仪,日本日立株式会社;NOVA血气电解质分析仪,美国 NOVA公司;丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总蛋白(TP)、白 蛋 白 (ALB)、尿 素 氮 (BUN)、肌 酐(CREA)、血糖(GLU)、总胆固醇(TC)、甘油三酯(TG)、肌酸磷酸激酶(CK)、乳酸脱氢酶(LDH)等试剂盒由上海申能德赛技术诊断有限公司生产,血气试剂包由美国NOVA公司生产。
1.3 分组及造模处理方法
大鼠适应性饲养1周后,按体重随机分成5组,即多因素组(multifactor group,MF)、热水游泳组(warm swimming group,WS)、睡眠不足组(sleep deficiency group,SD)、单纯束缚组(purely constraint group,PC)和正常对照组(control group,C),每组12只。各组处理方法如下:MF组大鼠每天在水温(43±0.5)℃的水槽中游泳3 min,之后擦干被毛,将大鼠放置睡眠剥夺装置中剥夺睡眠10 h,随后放回饲养笼中,并在晚上19∶00加入足量的普通饲料,暴食1 h后取出剩余饲料;SW组大鼠每天在水温(43±0.5)℃的水槽中游泳3 min,之后擦干被毛放回饲养笼中,正常饲养;SD组大鼠每天上午开始睡眠剥夺10 h,之后放回饲养笼中正常饲养;PC组大鼠每天下午放入束缚桶内限制活动3 h;C组大鼠不做任何处理,正常饲养;造模5 d后,各组处死6只,剩余动物进行恢复饲养3 d后处死。
1.4 指标观察
分别在造模结束后和恢复3 d时,将大鼠用3%的戊巴比妥钠溶液0.1 mL/100 g腹腔注射麻醉,麻醉后打开腹腔,取腹主动脉肝素抗凝血0.5 mL测定大鼠动脉血气电解质指标;取腹主静脉血离心血清,测定血清中 ALT、AST、TP、ALB、BUN、CREA、GLU、TC、TG、CK和 LDH等指标,所有操作均按试剂盒说明书进行。
1.5 统计学方法
2 结果
2.1 不同因素致亚健康模型大鼠肝肾功能的影响
与正常对照(C)组比,造模5 d后多因素(MF)组的大鼠 BUN水平显著降低(P<0.05),同时CREA水平显著升高(P<0.01),恢复3 d后,MF组的大鼠ALT、ALB和BUN水平均明显高于C组(P<0.05);而其它各模型大鼠的肝肾功能均未见明显变化(P>0.05),见表1。
2.2 不同因素致亚健康模型大鼠糖脂代谢和心肌酶的影响
与正常对照(C)组比,造模5 d后各模型组的大鼠GLU浓度均显著升高(P<0.01);多因素(MF)组的大鼠血清中 AST、CK、CK/AST比值和LDH水平均显著升高,并且TG水平显著降低(P<0.01);热水游泳(WS)组的大鼠血清中 TC、CK、CK/AST比值和LDH水平亦升高显著(P<0.01);恢复3 d后,MF组TC含量明显升高(P<0.01),且MF组和WS组的大鼠血清 AST、CK、CK/AST比值和LDH水平仍显著高于C组(P<0.01),睡眠不足(SD)组的大鼠CK亦显著高于 C组(P<0.05),其余各模型大鼠 AST、CK、CK/AST和 LDH均略高于C组,但差异不显著(P>0.05);见表2。
2.3 不同因素致亚健康模型大鼠血气指标的影响
与正常对照(C)组比,造模5 d后多因素(MF)组、睡眠不足(SD)组和单纯束缚(PC)组的大鼠PCO2、Hct和 Hb明显升高(P <0.05,P <0.01),同时,热水游泳(WS)组 Hct和 Hb亦升高显著(P<0.01),但MF组的大鼠PO2和SO2%均显著降低(P<0.05);恢复3 d后,除各造模大鼠的血液pH值和PO2均明显下降(P<0.05,P<0.01)外,MF组、SD组和PC组的大鼠PCO2升高并伴有SO2%的降低(P<0.05,P<0.01),见表 3。
表1不同因素致亚健康模型大鼠肝肾功能的影响ˉ±s,n=6)Tab.1 Effects of different factors on liver and kidney function in the sub-health model rats
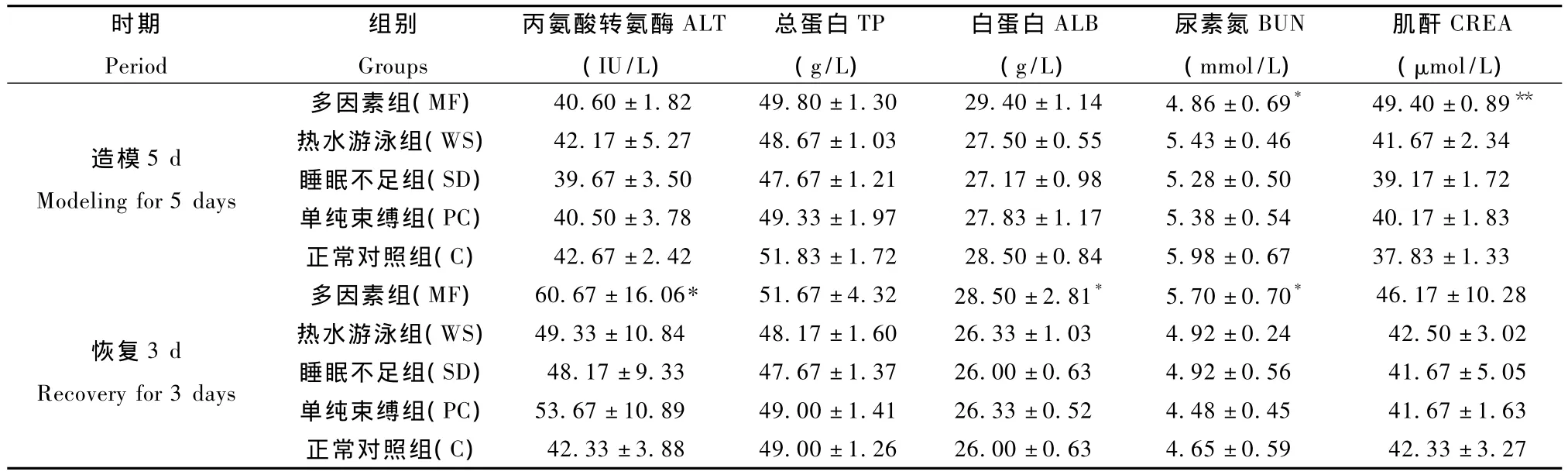
表1不同因素致亚健康模型大鼠肝肾功能的影响ˉ±s,n=6)Tab.1 Effects of different factors on liver and kidney function in the sub-health model rats
注:与正常对照(C)组比,*P <0.05,**P <0.01.Note:Compared with the control group,*P <0.05,**P <0.01.
时期Period组别Groups丙氨酸转氨酶ALT(IU/L)总蛋白TP(g/L)白蛋白ALB(g/L)尿素氮BUN(mmol/L)肌酐CREA(μmol/L)造模5 d Modeling for 5 days多因素组(MF) 40.60±1.82 49.80±1.30 29.40±1.14 4.86±0.69* 49.40±0.89**热水游泳组(WS) 42.17±5.27 48.67±1.03 27.50±0.55 5.43±0.46 41.67±2.34睡眠不足组(SD) 39.67±3.50 47.67±1.21 27.17±0.98 5.28±0.50 39.17±1.72单纯束缚组(PC) 40.50±3.78 49.33±1.97 27.83±1.17 5.38±0.54 40.17±1.83正常对照组(C) 42.67±2.42 51.83±1.72 28.50±0.84 5.98±0.6737.83±1.33恢复3 d Recovery for 3 days 42.33±3.27多因素组(MF) 60.67±16.06* 51.67±4.32 28.50±2.81* 5.70±0.70* 46.17±10.28热水游泳组(WS) 49.33±10.84 48.17±1.60 26.33±1.03 4.92±0.24 42.50±3.02睡眠不足组(SD) 48.17±9.33 47.67±1.37 26.00±0.63 4.92±0.56 41.67±5.05单纯束缚组(PC) 53.67±10.89 49.00±1.41 26.33±0.52 4.48±0.45 41.67±1.63正常对照组(C) 42.33±3.88 49.00±1.26 26.00±0.63 4.65±0.59
表2不同因素致亚健康模型大鼠糖脂代谢和心肌酶的影响(ˉ±s,n=6)Tab.2 Effects of different factors on blood sugar and lipid metabolism and myocardial enzymes in the sub-health model rats
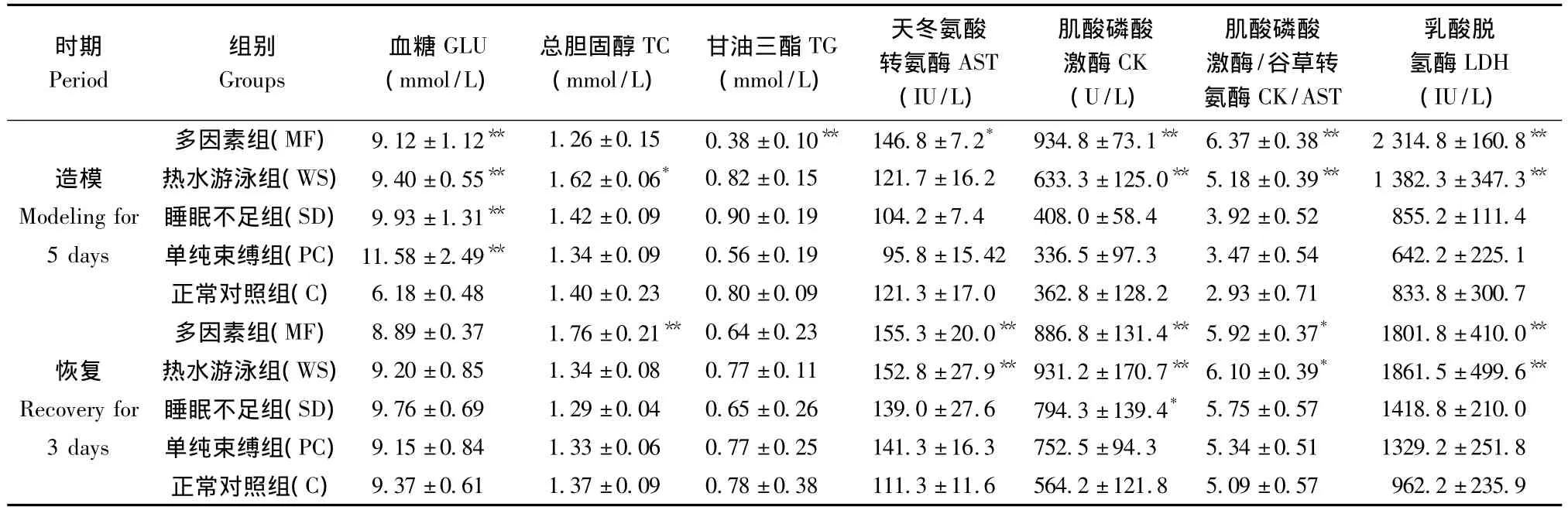
表2不同因素致亚健康模型大鼠糖脂代谢和心肌酶的影响(ˉ±s,n=6)Tab.2 Effects of different factors on blood sugar and lipid metabolism and myocardial enzymes in the sub-health model rats
注:与正常对照(C)组比,*P <0.05,**P <0.01.Note:Compared with the control group,*P <0.05,**P <0.01.
时期Period组别Groups血糖GLU(mmol/L)总胆固醇TC(mmol/L)甘油三酯TG(mmol/L)天冬氨酸转氨酶AST(IU/L)肌酸磷酸激酶CK(U/L)肌酸磷酸激酶/谷草转氨酶CK/AST乳酸脱氢酶LDH(IU/L)多因素组(MF) 9.12 ±1.12** 1.26 ±0.15 0.38 ±0.10** 146.8 ±7.2* 934.8 ±73.1** 6.37 ±0.38** 2 314.8 ±160.8**4.2±121.8 5.09±0.57 962.2±235.9造模 热水游泳组(WS) 9.40±0.55** 1.62±0.06* 0.82±0.15 121.7±16.2 633.3±125.0** 5.18±0.39** 1 382.3±347.3**Modeling for 睡眠不足组(SD) 9.93±1.31** 1.42±0.09 0.90±0.19 104.2±7.4 408.0±58.4 3.92±0.52 855.2±111.4 5 days 单纯束缚组(PC)11.58±2.49** 1.34±0.09 0.56±0.19 95.8±15.42 336.5±97.3 3.47±0.54 642.2±225.1正常对照组(C) 6.18±0.48 1.40±0.23 0.80±0.09 121.3±17.0 362.8±128.2 2.93±0.71 833.8±300.7多因素组(MF) 8.89±0.37 1.76±0.21** 0.64±0.23 155.3 ±20.0** 886.8 ±131.4** 5.92±0.37* 1801.8±410.0**恢复 热水游泳组(WS) 9.20±0.85 1.34±0.08 0.77±0.11 152.8 ±27.9** 931.2 ±170.7** 6.10±0.39* 1861.5±499.6**Recovery for 睡眠不足组(SD) 9.76±0.69 1.29±0.04 0.65±0.26 139.0±27.6 794.3±139.4* 5.75±0.57 1418.8±210.0 3 days 单纯束缚组(PC) 9.15±0.84 1.33±0.06 0.77±0.25 141.3±16.3 752.5±94.3 5.34±0.51 1329.2±251.8正常对照组(C) 9.37±0.61 1.37±0.09 0.78±0.38 111.3±11.6 56
表3不同因素致亚健康模型大鼠血气指标的影响(ˉ±s,n=6)Tab.3 Effects of different factors on blood gas parameters in the sub-health model rats
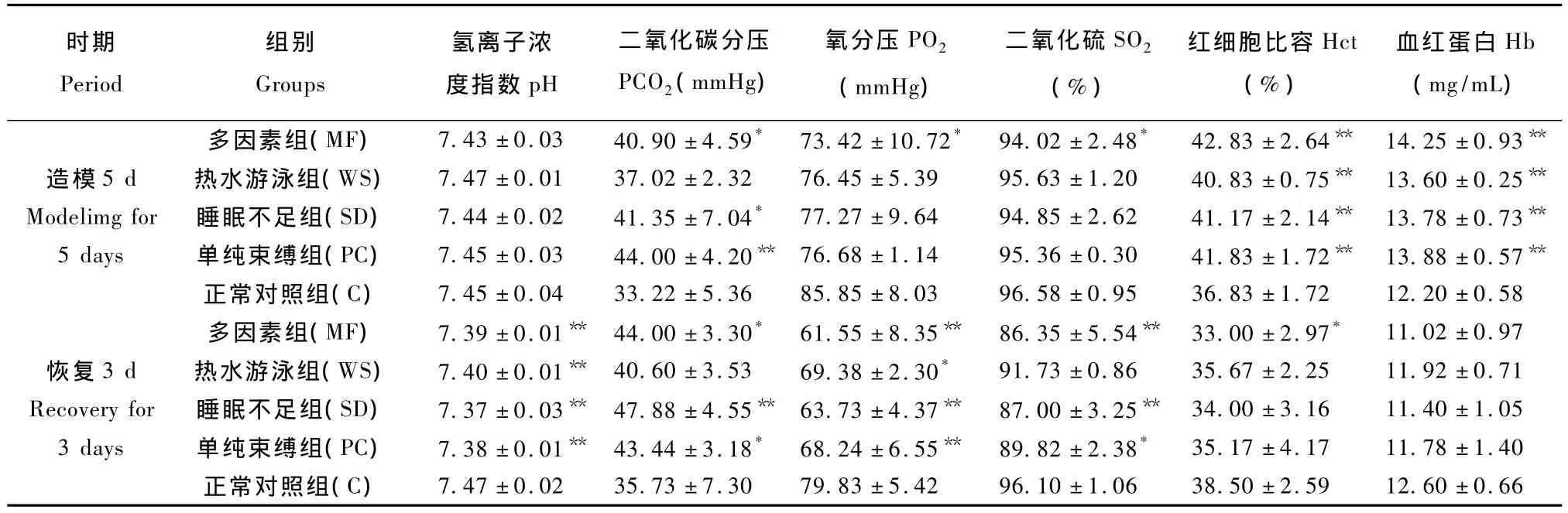
表3不同因素致亚健康模型大鼠血气指标的影响(ˉ±s,n=6)Tab.3 Effects of different factors on blood gas parameters in the sub-health model rats
注:与正常对照(C)组比,*P <0.05,**P <0.01.Note:Compared with the control group,*P <0.05,**P <0.01.
时期Period组别Groups氢离子浓度指数pH二氧化碳分压PCO2(mmHg)氧分压PO2(mmHg)二氧化硫SO2(%)红细胞比容Hct(%)血红蛋白Hb(mg/mL)多因素组(MF) 7.43 ±0.03 40.90±4.59* 73.42 ±10.72* 94.02±2.48* 42.83±2.64** 14.25±0.93**38.50 ±2.59 12.60 ±0.66造模 5 d 热水游泳组(WS) 7.47 ±0.01 37.02 ±2.32 76.45 ±5.39 95.63 ±1.20 40.83 ±0.75** 13.60 ±0.25**Modelimg for 睡眠不足组(SD) 7.44 ±0.02 41.35 ±7.04* 77.27 ±9.64 94.85 ±2.62 41.17 ±2.14** 13.78 ±0.73**5 days 单纯束缚组(PC) 7.45 ±0.03 44.00 ±4.20** 76.68 ±1.14 95.36 ±0.30 41.83 ±1.72** 13.88 ±0.57**正常对照组(C) 7.45 ±0.04 33.22±5.36 85.85 ±8.03 96.58±0.95 36.83±1.72 12.20±0.58多因素组(MF) 7.39 ±0.01** 44.00 ±3.30* 61.55 ±8.35** 86.35 ±5.54** 33.00 ±2.97* 11.02 ±0.97恢复 3 d 热水游泳组(WS) 7.40 ±0.01** 40.60±3.53 69.38 ±2.30* 91.73±0.86 35.67±2.25 11.92±0.71 Recovery for 睡眠不足组(SD) 7.37 ±0.03** 47.88 ±4.55** 63.73 ±4.37** 87.00 ±3.25** 34.00 ±3.16 11.40 ±1.05 3 days 单纯束缚组(PC) 7.38 ±0.01** 43.44 ±3.18* 68.24 ±6.55** 89.82 ±2.38* 35.17 ±4.17 11.78 ±1.40正常对照组(C) 7.47 ±0.02 35.73±7.30 79.83 ±5.42 96.10±1.06
表4不同因素致亚健康模型大鼠电解质指标的影响(ˉ±s,n=6)Tab.4 Effects of different factors on electrolytes parameters in the sub-health model rats
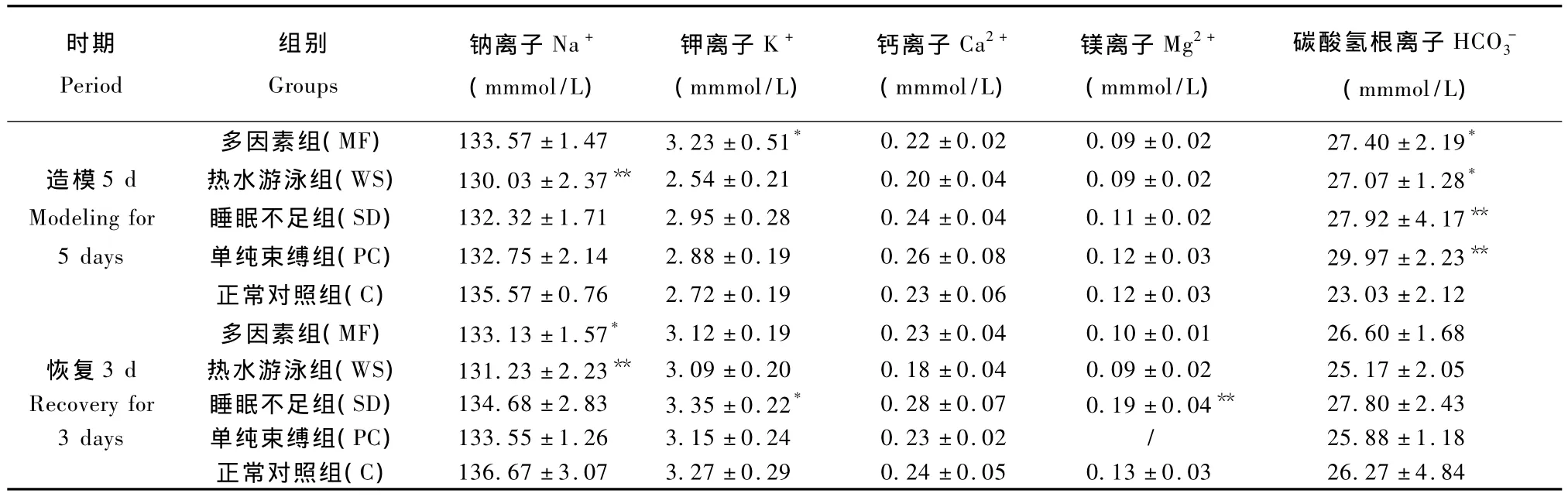
表4不同因素致亚健康模型大鼠电解质指标的影响(ˉ±s,n=6)Tab.4 Effects of different factors on electrolytes parameters in the sub-health model rats
注:与正常对照(C)组比,*P <0.05,**P <0.01.Note:Compared with the control group,*P <0.05,**P <0.01.
时期Period组别Groups钠离子Na+(mmmol/L)钾离子K+(mmmol/L)钙离子Ca2+(mmmol/L)镁离子Mg2+(mmmol/L)碳酸氢根离子HCO-3(mmmol/L)多因素组(MF) 133.57±1.47 3.23±0.51* 0.22±0.02 0.09 ±0.02 27.40±2.19*6.27 ±4.84造模 5 d 热水游泳组(WS) 130.03±2.37** 2.54±0.21 0.20±0.04 0.09 ±0.02 27.07±1.28*Modeling for 睡眠不足组(SD) 132.32 ±1.71 2.95 ±0.28 0.24 ±0.04 0.11 ±0.02 27.92 ±4.17**5 days 单纯束缚组(PC) 132.75 ±2.14 2.88 ±0.19 0.26 ±0.08 0.12 ±0.03 29.97 ±2.23**正常对照组(C) 135.57±0.76 2.72±0.19 0.23±0.06 0.12 ±0.03 23.03±2.12多因素组(MF) 133.13±1.57* 3.12±0.19 0.23±0.04 0.10 ±0.01 26.60±1.68恢复 3 d 热水游泳组(WS) 131.23±2.23** 3.09±0.20 0.18±0.04 0.09 ±0.02 25.17±2.05 Recovery for 睡眠不足组(SD) 134.68±2.83 3.35±0.22* 0.28±0.07 0.19±0.04** 27.80±2.43 3 days 单纯束缚组(PC) 133.55±1.26 3.15±0.24 0.23±0.02 / 25.88±1.18正常对照组(C) 136.67±3.07 3.27±0.29 0.24±0.05 0.13 ±0.03 2
2.4 不同因素致亚健康模型大鼠电解质指标的影响
3 讨论
随着人类社会的高速发展和生活方式的改变,亚健康将是危险人类健康的最大敌人之一[5],由于其隐匿性和潜伏期长的特点,容易忽视其危害性。随着现代医学模式的转变和健康观念的更新,亚健康问题逐渐成为医学研究的热点。当前对亚健康状态的形成原因还不明确,可能会由多种因素引起,而引起的主要症状往往有多个,临床表现多样复杂且不固定,因此,如何切实有效、准确客观评价和诊断亚健康状态一直是该研究领域的难点。本文前期采用热水游泳、睡眠不足和束缚等方法进行建模,能够很好的模拟人类临床上躯体疲劳、生活方式不良、心理应激、社会压力大等亚健康的形成原因,而中医理论认为亚健康形成以气虚、气郁及湿证为主,情志失调是亚健康发生的重要因素[6],故我们认为通过血液微环境的改变很有可能是了解机体亚健康状态的重要的定量指标,并能有效评估亚健康状态的气血状态。
本研究结果显示,多因素大鼠的肌酐浓度有显著增高,这可能与肾脏的排泄功能降低有关。有报道显示,肾小球滤过率的降低,肾小管重吸收作用的选择性降低可能会导致临床上CREA浓度的升高[7]。因此,相对于单因素诱导亚健康模型大鼠,多因素诱导的亚健康状态更易使机体代谢负荷增加或加重。另外,研究发现运动负荷的大小、肌肉酸痛与血清中 CK水平高度相关[8]。正常情况下,肌细胞膜结构完整,功能正常,使CK极少渗出细胞膜而进入血液,但在剧烈运动时,无论是大强度还是低强度的训练都会促使细胞内CK释放,进入血液使血清中CK浓度升高。本实验中热水游泳和多因素复合诱导的亚健康状态大鼠的血液CK浓度升高的机制可能与此相关。此外,在测量代谢水平时,还发现各亚健康状态大鼠的血糖浓度和 CK/AST的比值明显升高,提示亚健康状态使易导致机体处于明显的应激状态。有研究显示,当机体处于应激时,胰高血糖素、生长激素、肾上腺糖皮质激素促进糖原分解和糖异生过程,从而导致血糖浓度升高[9]。但在实际的生活中,亚健康状态的形成往往可能是由多种因素和多种环节共同诱导作用的结果,本研究也发现多因素诱导的亚健康状态除上述指标明显的变化外,血液生化指标也伴有诸如TG、AST、LDH等水平的改变,这与临床上亚健康状态人群常伴有轻度或临界的代谢异常[10]较为符合,也表明亚健康状态出现的糖、脂代谢紊乱是气虚血瘀证候的重要生物学基础[11]。
血气分析显示,不同因素致亚健康状态大鼠的Hct和Hb均有显著的升高,提示大鼠出现较明显的应激变化。据资料显示[12],应激引起 Hct升高的原因可能是动物由于受到不同因素的刺激,脾脏内受体激动,促使高浓缩血液排出,从而使血液浓缩。另外,可能由于长时间大强度持续反复的应激反应,引起模型动物的大量出汗,水分丢失,从而造成血浆容量及血容量减少血液浓缩HCT升高。Hb的升高伴随着Hct的升高,从而提高血液携氧量,适应应激后的代谢需要,具有重要的生理意义。临床研究显示,亚健康状态临床上常见的证候为脾气虚弱等,且脾虚患者的红细胞膜上CoA受体有异常变构,从而引起红细胞膜带Ⅲ蛋白发生变构,不能正常进行阴离子交换而缺氧。本研究结果显示,各亚健康状态大鼠的浓度升高可能与此有关[13]。且热水游泳、睡眠不足、以及多因素组大鼠伴有Na+、K+、Mg2+等离子的改变,这可能应激引起的钠钾泵工作异常有关。
此外,我们也发现处于恢复期的亚健康大鼠的pH、PO2、SO2等出现持续的降低,并伴有 PCO2和LDH的升高,说明亚健康状态体液酸碱平衡出现紊乱和气虚证候,且即使采取有效的适应性休息亦不能有效缓解亚健康状态的疲劳和乳酸积聚等各种症状和指标的迅速恢复。因此,采取有效的中药干预可能有效缓解这些症状的发生[14]。
综上所述,采用不同因素诱导的亚健康状态大鼠的血液生化、血气电解质指标均出现了不同程度上的改变,并与临床上亚健康状态出现的症状较为一致;并在这些诱导因素中以睡眠不足相关的引起亚健康状态相对较为严重,故通过血液生化和血气电解质指标可有效评估亚健康状态机体血液微环境的改变,为亚健康状态的有效干预提供可靠地诊断技术和方法。
亚健康状态是人的身心情感处于疾病与健康之间的一种健康低质状态,这种状态不是界于健康与疾病之间的一个“边缘”,而是一个很宽的“过渡带”。本文用热水游泳、睡眠不足和束缚等模拟人类临床上躯体疲劳、生活方式不良、心理和社会压力加重造成的脑力和体力的透支而导致亚健康状态,但仅进行了造模5 d和停止造模后恢复3 d的检测,而未进行造模过程的动态检测和延长恢复时间后的检测,对亚健康状态形成过程和发展过程的动态变化仍未能了解,有待进一步探讨。
[1] 袁云娥,吴小苏,谭燕.亚健康概念及其研究进展[J].中国医院,2004,8(4):55-59.
[2] 夏忠诚,李敬会,赵霞.中医药防治亚健康状态刍议[J].辽宁中医药大学学报,2011,13(1):93-95.
[3] 陈文锋.亚健康状态的研究近况[J].中国中医药现代远程教育,2010,8(17):268-270.
[4] Spiegel K,Leproult R,van Cauter E.Impact of sleep debt on metabolic and endocrine function[J]. Lancet.1999,354(9188):1435-1439.
[5] 王光辉,王琦,薛俊宏,等.亚健康干预的现状与进展[J].世界中西医结合杂志,2010,5(10):908-903.
[6] 王利敏,赵歆,陈家旭,等.亚健康状态综合评价指标体系研究思路探析[J].华中医药杂志,2010,25(2):180-183.
[7] 湖南医学院第二附属医院检验科.临床生化检验[M].长沙:湖南人民出版社.1981:197.
[8] Mazzone G,Vignola G,Giammarco M,et al.Effects of loading methods on rabbit welfare and meat quality[J].Meat Science.2010,85:33-39.
[9] 毛晓明,刘志民.氧化应激在糖尿病糖代谢中的作用[J].江苏医药,2005,31(3):212-213.
[10] 夏本立,曹东萍,于正军.亚健康防治指南[M].北京:人民军医出版社,2006.
[11] 扈新刚,张允岭,郑宏,等.气虚血瘀大鼠模型糖、脂代谢及氧化应激反应研究[J].北京中医药大学学报,2009,4:249-251.
[12] 林广玲,黄林锋,邱树彬.2型糖尿病与凝血功能障碍[J].中国血液流变学杂志,2005,1(51):86-88.
[13] 杨志强,张兰.运动性脾胃失调动物模型的建立和机理探讨[J].中医药学刊,2002,20(1):92-93.
[14] 冷晓霞,朱科燕,周卫民,等.心理应激致亚健康状态大鼠的血气、电解质代谢及中药的干预效应[J].浙江中医药大学学报,2009,33(6):754-755.

