湿痹通对大鼠急性痛风性关节炎模型抗炎作用机制的探讨
姚 红,杨飞燕,刘昌盛,陈瑞旦,童 娟
(广州医学院第一附属医院,广东 广州510120)
痛风性关节炎(gouty arthritis)又称为尿酸性关节炎,是由尿酸钠(monosodiumurate,MSU)在关节腔内形成微晶体沉淀,引起非特异性关节炎症,痛风最常见的表现形式是以关节红肿热痛的炎症反应为主[1],属于中医学“痹症”之风湿热痹范畴。现代医学研究显示:急性痛风性关节炎发作与自身免疫介导的免疫炎症反应有关。在痛风性关节炎急性发作时,尿酸盐晶体刺激血液中单核细胞和关节滑液中的多形核白细胞引起白介素-1(interleukin-1 IL-1)的大量释放是急性痛风性关节炎发作的特点,故IL-1 是急性痛风性关节炎的一个重要炎症介质[2],关节内主要是以白细胞介素-1β(IL-1β)形式存在,在痛风性关节炎的发病过程中起重要作用[3]。但关于中医药治疗痛风性关节炎的实验研究中,重点往往关注药物对人体内血尿酸浓度的影响,而忽略了中药抗炎作用的效应。本实验用尿酸钠晶体注射大鼠踝关节内诱导急性痛风性关节炎模型,主要观察湿痹通对模型大鼠关节炎症程度、血清内及关节内IL-1 及IL-1R 水平的影响,现将实验方法及结果报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 Wistar 大鼠40 只,雄性,180~200 g(由南方医科大学实验动物中心提供,生产许可证号为scxk 粤2006-0015),饲养环境:广州医学院实验动物中心SPF 级实验室(许可证:4402100561)。
1.1.2 药物 湿痹通由广州医学院第一附属医院制剂室提供(为院内制剂,由七叶莲、土茯苓、萆薢组成,经煎煮后减压浓缩至2 g/mL,冰箱保存备用)。秋水仙碱(50 mg/片,西双版纳药业有限公司生产,No.H53021369)。
1.1.3 试剂 尿酸钠(美国Sigma 公司);大鼠IL-1及白细胞介素-1R(IL-1R)ELISA 试剂盒(购自深圳晶美生物工程有限公司);大鼠免疫组化试剂盒(购自广州杰特伟生物科技有限公司),抗IL-1β 抗原(ab109555 Abcam 抗体),抗IL-1R 抗原(ab106278 Abcam 抗体),DAB 显色试剂盒。
1.1.4 仪器 DF-110 型电子分析天平(德国Sartorius 公司生产);游标卡尺 (上海实业有限公司生产);光学显微镜(日本Olympus 公司生产);pH 计(编号DECTA320,瑞士梅勒公司生产);套式恒温器(GB2292 型,美国Janis 公司生产);振荡混合器(上海医学仪器厂生产);高速冷冻离心机 (型号KR-180 FA,上海医学仪器厂生产);鲎试验微生物检测仪ELx808(配套IU)(厦门市鲎试剂实验厂有限公司生产);TALgent 专业分析软件(厦门市鲎试剂实验厂有限公司生产)。
1.2 方法
1.2.1 尿酸钠结晶及尿酸钠溶液的制备 无菌条件下将800 mg 尿酸钠和155 mL 生理盐水混合,置于烧瓶中用电炉加热煮沸至尿酸钠完全溶解,迅速小滴滴入1 mol/L 的盐酸调整pH 6.8~7.2,自然降温后于3 000 r/min 离心,离心至晶体不再析出后,置于4 ℃冰箱保存备用,用前离心后再将晶体混悬于PBS 中配成所需浓度,采用鲎试剂动态浊度法检测内毒素(内毒素<0.062 5 Eu/mL)。
1.2.2 药物制备 将七叶莲、土茯苓、萆薢3 味药按等剂量比列放置在套式恒温器中,加入10 倍药材量的蒸馏水,武火煮沸后改文火煎煮2 h,滤出药液,药渣加入8 倍蒸馏水继续煎煮2 h,两次滤液合并,蒸馏悬蒸浓缩药液至2 g/mL,冰箱保存备用,用前加蒸馏水配成所需浓度。
1.2.3 动物模型的制备 采用改良后的Cdoerre大鼠动物模型造模方法[4]。大鼠腹腔注射水合氯醛30 mg/kg 麻醉,选受试大鼠左侧踝关节背侧,常规消毒后,用4.5 号注射针与胫骨成45°方向插入踝关节,将0.1 mL 尿酸钠溶液(50 mg/mL)注入到踝关节腔,形成大鼠关节局部红肿热痛并不同程度的跛行,即成大鼠急性痛风性关节炎模型。
1.2.4 动物分组及给药方法 Wistar 雄性大鼠40只按体重随机分为5 组,每组8 只,给药剂量均按60 kg 成人体表面积换算[5]。设为空白组、模型组、秋水仙碱组[0.009 g/(kg·d)]、湿痹通低剂量组[27 g/(kg·d)]、湿痹通高剂量组[54 g/(kg·d)]。适应性喂养3 d 后开始造模,空白组不做任何处理,余4 组大鼠按照动物模型的制备方法制造大鼠急性痛风性关节炎模型。造模后当天开始连续灌胃7 d,在每天早上9 点秋水仙碱组、湿痹通各剂量组分别灌胃相应药物,空白组及模型组予以蒸馏水10 mL/(kg·d)灌服。于第7 天灌胃后3 h 处死大鼠取材。
1.2.5 炎症指数及功能障碍指数 根据Coderre 炎症指数及功能障碍指数分级评定标准[6],造模后8、72 h 分别观察大鼠炎症指数及功能障碍指数。
①炎症指数分级标准:0 分 正常;1 分 关节皮肤红斑,轻度肿胀,骨性标志可见;2 分 关节明显红肿,骨性标志消失,但肿胀局限于关节部位;3 分 关节以外肢体肿胀;②功能障碍指数分级标准:0 分 正常步态,双足均匀着地;1 分 足着地减轻,足趾未展开,轻度跛行;2 分 足屈起,趾背着地,明显跛行;3 分 足完全离地,三足步态。
1.2.6 血清IL-1、IL-1R 含量的测定 (ELISA 法)大鼠末次灌胃后3 h,用10%水合氯醛以3 mL/kg腹腔麻醉后,腹主动脉取血5 mL,3 000 r/min,离心15 min,分离血清待测。
1.2.7 关节软组织内IL-1β、IL-1R (免疫组化法)石蜡切片常规脱蜡至水化,过氧化氢去内源性酶,胰酶消化暴露抗原,滴加一抗4 ℃孵育过夜,依次滴加生物素标记二抗、酶标记链霉卵白素过氧化物酶,DAB 显色。采用Image Pro-Plus6.0 图像处理分析软件对图片上棕黄色像素点的强度值进行定量分析。在400 倍光镜下每张切片随机选择3 个不重叠视野,将呈现棕黄色区域视为阳性目标,测量出累积光密度总值(IOD SUM),同时测量上述3 个视野的染色阳性面积(area),将IOD SUM 与area 的比值作为平均光密度 (mean density) 值,即mean density=(IOD SUM)/area。
1.3 统计学分析
2 结果
2.1 各组大鼠炎症指数及功能障碍指数积分比较
模型组炎症指数及功能障碍指数积分均比其它各用药组高,差异具有统计学意义(P<0.05)。造模后72 h 比造模后8 h 各组积分明显降低,差异具有统计学意义(P<0.05)。结果见表1。
2.2 各组大鼠血清中IL-1 及IL-1R 含量的比较
各组IL-1 与IL-1R 的含量,模型组高于空白组,差异具有统计学意义(P<0.05),各用药组低于模型组,且差异具有统计学意义(P<0.05)。而各用药组与空白组比较差异无统计学意义(P>0.05),各用药组之间比较差异也无统计学意义(P>0.05)。结果见表2。
表1 各组大鼠炎症指数积分及功能障碍指数积分比较(n=8,±s,分)

表1 各组大鼠炎症指数积分及功能障碍指数积分比较(n=8,±s,分)
注:与模型组比较▲P<0.05;造模后72 h 与8 h 比较※P<0.05。
药物剂量(g/kg)组 别空白组模型组秋水仙碱组湿痹通低剂量组湿痹通高剂量组— —0.009 27 54炎症指数造模后8 h 造模后72 h 0 0 2.5±0.53 1.8±0.71※2.0±0.00▲ 1.0±0.53▲※1.9±0.35▲ 0.9±0.64▲※1.8±0.46▲ 1.0±0.53▲※功能障碍指数造模后8 h 造模后72 h 0 0 2.5±0.53 1.8±0.71※2.1±0.83 0.9±0.83▲※2.0±0.76 0.9±0.64▲※1.9±0.64 0.6±0.74▲※
表2 各组大鼠血清IL-1、IL-1R 含量的比较(n=8,±s,pg/mL)

表2 各组大鼠血清IL-1、IL-1R 含量的比较(n=8,±s,pg/mL)
注:与空白组比较▽P<0.05;与模型组比较▲P<0.05。
组 别空白组模型组秋水仙碱组湿痹通低剂量组湿痹通高剂量组药物剂量(g/kg)— —0.009 27 54 IL-1 0.057±0.006 0.101±0.013▽0.064±0.012▲0.066±0.014▲0.057±0.012▲IL-1R 0.055±0.006 0.079±0.012▽0.058±0.013▲0.066±0.005▲0.056±0.008▲
2.3 各组大鼠关节软组织中IL-1β、IL-1R 表达的比较
模型组、秋水仙碱组、湿痹通各剂量组与空白组的IL-1β、IL-1R 平均光密度值比较均有明显升高,差异具有统计学意义(P<0.01)。各用药组平均光密度值比模型组降低且差异具有统计学意义(P<0.05)。湿痹通低剂量组与秋水仙碱组比较差异无统计学意义(P>0.05),两组与湿痹通高剂量组比较,高剂量组的平均光密度值下降,且差异有统计学意义 (P<0.05)。结果见表3。大鼠关节软组织免疫组化光镜图(见图1~2)。
表3 各组大鼠关节软组织IL-1β、IL-1R 表达的比较 (±s,pg/mL)
表3 各组大鼠关节软组织IL-1β、IL-1R 表达的比较 (±s,pg/mL)
注:与空白组比较#P<0.01;与模型组比较▲P<0.05;与高剂量组比较★P<0.05。
药物剂量(g/kg)组 别空白组模型组秋水仙碱组湿痹通低剂量组湿痹通高剂量组— —0.009 27 54 IL-1β 29.09±19.49 151.09±5.03#122.46±14.55#▲★124.72±13.37#▲★84.44±12.32#▲IL-1R 16.05±15.12 184.82±31.49#132.32±28.65#▲★138.54±7.75#▲★82.47±28.85#▲

图1 各组大鼠关节软组织IL-1β 免疫组化光镜图(×400)
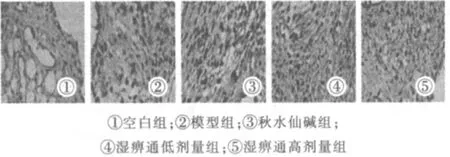
图2 各组大鼠关节软组织IL-1R 免疫组化光镜图(×400)
3 讨论
急性痛风性关节炎是尿酸盐在关节及关节周围组织以结晶形式沉积引起的急性炎症反应。本实验运用公认的大鼠踝关节内注入尿酸钠晶体溶液制备急性痛风性关节炎病变模型的方法,造模后大鼠关节出现红、肿、热和功能障碍等表现,其病理表现与临床急性痛风性关节炎极为相似,充分地模拟了人类急性痛风性关节炎的病变过程。同时,造模后模型组大鼠炎症指数及功能障碍指数积分均比空白组升高(P<0.05),也进一步说明造模方法是成功的。而造模后72 h 比造模后8 h 各组积分有所降低 (P<0.05),预示急性痛风性关节炎的关节炎症在自身免疫调节下有自行缓解的趋势。
在急性痛风性关节炎的炎症反应中,人体免疫系统起到至关重要的作用,尿酸盐晶体刺激血液中单核细胞和关节滑液中的多形核白细胞引起IL-1的大量释放是急性痛风性关节炎发作的特点,是关节破坏的关键细胞因子,在痛风性关节炎的发展过程中起重要作用[7]。IL-1 分为膜结合型白细胞介素-1α(IL-1α)和可溶型(IL-1β)2 种。IL-1β 存在于在关节组织中(包括滑膜、滑液及软骨),是最经典的炎症调节的始动因素[8-9]。有研究表明,IL-1β 作为主要的炎症趋化因子和激活因子,可以活化巨噬细胞、粒细胞,诱导内皮细胞并增强其活性,并可以刺激巨噬细胞、淋巴细胞、内皮细胞合成IL-1β 诱导免疫级联反应[10]。因此对于IL-1 与IL-1R 在体内及关节内含量的比较,可确定急性痛风性关节炎炎症控制的效果。
湿痹通是我们临床以袪湿除痹立法治疗急性痛风性关节炎的基础方,通过观察其对大鼠体内血清及关节组织内IL-1、IL-1R 表达的影响,探讨湿痹通抗炎作用及其机制。实验结果显示:模型组大鼠血清中IL-1、IL-1R 的含量升高,湿痹通与秋水仙碱均能降低血清IL-1、IL-1R 的含量(P<0.05);大鼠关节软组织炎症细胞因子水平的比较提示:湿痹通各剂量组、秋水仙碱组大鼠关节软组织内IL-1β、IL-1R 平均光密度值均低于模型组(P<0.05),说明实验药物对急性痛风性关节炎关节软组织内IL-1β、IL-1R 均具有抑制作用,且湿痹通高剂量组效果更为明显(P<0.01)。说明湿痹通可用于该病的急性期治疗,其作用机制可能通过阻断血清及关节软组织内IL-1、IL-1R 的表达而改善大鼠急性痛风性关节炎的炎症反应有关。
[1]叶仁群,林国彬,宋晓容,等.清热利湿活血法对急性痛风性关节炎患者IL-6 和TNF-α 的影响[J].中华中医药学刊,2012,30(4):845-847.
[2]曹世霞,祝 捷,张三印,等.秦皮总香豆素对急性痛风性关节炎大鼠模型IL-1β、IL-8、TNF-α 的影响[J].四川中医,2011,29(3):68-70.
[3]关雪峰,刘元禄.清热解毒方药对兔膝急性痛风性关节炎细胞因子TNF-α 和IL- 1β 影响的实验研究 [J].中华中医药学刊,2009,27(4):829-831.
[4]姚 丽,刘树民,于书仪.痛风性关节炎动物模型的改良[J].中国实验动物学报,2009,17(3):210-212.
[5]赵 伟,孙国志.不同种实验动物间用药量换算[J].畜牧兽医科技信息,2010,5(12):51-53.
[6]Terkeltaub R.Pathogenesis and treatment of crystal induced inflammation.In: Koopman WJ.Arthritis and allied conditions: a textbook rheumatology [M].Baltimore: William,s and wilkins,1996:2 085-2 102.
[7]Chen CJ,Shi Y,Hearn A,et al.MyD88-dependent IL-1 receptor signaling is essential for gouty inflammation stimulated by monosodium urate crystals.[J].Clin Invest,2006,116 (8):2 262-2 271.
[8]LA O'Neill.The interleukin-1 receptor/Toll-like receptor superfamily:10 years of progress[J].Immunol Rev,2008,226(12):10-18.
[9]吴红娟,孙必强,朱传湘,等.盐酸青藤碱对家兔骨关节炎关节液IL-1β、PGE-2 生成与关节组织结构的影响[J].湖南中医药大学学报,2010,30(9):84-86.
[10]Timmer TC,Baltus B,Vondenhoff M,et a1.Inflammation and eetopic lymphoid structures in rheumatoid arthritis synovial tissues dissected by genomics technology:identification of the interleukin -7signaling pathway in tissues with lymphoid neogenesis[J].Arthritis Rheum,2007,56(8):2 492-2 502.

