检测β1-肾上腺素能受体自身抗体及抗体滴度对顽固性心衰患者的作用
马利祥,王庆胜,张 茗,张双月,巢永波,魏 梅,南潮平,张 华,杨新春
(1.秦皇岛市第一医院 心内科,河北 秦皇岛066000;2.秦皇岛市中铁山桥集团医院;3.首都医科大学附属北京朝阳医院)
由于人群的老龄化、高血压的高发病率和低控制率,溶栓和介入治疗使急性心肌梗塞的死亡率下降等原因,导致顽固性心力衰竭的发生率、住院率明显上升。顽固性心力衰竭是心血管病患者住院和死亡的主要原因。目前已证实心肌细胞β1-AR自身抗体与心力衰竭有关联,自身抗体的出现有可能通过长期影响心脏受体的功能而累及心脏的活动,长期β1-AR自身抗体的过度刺激可能影响心肌损伤和心脏功能,导致心衰的发生[1]。本研究通过检测β1-肾上腺素能受体自身抗体,为指导β1-肾上腺素能受体阻滞剂在顽固性心衰的安全性应用方面,提供一种检测指标的尝试。
1 资料与方法
1.1 研究对象 随机选取2007年1月至2011年1月120例心力衰竭NYHA分级Ⅲ-Ⅵ级患者,病因不限。入选标准:①所有心力衰竭患者14天前未用或停用β-受体阻滞剂,②NYHA分Ⅲ-Ⅵ级,左室射血分数(LVEF)≤40%患者,③能够保持联系坚持长期随访的。排除标准:①并发恶性疾病估计生存期低于3年者,②静息坐位收缩血压<90mm-Hg,③流出道梗阻性疾病,④急性心肌梗死,⑤患有内分泌疾病和自身免疫性疾病,⑥肝和肾功能不全(谷丙转氨酶高于正常上限2倍以上,血肌酐≥3.0 mg/ml),⑦糖尿病伴严重的眼底疾病或肾脏疾病,⑧妊娠或哺乳期女性。
1.2 方法 随即分为两组,A组:比索洛尔首剂1.25mg qd,每两周逐渐加量,直至10mg qd。B组:比索洛尔首剂1.25mg qd,4周逐渐加至5mg qd。余治疗同(ACC/AHA 2005)指南规定用药进行。
1.3 相关指标检测 治疗前、治疗后2周、4周、6周、8周各取肘前静脉血2ml。自身抗体的测定:用间接SA-ELISA(Streptavidin-ELISA)方法测定抗β1-AR自身抗体,抗原肽段由中国科学院生物化学研究所合成。阳性判定:以阳性血清与阴性血清的吸光度之比,即P/N比值来判断,P/N≥2.1为阳性,P/N≤1.5为阴性。P/N=(标本OD值-空白对照OD值)/(阴性对照OD值-空白对照OD值)。抗体滴度的判定:将标本从1:20-1:160起依次倍比稀释,以出现P/N≥2.1的最高稀释度作为该标本的滴度。为保证实验的可靠性,每一样本采用双孔同时测定,批内变异系数为4.6%-5.2%,批间变异系数为8.7%。每次测定均设定空白对照和已知阳性、阴性对照[2,3]。
1.4 统计学处理 统计时抗体效价用几何平均数±标准差表示,计量资料用平均数±标准差表示。统计应用SPSS 12.0统计软件。两组计量资料采用t检验,三组及以上计量资料用方差分析,计数资料采用χ2检验。取α=0.05,双侧检验,以P<0.05为有统计学意义,P<0.01有显著统计学意义。
2 结果
2.1 两组研究对象临床特征 A组60例患者中男性46例,女性14例,年龄66-84(75±3)岁。B组60例中男性52例,女性8例,年龄70-84(77±5)岁。两组患者在年龄、性别、生命体征、心功能分级无统计学差异(表1)。

表1 两组患者入组时的基本临床特征
2.2 两组患者β1-肾上腺素能受体自身抗体及抗体滴度的变化 B组间治疗前与治疗后2周、4周、6周、8周β1-肾上腺素能受体自身抗体及抗体滴度,差异均无统计学意义,但有下降的趋势(P>0.05),A组间治疗前与治疗后2周、4周、6周、8周β1-肾上腺素能受体自身抗体及抗体滴度,差异均无统计学意义,但下降的趋势较A组明显(P>0.05);A、B两组间8周β1-肾上腺素能受体自身抗体及抗体滴度相比降低,两组间差异有统计学意义(P<0.05)(表2)。
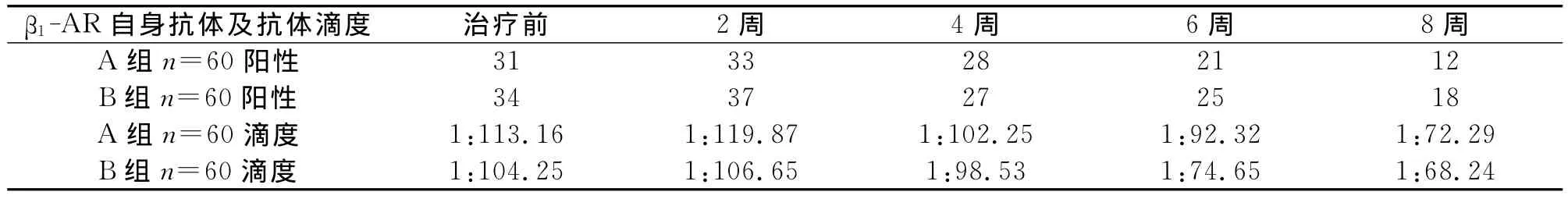
表2 两组患者β1-肾上腺素能受体自身抗体及抗体滴度比较
2.3 两组患者心功能各项指标的比较
B组间治疗前与治疗后2周、4周、6周、8周心功能左室舒张末径及射血分数有改善,2周4周差异均无统计学意义,但有好转的趋势(P>0.05),而6周与治疗前差异有统计学意义(P<0.05),8周与治疗前差异有显著统计学意义(P<0.01),A组间治疗前与治疗后2周、4周、6周、8周心功能左室舒张末径及射血分数有改善,而4周与治疗前差异有统计学意义(P<0.05),8周与治疗前差异有显著统计学意义(P<0.01)。A、B组间8周左室舒张末径及射血分数比较,两组间差异有统计学意义(P<0.05)(表3)。

表3 两组患者心功能各项指标的比较
3 讨论
本研究发现随着比索洛尔治疗量的增加,患者的心功能在逐渐改善。而且β1-肾上腺素能受体自身抗体及抗体滴度随着心功能的改善在第二周先上升然后逐渐下降。升高的的机理目前尚不明确,可能由于加用比索洛尔后,并没有立刻改善心功能,有一过性调整期,随后随着心功能的改善β1-肾上腺素能受体自身抗体及抗体滴度也逐渐下降。
目前认为,慢性心衰是长期心脏重构和神经内分泌过度激活的结果。其中,免疫系统的功能与神经和内分泌的功能密切相关,慢性心衰时由于神经激素的激活,使免疫功能发生改变,心肌细胞膜受体的抗原决定簇可能被心肌重塑过程以某种方式修正,因而产生了针对自身受体的抗体[4,5]。β1-AR自身抗体不仅存在于扩张型心肌病患者,而且广泛存在于各种原因导致的心衰患者血清中,各种心衰患者之间β1-AR自身抗体的滴度也无明显差异[6-8]。本研究在顽固性心衰患者中检测到了β1-AR自身抗体,而且随着比索洛尔的增加β1-AR自身抗体阳性率及滴度有所下降,用量多的下降的更多。通过检测β1-AR自身抗体可以了解β1-AR阻滞剂的应用效果情况,β1-AR自身抗体如果没有变化,可以考虑β1-AR拮抗剂(比索洛尔)剂量未达标,可以增加剂量。本研究并没有看到β1-AR自身抗体阳性率及抗体滴度下降到某一平台期,可能患者心功能有进一步改善的趋势,此平台期是否是β1-AR阻滞剂的维持剂量,及心功能趋于稳定期待进一步实验予以明确。
[1]Magnusson Y,Wallukat G,Waagstein F,et al.Autoimmunity in idiopathic dilated cardiomyopathy.Characterization of antibodies against the beta 1-adrenoceptor with positive chronotropic effect[J].Circulation,1994,89(6):2760.
[2]Liu HR,Zhao RR,Jiao XY,et al.Relationship of Myocardial Remodeling to the Genesis of Serum Autoantibodies to Cardiac Beta1-Adrenoceptors and Muscarinic Type 2Acetylcholine Receptors in Rats[J].J Am Coll Cardiol,2002,39(11):1866.
[3]Jahns R,Boivin V,Krapf T,et al.Modulation of beta1-adrenoceptor activity by domain-specific antibodies and heart failure-associated autoantibodies[J].J Am Coll Cardiol,2000,36(4):1280.
[4]Nikolaev VO,Boivin V,Störk S,et al.A novel fluorescence method for the rapid detection of functional beta1-adrenergic receptor autoantibodies in heart failure[J].J Am Coll Cardiol,2007,50(5):423.
[5]Christ T,Wettwer E,Dobrev D,et al.Autoantibodies against the beta1adrenoceptor from patients with dilated cardiomyopathy prolong action potential duration and enhance contractility in isolated cardiomyocytes[J].J Mol Cell Cardiol,2001,33(8):1515.
[6]Luciano D L,Barbara R,et al.Skeletal muscle myofibrillar protein oxidation in heart failure and the protective effect of carvedilol[J].J Molecular and Celluar Cardiol,2005,38;803.
[7]Herda LR,Felix SB,Boege F.Drug-like actions of autoantibodies against receptors of the autonomous nervous system and their impact on human heart function[J].Br J Pharmacol,2012,1476.
[8]Wang YY,Ma ZY,Li XD,et al.Serum positive for the autoantibody against theβ(1)-adrenoceptor from Chinese patients with congestive heart failure decreases I(ss)in mouse cardiac myocytes[J].Clin Dev Immunol,2011,143517.

