VEGF和端粒酶检测对恶性腹水的诊断价值
于艳芳,段晓辉,张 勇,张瑞英,贾力品,崔星亮,裴志萍
(1.河北工程大学附属医院 血液内科,河北 邯郸056002;2.河北工程大学医学院;3.邯郸市第二医院)
很多原因可以引起腹水,临床医生对腹水性质的诊断比较困难。在确定腹水存在后,明确腹水的良性、恶性一直困扰着临床医生,查找到癌细胞对明确诊段的具有重要意义,但其阳性率尚不尽人意。目前,判断腹水性质的报道很多,方法也不相同。因此,建立新的能诊断腹水良性、恶性的诊断指标,对腹水性质的判定、疾病诊断和治疗具有重要的指导意义。
1 材料与方法
1.1 检测对象 选择2009年10月—2010年12月在河北工程大学附属医院住院确诊为恶性腹水的患者60例(均有腹膜转移)作为病例组,男35例,女25例,平均年龄(56±12.5)岁,其中肝癌28例,胃癌10例,卵巢癌13例,结肠癌8例,胰腺癌1例。选择同一时期入院确诊为良性腹水75例患者作为对照组,男40例,女35例,平均年龄(50±12)岁,其中肝硬化37例,结核性腹水18例,心源性腹水8例,低蛋白血症4例,良性腹膜间皮瘤3例。两组患者年龄、性别方面比较无显著性差异(P>0.05),符合统计学要求。
1.2 主要仪器及试剂 细胞制片机为HZ-36A型全自动液基薄层细胞检测技术(TCT)制片机;羊抗人端粒酶多克隆抗体和鼠抗人血管内皮细胞生长因子(VEGF)多克隆抗体购自北京中山生物技术有限公司;含兔抗羊二抗和兔抗鼠二抗的SABC试剂盒购自福州迈新生物技术开发公司。
1.3 检测方法及结果判定 确定分组患者后,于入院次晨无菌穿刺腹腔收集腹水150-200ml。在收集腹水前均未接受过任何治疗。样品于4℃加1.077g/ml的细胞分离液,3 000r/min离心20 min,吸弃上清,PBS重悬沉淀,1 600r/min离心6 min,洗细胞2次,沉淀物用细胞保存液重悬加入细胞保存瓶,置于-80℃保存。采用全自动TCT制片机制片,免疫细胞化学方法SABC检测VEGF和端粒酶。
1.4 结果判定 染色结果为端粒酶定位于肿瘤细胞核,VEGF位于细胞胞浆,颜色介于淡黄色-棕褐色,所有染色后图片均由固定的二位病理医师双盲法阅片。选取细胞分布均匀区域准确计数200个细胞,统计细胞染色程度和着色细胞个数。计分规则:无色0分,浅色1分,深色2分,计算每个样本总分数。
1.5 数据分析 利用SPSS 11.5软件绘制受试者工作曲线(ROC曲线),计算曲线下面积,根据ROC曲线判断最佳诊断性能(灵敏度与特异度之和最大)时候的界值,并计算阳性预测值、阴性预测值、阳性似然比、阴性似然比和尤登指数(Youden index,YI)。
2 结果
2.1 良性、恶性腹水细胞TCT制片后行SABC细胞化学染色,计算其染色得分分布 恶性腹水的VEGF、端粒酶染色结果均偏向于得分轴的右侧,呈现偏态分布,以大分值为主;良性腹水细胞染色结果呈现正态分布,且其中位数明显小于恶性腹水染色得分中位数(P<0.01),见图1。
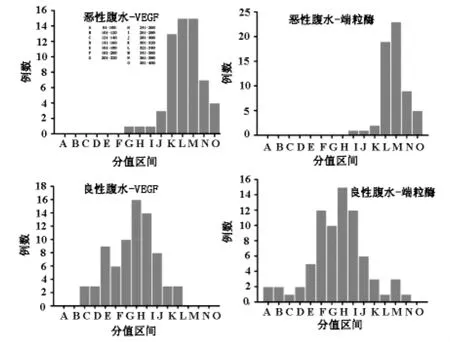
图1 良性、恶性腹水的TCT制片细胞染色得分分布
2.2 VEGF、端粒酶染色得分值 以确诊实验的结果为金标准结果,统计VEGF、端粒酶染色得分值,以此分值为诊断结果,数据输入SPSS11.5软件,绘制ROC曲线,见图2。以SPSS反馈数据得出最佳阳性判断界值为VEGF>300分、端粒酶>320分为阳性,计算两者的诊断性能指标,图2、见表1。
3 讨论
恶性腹水是恶性肿瘤侵袭转移的一种表现,很多非恶性疾病也能引起腹水,如结核病、肝硬化、低蛋白症等。鉴别腹水的良性、恶性一直是临床医生困惑的问题。传统的鉴别腹水性质的方法—灵敏度和特异度都不尽人意,虽然直接检查腹水中的癌细胞具有诊断意义,但是其阳性率不高,容易漏诊。因此,寻求一种高诊断性能的检验方法鉴别诊断腹水的性质显得尤为重要。

图2 ROC曲线

表1 根据ROC曲线计算各性能指标
VEGF是一种促内皮细胞有丝分裂原,能增加血管通透性,促进血管内皮细胞增殖,在恶性腹水的形成中,VEGF扮演着重要的角色[1],有报道称,卵巢癌患者腹水中的VEGF含量明显高于良性腹水中的含量[2],说明检测腹水中VEGF的含量具有鉴别良性、恶性腹水的能力。端粒酶是肿瘤的一个显著特征,其高表达见于各种恶性肿瘤,而正常组织检测不到有活性的端粒酶。据国外报道,98%的肿瘤细胞系、90%的原发肿瘤皆表现出端粒酶活性[3],因此,有人建议用端粒酶来作为恶性肿瘤的标志物,其诊断灵敏度和特异性甚至可以达到90%[4]。VEGF以可溶性细胞因子的形式存在,并可经分泌小泡分泌到细胞外,而端粒酶则存在于细胞核内部,其活性主要表现为对染色质端粒的编辑。
液基薄层细胞学技术是近些年的一项新技术,因其在妇科宫颈疾病诊断方面具有独到的优点而受到国内外学者的广泛青睐[5]。近年来有人将其应用于腹水细胞检查,并且也得到了很高的诊断符合率,且涂片背景清晰,恶性细胞容易分辨,细胞团中单个细胞界限分明,染色清晰,极大地提高了识别的准确度[6]。
本研究收集本院确诊为恶性腹水和良性腹水患者为研究对象,采取细胞内定位半定量检测VEGF和端粒酶的表达。结果显示,恶性腹水患者的腹水细胞VEGF和端粒酶表达明显高于良性腹水的二者表达量(P<0.05,结果另文发表),表达分数呈现偏态分布,分值都比较高。而良性腹水细胞表现为正态分布,但是其中位数要明显小于恶性腹水分布的中位数(P<0.05,结果另文发表)。
对本文收集的135例标本进行SABC细胞化学染色,并统计染色深度评分,绘制ROC曲线显示,曲线下面积VEGF为0.953,端粒酶为0.957,表明二者具有较高的诊断价值。以ROC曲线最接近左上角点的值为最佳诊断指标判定点,其诊断敏感性VEGF为 0.900,端粒酶为 0.933,诊断特异性VEGF为0.920,端粒酶为0.933。且给出以VEGF为检测对象的阳性临界值为300分,端粒酶为320分。此结果表明,采取本研究方法选择最佳的阳性临界值,用VEGF和端粒酶表达为诊断指标鉴别诊断腹水的性质,具有很高的诊断正确度。
由此可见,作为一种辅助检验方法,TCT制片后用细胞免疫化学染色检测判定腹水的良性、恶性具有较好的诊断价值。在高度怀疑恶性腹水,而细胞学检查阴性,且其他检查未发现病变时,可以对腹水细胞行VEGF、端粒酶免疫细胞化学染色,计算染色深浅得分,从而对腹水性质进行判断。
[1]Neulen J,Yan Z,Raczek S,et al.Human chorionic gonadotropin dependent expression of VEGF/VPF in human granulosa cell:Importance in ovarian hyperstimulation syndrome[J].J Clin Endocrihol Metab,1995,(80):1967.
[2]Yamamoto S,Kanishi I,Mandai M,et al.Expression of vascular endothelial growth factor (VEGF)in epithelial ovarian neoplasms:Correlation with clinicopathology and patient survival,and analysis of serum VEGF levels[J].Br J Cancer,1997,76(9):1221.
[3]Kim JL,Piatyxzek MA,Prowse K R,et al.Specific association of human telomerase activity with immortal cells and cancer[J].Science,1994,266:2011.
[4]Dahse R,Fiedler W,Ernst G.Telomeres and telomerase:biological and clinical importance[J].Clin Chem,1997,43:708.
[5]潘秦镜,李凌,乔友林,等.液基细胞学筛查宫颈癌的研究[J].中华肿瘤杂志,2001,23(4):309.
[6]施海法,血管内皮生长因子和端粒酶与恶性腹水的相关性分析[J].疑难病杂志,2010,9(6):448.

