SOX-2和OCT-4在宫颈鳞癌中的表达及临床意义
邓 新,刘书童,车广华,李 允,高 航*
(1.沈阳医学院第三临床学院,辽宁 沈阳110034;2.吉林大学病理生物学教育部重点实验室,吉林 长春130021;3.吉林大学第二医院,吉林 长春130041)
宫颈癌是女性常见的恶性肿瘤之一,占女性生殖系统恶性肿瘤的半数以上。因此,进一步寻找宫颈癌早期诊断的有效指标,对于明确宫颈癌发生、发展的机制有着重要的意义。SOX-2基因参与性别决定、骨组织的发育、血细胞生成等多种早期胚胎发育过程,并且与调控及决定细胞命运有关,是维持干细胞特性的重要基因[1]。OCT-4特异性表达于全能胚胎干细胞,是保持其自我更新和多潜能性的关键分子[2]。但SOX-2及OCT-4在宫颈鳞癌中的表达及临床意义,目前国内外尚无相关研究报道。
1 材料与方法
1.1 研究对象 采集自沈阳医学院第三临床学院妇产科及吉林大学病理学系2009-2010年间手术切除宫颈癌标本46例(高分化21例,中分化17例,低分化8例),全部标本均经病理证实为宫颈鳞癌。所有患者术前均未做化、放疗,临床病例资料完整。病例标本均在肿瘤切除后分为两份,一份放入10%中性福尔马林固定,经石蜡包埋固定后切片,用于免疫组织化学染色,另一部分置于液氮中保存,用于提取组织总RNA进行RT-PCR检测目的基因mRNA的表达水平。
1.2 实验方法
1.2.1 免疫组化法
1.2.1.1 主要试剂 兔抗人SOX-2多克隆抗体、兔抗人OCT-4多克隆抗体(北京博奥森生物技术有限公司),一抗浓度1∶200;SP免疫组化试剂盒(KIT-9710)、DAB显色剂购自福州迈新生物技术开发有限公司,微波炉抗原修复,以PBS代替一抗为阴性对照。
1.2.1.2 评分方法 SOX-2阳性表达标准为胞浆内出现棕黄色或棕褐色颗粒,阴性为细胞胞浆无棕黄色颗粒。OCT-4蛋白阳性表达为细胞核出现棕黄色或棕褐色颗粒,阴性则为细胞核无棕黄色颗粒。在400×视野下采集图像,每张切片选取5个高倍视野(400×),阳性结果判断根据平均每高倍视野阳性癌细胞数占所观察癌细胞总数的百分率。综合染色强度和阳性率进行评分:①染色强度按下列标准评分:阴性0分,染色弱但强于阴性对照者为1分,染色较强为2分;染色强为3分。②阳性率按下列标准评分:无阳性细胞或阳性率<10%为阴性计0分,阳性率<30%为阳性为1分,31%-60%为2分;>60%为3分。上述两种评分相加大于等于3分为阳性(+),4-5分为(++),6分为(+++)[3]。
1.2.2 RT-PCR
1.2.2.1 主要试剂 TRIZOL Reagent(Invitrogen公司),DEPC(北京鼎国公司),2×Taq PCR MasterMix(北京天根生物技术有限公司),MMLV(Fermentas公司),引物由大连宝生物公司合成。
1.2.2.2 评分方法 用内参照(GAPDH)光密度值标化SOX-2、OCT-4mRNA的光密度值进行半定量分析,得到SOX-2mRNA、OCT-4mRNA表达的相对含量。具体计算公式:目的基因相对含量=(目的基因光密度值/GAPDH光密度值)×100%
1.3 统计学方法 所有实验数据用SPSS11.5统计软件进行处理,各组间数据比较采用χ2检验,P<0.05为差异有显著性,P>0.05差异无统计学意义。
2 结果
2.1 免疫组化法检测
2.1.1 SOX-2的蛋白表达 阳性表达以胞浆内出现棕黄色或棕褐色颗粒为判定标准,阴性表达的胞浆内无棕黄色颗粒(见图1)。SOX-2蛋白在正常宫颈组织、高分化宫颈鳞癌、中分化宫颈鳞癌、低分化宫颈 鳞癌组织中阳性率分 别 为 44.5% (4/9)、57.1%(12/21)、82.4%(14/17)、87.5%(7/8)。正常宫颈组织与高分化宫颈鳞癌组织相比较,SOX-2蛋白的表达无显著差异(P>0.05),中低分化宫颈鳞癌与正常宫颈及高分化宫颈鳞癌相比较,差异有显著性,P<0.05。可见随着肿瘤组织分化程度的下降,SOX-2的表达逐渐增强。

图1 SOX-2蛋白在正常宫颈及宫颈鳞癌组织中的表达(SP×400)
2.1.2 OCT-4的蛋白表达 OCT-4蛋白在正常宫颈及宫颈鳞癌组织阳性表达定位于细胞核(见图2)。OCT-4蛋白在正常宫颈组织、高分化宫颈鳞癌、中分化宫颈鳞癌、低分化宫颈鳞癌组织中阳性率分别为0%(0/9)、61.9%(13/21)、64.7%(11/17)、75%(6/8)。正常宫颈组织与各分化程度宫颈鳞癌组织相比较,OCT-4的表达有显著差异(P<0.01);但各分化程度的宫颈鳞癌组织中OCT-4的表达相比较,差异无显著性,P﹥0.05。
2.2 RT-PCR结果
2.2.1 SOX-2mRNA的表达 正常宫颈组织与宫颈鳞癌组织的阳性表达率分别为55.6%(5/9)、76.1%(35/46)。SOX-2mRNA 在正常宫颈组织、高、中、低分化宫颈鳞癌组织中的表达强度分别为0.215±0.013、0.486±0.152、0.872±0.283和0.881±0.136。SOX-2mRNA在正常宫颈组织及不同分化程度宫颈鳞癌组织中的表达有显著性差异(P<0.01)(见图3)。SOX-2mRNA的表达随着病理学分级的下降而表达上调。
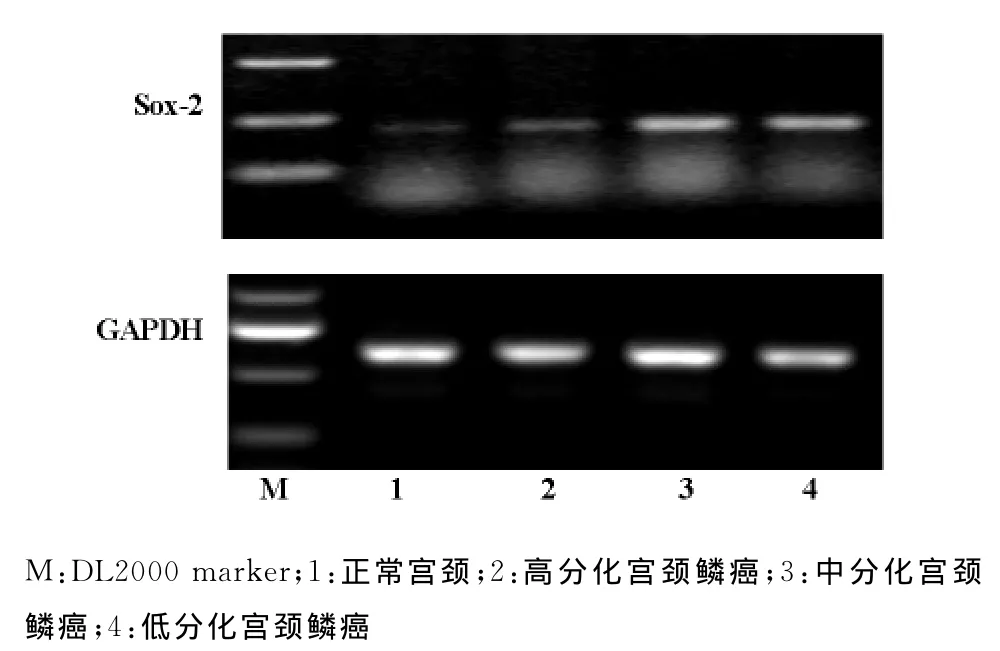
图3 SOX-2mRNA在正常宫颈组织及不同分化程度宫颈鳞癌组织中的表达
2.2.2 OCT-4mRNA 的表达 正常宫颈组织和宫颈鳞癌组织的阳性表达率分别为33.3%(3/9)、58.7%(27/46)。OCT-4mRNA 在正常宫颈组织、高、中、低分化宫颈鳞癌组织中的表达强度分别为0.526±0.275、0.636±0.352、0.875±0.316和1.082±0.519。在正常宫颈组织中 OCT-4mRNA的表达与不同分化程度宫颈鳞癌组织中的表达有显著性差异(P<0.01)(见图4)。但是OCT-4mRNA的表达与病理学分级无关。

图4 OCT-4mRNA在正常宫颈组织及不同分化程度宫颈鳞癌组织中的表达
3 讨论
近年来研究表明,SOX-2本身不仅能维持干细胞的多潜能性,同时其能调节其他干细胞相关的重要转录因子水平,如:OCT-4等,从而共同维持干细胞的多潜能性[4]。SOX-2在许多实体肿瘤中过表达或者表达异常,不仅仅是胚胎和生殖细胞肿瘤,也包括体细胞肿瘤。有实验表明SOX-2在正常结直肠黏膜组织中不表达,在结直肠癌组织中有较高的阳性表达率,并且结直肠癌中SOX-2的表达水平与患者预后有关[5]。Santagata等发现SOX-2在胚胎性癌中表达,而在单一的精原细胞瘤中不表达,所以SOX-2可以作为区别精原细胞瘤成分和非精原细胞瘤成分的干细胞肿瘤的诊断依据[6]。
OCT-4是多条基因调节通路的衔接点,其可以激活特定的信号通路对细胞增殖分化产生作用;也可以通过前馈系统、信号通路等对多种转录因子的表达进行调控[7]。有实验发现在裸鼠种植异常表达OCT-4的异源性的非致瘤性细胞系,可以使细胞转化为致瘤性细胞,出现成瘤作用[8]。OCT-4的表达与口腔鳞癌患者的生存率有明显的相关性,表达水平越高则肿瘤的预后越差,这提示OCT-4可以作为评估口腔鳞癌预后的有效指标[9]。
本实验结果提示SOX-2参与了宫颈鳞癌的发生发展过程,并且其在宫颈鳞癌中阳性表达强度与癌组织的分化程度有关,宫颈鳞癌组织分化越差,恶性度越高,SOX-2阳性表达强度也越高。OCT-4与宫颈鳞癌的发生和发展有关,其可能通过保持细胞的多潜能性,抑制肿瘤细胞分化从而保持其增殖能力来促进肿瘤的发生和发展。
综上所述,SOX-2及OCT-4在宫颈癌中表达明显上调,提示SOX-2、OCT-4的表达可能增强了肿瘤细胞浸润与转移的能力。SOX-2及OCT-4有望成为宫颈鳞癌诊断的分子标志物,同时为宫颈鳞癌提供新的治疗靶点。
[1]Hussenet T,Dali S,Exinger J,et al.SOX2is an oncogene activated by recurrent 3q26.3amplifications in human lung squamous cell carcinomas[J].PLoS One,2010,5(1):e8960.
[2]Jiang Y,Jahagirdar BN,Reinhardt RL,et al.Pluripotency of mesenchymal stem cells derived from adult marrow [J].Nature,2002,418 (68 93):41.
[3]Jansen AP,Camalier CE,Ctrak C,et al.Characterization of programmed cell deah 4in multiple human cancers reveals a novel enhancer of drug sensitivity[J].Mol Cancer Ther,2004,3(2):103.
[4]Rizzino A.Sox2and Oct-3/4:a versatile pair of master regulatorsthat orchestrate the self-renewal and pluripotency of embryonic stem cells[J].Wiley Interdiscip Rev Syst Biol Med,2009,1(2):228.
[5]王钰婷,薛立辉,聂刘旺.SOX基因与肿瘤关系的研究进展 [J].癌变·畸变·突变,2009,21(1):77.
[6]Santagata S,Ligon KL,Hornick JL.Embryonic stem cell transcription factor signatures in the diagnosis of primary and metastatic germ cell tumors[J].Am J Surg Pathol,2007,31(6):836.
[7]郑鹏生,曹浩哲.OCT-4基因的研究进展[J].西安交通大学学报(医学版),2010,31(5):521.
[8]Gidekel S,Pizov G,BergmanY,et al.Oct-3/4is a dose-dependent oncogenic fate determinant[J].Cancer Cell,2003,4(5):361.
[9]Chiou SH,Yu CC,Huang CY,et al.Positive correlations of Oct-4 and Nanog in oral cancer stem-like cells and high-grade oral squamous cell carcinoma[J].Clin Cancer Res,2008,14(13):4085.

