加味佛手散治疗原发性痛经作用机制实验研究
佟 昕 佟 力
(1秦皇岛市海港区计划生育服务站,河北秦皇岛,066000;2秦皇岛市青龙满族自治县人民医院)
加味佛手散(MFSS)为本课题组应用的自拟方,以佛手散为基础的组方,由当归、川芎、血见愁、赤芍、黄芪等组成,具有益气活血、行气活血、通经散寒、止痛之功效,临床用于治疗原发性痛经疗效可靠[1],前期实验研究证明本方对原发性痛经模型动物的痛反应及对缩宫素诱发的正常小鼠离体子宫过度收缩有明显的抑制作用[2]。本研究旨在通过观察MFSS对原发性痛经模型动物子宫平滑肌兴奋性的影响及血清中PGF2α水平,探讨MFSS治疗原发性痛经的机制。
1 材料与方法
1.1 材料
1.1.1 药物 加味佛手散水提取物的制备:当归、川芎、血见愁、赤芍、黄芪按 6∶3∶1∶1∶5 配伍,加 8 倍量水,浸泡4h,煎煮2次,每次煎煮20min,合并煎煮液,过滤,减压浓缩至1g/mL;元胡止痛片(YHZTP),承德天源药业有限公司,批号:20090312;己烯雌酚片,石家庄市华龙药业股份有限公司,批号:20090408;缩宫素注射液,上海禾丰制药有限公司,批号090206。
1.1.2 试剂盒 大鼠前列腺素F2α(PGF2α)酶联免疫检测试剂盒,批号090621,上海西唐生物科技有限公司生产。谷胱甘肽过氧化物酶试剂盒,批号:20090716;SOD试剂盒,批号:20090321;MDA试剂盒,批号:20090711,均购自南京建成生物工程研究所第一分所。
1.1.3 洛氏液(Locke’s solution)[3]NaCl 9.0g/L,KCl 0.42g/L,CaCl20.24g/L,NaHCO30.2g/L,Glucose 1.0g/L,临用时重蒸水新鲜配制。
1.1.4 仪器 MacLab/4e四道生理记录仪(澳大利亚生产)。
1.1.5 动物 wistar大鼠,清洁级,雌性,未孕,体质量200~220g,由河北医科大学实验动物中心提供,许可证号:SCXK(冀)-1-003,实验前在本实验室适应3天,实验室温度22~24℃,相对湿度60%,光照时间12h(7:00-19:00)。
1.2 方法
1.2.1 分组及原发性痛经模型的制备[4]雌性wistar大鼠60只,随机分为正常对照组(NC)、MFSS(按生药计算)1.0、2.0和4.0g/kg组,YHZT 1.0g/kg阳性对照组及模型组(MC)。除正常对照组外,其他组大鼠均每天腹腔注射(ip)己烯雌酚2mg/kg,连续10d。ip己烯雌酚第6日开始,各组灌胃给予相应的药物,给药容积为5mL/kg,模型组灌胃等体积蒸馏水,连续5d。末次给药后1h肌肉注射缩宫素20u/kg。
1.2.2 检测标本的制备 上述模型动物在注射缩宫素40min后,乙醚轻度麻醉,腹腔静脉取血,3000 r/min,4℃离心15min,分离血清,置于-20℃保存。取血后,迅速取出子宫,置于冷洛氏液中轻轻冲洗,供下列实验用。
1.2.3 大鼠离体子宫平滑肌活动力的测定 将上述离体子宫固定于盛有15mL洛氏液的恒温浴槽中,与MecLab/4e相连的张力换能器上。浴槽内温度为37.5~38℃,恒量通入95%O2+5%CO2混合气体。调节微调器加前负荷1g,平衡40min,待子宫恢复自发节律,收缩频率和幅度稳定后,记录各组动物子宫的收缩频率和幅度,并计算其活动力(频率×幅度)。
1.2.4 大鼠血清中PGF2α、MDA含量及SOD和GSH-PX的活性测定 取1.2.2制备的血清,按试剂盒方法测定各组大鼠血清中PGF2α、MDA含量及SOD和GSH-PX的活性。
表1 MFP对原发性痛经模型大鼠离体子宫收缩力的影响(n=10,±s)
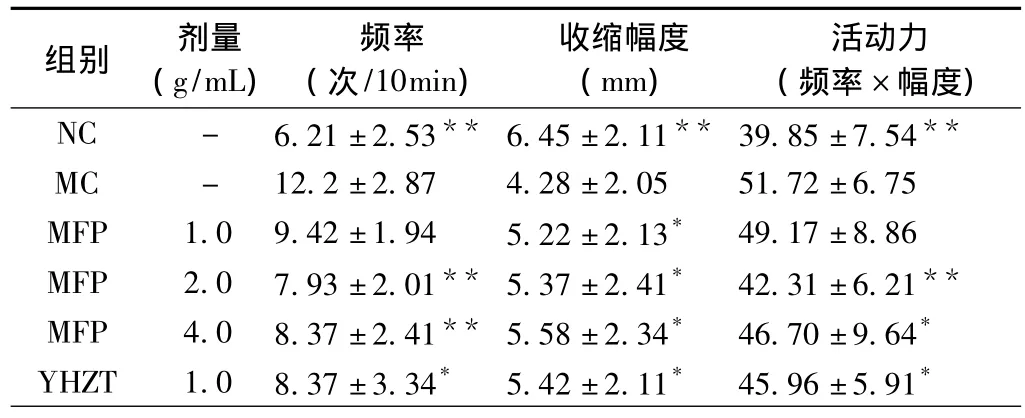
表1 MFP对原发性痛经模型大鼠离体子宫收缩力的影响(n=10,±s)
注:与 MC 组比较,*P <0.05,**P<0.01。
组别 剂量(g/mL)频率(次/10min)收缩幅度(mm)活动力(频率×幅度)NC - 6.21±2.53** 6.45±2.11** 39.85±7.54**MC - 12.2±2.87 4.28±2.05 51.72±6.75 MFP 1.0 9.42±1.94 5.22±2.13* 49.17±8.86 MFP 2.0 7.93±2.01** 5.37±2.41* 42.31±6.21**MFP 4.0 8.37±2.41** 5.58±2.34* 46.70±9.64*YHZT 1.0 8.37±3.34* 5.42±2.11* 45.96±5.91*
2 结果
2.1 对痛经模型大鼠离体子宫平滑肌活动力的影响模型组大鼠离体子宫平滑肌的收缩频率显著高于正常对照组、收缩幅度低于正常对照组(P<0.05)、活动力高于正常对照组(P<0.01)。MFSS 2.0、4.0g/kg剂量组离体子宫收缩频率明显低于模型组(P<0.05),收缩幅度高于模型组(P<0.05),活动力低于模型组(P<0.05)。1.0g/kg剂量组收缩幅度高于模型组(P<0.05),收缩频率与模型组比较差异无统计学意义(P>0.05)。2.0g/kg剂量组的活动力低于其他剂量组,结果见表2。
2.2 对大鼠血清中PGF2α、MDA、SOD和 GSH-PX水平的影响 MC组大鼠血清中PGF2α的含量显著高于NC组(P<0.01),MFSS各剂量组及YHZT组动物血清中PGF2α的含量显著低于MC组(P<0.05)。MC组MDA含量高于NC组(P<0.05),SOD、GSHPX活性低于NC组(P<0.05)。MFP各剂量组MDA的含量低于MC组(P<0.05);GSH-PX及SOD的活性高于MC组,结果见表2。
表2 MFP对原发性痛经模型大鼠血清中PGF2α、MDA、SOD和GSH-PX水平的影响(n=10,±s)

表2 MFP对原发性痛经模型大鼠血清中PGF2α、MDA、SOD和GSH-PX水平的影响(n=10,±s)
注:与MC组比较,*P<0.05,**P <0.01。
组别 剂量(g/kg) PGF2α(μg/mL) MDA(nmol/mL) SOD(u/mL) GSH -PX(U)1.12±0.35 102.39±38.56 812.62±154.29 MC - 8.71±2.87 1.78±0.41 159.46±55.37 537.91±119.60 MFP 1.0 5.71±2.42* 1.46±0.26* 137.64±54.56* 597.12±203.12*MFP 2.0 5.34±0.75** 1.37±0.43** 122.75±49.52* 723.52±272.26**MFP 4.0 4.79±0.87** 1.45±0.35* 128.12±42.51* 682.57±113.24*YHZT 0.1 4.78±1.38** 1.41±0.38** 134.78±51.25* 616.69±123.46 NC - 3.01±0.45***
3 讨论
原发性痛经的病因、病机复杂。Creat sas G等研究证明原发性痛经的发生与前列腺素(PGs)密切相关[5],前列腺素能促进子宫内膜螺旋小动脉收缩,加速内膜缺血、坏死及血管的断裂导致月经来潮。痛经患者血中PGF2α水平与痛经的症状呈正相关。高浓度的PGF2α作用于螺旋小动脉上的PGF2α受体,引起子宫平滑肌痉挛性收缩,表现为能宫肌张力增高、收缩幅度增加,导致子宫组织血流减少,缺血、缺氧,酸性代谢产物堆积于肌层,刺激子宫自主神经疼痛纤维而致痛经[6-8]。子宫平滑肌痉挛性收缩致肌间血管受压而出现子宫肌层及内膜的暂时缺血,产生更多的超氧自由基,而抗氧化酶活性相应降低,引起自由基的连锁反应,形成一系列的脂质自由基及其降解产物,进一步引起细胞膜的流动性降低,通透性增高,线粒体肿胀,溶酶体破坏及溶酶体酶的释放,更进一步加重了子宫内膜的损伤,使痛经发生并加剧[9]。
本方临床用于治疗血瘀兼气虚型原发性痛经,疗效可靠[1]。前期实验研究证明本方可明显减少原发性痛经模型小鼠的扭体反应次数,延长扭体反应的潜伏期[2]。本研究结果证明,MFS 2.0、4.0g/kg 明显降低原发性痛经模型大鼠离体子宫收缩频率(P<0.05),而收缩幅度高于模型组(P<0.05),活动力低于模型组(P<0.05),说明MFS可明显抑制原发性痛经大鼠子宫的过度收缩,使其舒张完全,改善子宫平滑肌的血液供应,进而减轻痛反应。MFS明显降低原发性痛经模型大鼠血清中PGF2α水平,提示其缓解原发性痛经模型大鼠子宫痉挛性收缩与抑制PGF2α的合成或释放有关。
本实验结果证明,本方可以明显提高血清中SOD和GSH-PX的活性,降低MDA的含量,提示其可通过提高SOD及GSH-PX酶的活性,加速超氧自由基的消除,减轻超氧自由基对子宫平滑肌的进一步损伤,是其治疗原发性痛经作用机制之一。
[1]佟力.佛手散加味治疗原发性痛经60例临床观察[J].河北中医,2010,32(5):693 -694.
[2]李兴岭,佟力,佟欣,等.佛手散加味对原发性痛经作用的实验研究[J].中国中医急症,2011,20(4):601 -602.
[3]徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:1583.
[4]王北婴,李仪奎.中药新药研究开发技术与方法[M].上海科学技术出版社,2001,700 -702.
[5]Creat sas G,Deligeoroglou E,Zachari A,et al.Prostaglandins:PGF2 alpha,PGE2,6 - keto - PGF1 alpha and TXB2 serum levels in dysmenorrheic adolescents before,during,and after treatment with oral contraceptives[J].Europ J Obstet Gynecol Reprod Biol,1990,36(3):292 -298.
[6]华永庆,洪敏,朱荃.原发性痛经进展[J].南京中医药大学学报,2003,19(1):622 -641.
[7]李炳如,樊菁.痛经宁对大鼠子宫微循环的影响[J].中草药,1990,21(7):22-24.
[8]孙宁铨,林雅,张从羽,等.痛经散治疗原发性痛经的临床与机制初探[J].中西医结合杂志,1996,6(12):711 -713.
[9]裴培田,姚凝.舒经玫瑰胶囊对小鼠原发性痛经血清中谷胱甘肽过氧化物酶及一氧化氮的影响[J].中国药物与临床,2005,5(1):24-25.

