检测乳粉中克罗诺杆菌属穆汀斯克罗诺杆菌的双抗夹心ELISA方法的研究
石 曼,生 威,杜欣军,王 帅,杨 丽,余桂春,郭柏雪,王 硕
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
检测乳粉中克罗诺杆菌属穆汀斯克罗诺杆菌的双抗夹心ELISA方法的研究
石 曼,生 威,杜欣军,王 帅,杨 丽,余桂春,郭柏雪,王 硕*
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
获得了抗穆汀斯克罗诺杆菌的多克隆抗体,抗体只对穆汀斯克罗诺杆菌菌株有特异性识别,而对非穆汀斯克罗诺杆菌无交叉反应。利用所得到的抗体,建立了一种双抗夹心ELISA检测方法,该方法对纯培养穆汀斯克罗诺杆菌菌液检出限为105cfu/mL;经过17h增菌,全脂乳粉染菌样品中的穆汀斯克罗诺杆菌的检出限为0.1cfu/g。该方法为快速检测乳粉中穆汀斯克罗诺杆菌的污染奠定了基础。
穆汀斯克罗诺杆菌,双抗夹心ELISA,全脂乳粉,检测
阪崎肠杆菌(Cronobacter spp.)是一种革兰氏阴性菌,1980年以日本细菌学家Riichi Sakazakii的名字命名,即阪崎肠杆菌(Enterobacter Sakazakii)[1]。2008年Iersen把阪崎肠杆菌生物群另外分为肠杆菌科的一个新属Cronobacter spp.,该属包含5个种,1个基因种,3个新亚种,分类关系见表1[2]。2008年第三十一届食品卫生法典委员会建议暂时同时使用两种命名:Enterobacter sakazakii(Cronobacter属)。阪崎肠杆菌感染死亡率高达20%~50%[3-4]。配方奶粉是主要的感染源[5-6]。传统的细菌培养检测步骤繁琐,检出时间长,ELISA使致病菌的快速检测有了较大的发展。本研究以穆汀斯克罗诺杆菌ATCC51329为免疫原,制备出了高效价、高特异性的抗血清,并建立了检测穆汀斯克罗诺杆菌的夹心ELISA方法。
1 材料与方法
1.1 材料与仪器
弗氏不完全佐剂、弗氏完全佐剂、辣根过氧化物酶标羊抗兔IgG抗体、TMB、过氧化氢脲 Sigma公司;Protein A-Sepharose 4B 美国Amersham公司;穆汀斯克罗诺杆菌ATCC51329(C.muytjensii)、阪崎克罗诺杆菌ATCC29544(C.sakazakii) 中国工业微生物菌种保藏中心;阪崎克罗诺杆菌IQCC10422(C.sakazakii) 中国检科院食品安全微生物菌种保藏管理中心;大肠杆菌(Escherichia coli)ATCC8739、阴沟肠杆菌(Enterobacter cloacae)TJCIQENT6926、奇异变形杆菌(Proteus mirabilis)ATCC12453、福氏志贺氏菌(Shigella flexneri)TJCIQ51175、成团肠杆菌(Enterobacter agglomerans)TJCIQ090929、肠炎沙门菌(Salmonella enteritidis)TJCIQ50041、弗氏枸橼檬酸杆菌(Citrobacter freundii)TJCIQCIT6926 天津出入境检验检疫局赠送。
酶标仪 美国Thermo公司;蛋白纯化仪 美国BIO-RAD公司;分析天平-BL610 赛多利斯仪器系统有限公司;96孔酶标板 丹麦Nunc公司;洗板机 美国BIO-RAD公司;微量可调移液器 法国GILSON公司。

表1 克罗诺杆菌新属(Cronobacter spp.)组成和分类关系Table 1 Composition and classification of Cronobacter spp.
1.2 实验方法
1.2.1 制备免疫原 取新鲜无菌的改良月桂基硫酸盐胰蛋白胨肉汤-万古霉素液体培养基(mLST-Vm)接种穆汀斯克罗诺杆菌ATCC51329,摇床上180r/min,37℃振荡培养过夜。平板计数。菌体用1.5%福尔马林灭活,收集菌体,用无菌生理盐水离心(5000r/min,10min)洗涤两次,将重悬后的菌液比浊并稀释至1010cfu/mL,-20℃保存备用。
1.2.2 抗体制备、纯化及效价的测定 首次免疫以1mL浓度为109cfu/mL的菌液与等体积弗氏完全佐剂充分乳化,采取皮下和肌肉注射法免疫雄性新西兰大耳白兔。加强免疫用1mL浓度为109cfu/mL的菌液与等体积弗氏不完全佐剂充分乳化多点皮内和肌肉注射。分别于初次免疫后2、4、6周共加强免疫3次,于第二次免疫后7d,由兔子的耳缘静脉取血,进行效价测定。最后一次加强免疫后1周,取全血。采用以Protein A-Sepharose 4B作亲合层析介质纯化抗血清,并测定纯化后抗体浓度。
采用间接ELISA法检测抗穆汀斯克罗诺杆菌兔多克隆抗血清效价。在96孔板中包被107cfu/mL热灭活穆汀斯克罗诺杆菌(100μL/孔),37℃孵育2h。PBST洗板3次,封闭液(200μL/孔)37℃封闭30min。PBST洗板3次,加入梯度稀释的抗血清(100μL/孔)37℃孵育1h。PBST洗板4次,加入酶标二抗(100μL/孔)37℃孵育30min。PBST洗板5次,加入TMB底物溶液(100μL/孔)37℃孵育20min。加入1.25mol/L浓硫酸50μL/孔终止反应。选择吸光度值在0.7~1.2范围内的抗血清的稀释倍数,即为抗血清效价。
1.2.3 酶标抗体制备 过碘酸钠法[7]制备酶标抗体:5mg HRP溶于0.5mL双蒸水,加入1mL新配制的0.06mol/L NaIO4,4℃混匀30min。加入0.16mol/L乙二醇0.6mL,4℃混匀30min,终止氧化反应。加入5mg抗体,混匀并装入透析袋,置0.05mol/L pH9.6碳酸盐缓冲液1000mL中,4℃透析6~12h,换液3次,使之结合。取出透析袋中液体(约3mL),加入5mg/mL NaBH40.2mL 4℃缓慢混匀2h。饱和硫酸铵沉淀法纯化后沉淀物复溶于1mL PBS,4℃透析6~12h,换液3次。取出后加入等体积甘油,-20℃保存。
1.2.4 双抗夹心ELISA检测方法的建立 双抗夹心ELISA法检测穆汀斯克罗诺杆菌:在聚苯乙烯酶标板上包被浓度为0.5μg/mL的抗穆汀斯克罗诺杆菌兔多克隆抗体(100μL/孔),37℃孵育2h。PBST洗板3次,采用0.5%脱脂乳粉/PBS(200μL/孔)封闭30min。PBST洗板3次,加入梯度稀释的穆汀斯克罗诺杆菌(100μL/孔),室温孵育1h。PBST洗板4次,加入1∶2000酶标记的抗穆汀斯克罗诺杆菌兔多克隆抗体(100μL/孔),室温反应30min。PBST洗板5次加入TMB底物溶液(100μL/孔),37℃反应20min。加入1.25mol/L浓硫酸50μL/孔终止反应。以(测定孔OD值-空白值)/(阴性对照孔OD值-空白值)≥2.1,即OD值大于阴性对照孔2.1倍判为阳性。
1.2.5 双抗夹心ELISA检测穆汀斯克罗诺杆菌的灵敏度和特异性 将穆汀斯克罗诺杆菌以PBS(pH7.4)稀释至103、104、105、106、107、108cfu/mL的不同浓度作为抗原,检测双抗夹心ELISA法的灵敏度。大肠杆菌等不同菌株接种于mLST-Vm培养15h,菌悬液计数后沸水浴10min,以上述不同抗原作为待测抗原,确定双抗夹心ELISA检测的特异性。
1.2.6 人工接种全脂乳粉的检测 全脂乳粉是天津进出口检验检疫局赠送的不含穆汀斯克罗诺杆菌的阴性样。全脂乳粉样品的制备:无菌条件下,称取全脂乳粉10g,接入穆汀斯克罗诺杆菌不同浓度的菌悬液,按10、1、0.1cfu/g样品接种量接种,并以无菌生理盐水作阴性对照。在上述各样品中加入90mL mLSTVm,混匀,37℃,转速180r/min的恒温摇床上分别增菌培养11、14、17、20h后取样检测。
2 结果与分析
2.1 穆汀斯克罗诺杆菌多克隆抗体效价的测定
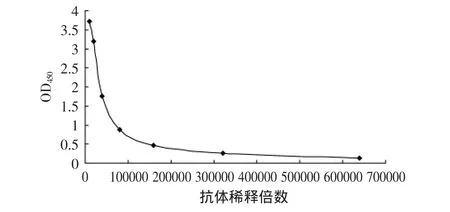
图1 纯化后抗体效价Fig.1 The titer of antibody after purification
间接ELISA对纯化后的抗穆汀斯克罗诺杆菌抗体进行效价测定,结果如图1,多克隆抗体效价很高,效价达到1∶80000。
2.2 双抗夹心ELISA法检测的灵敏度
以穆汀斯克罗诺杆菌纯培养菌液系列稀释,测定双抗夹心ELISA方法的灵敏度结果如图2,结果表明,随抗原浓度增大,OD值显著增大,该方法对105cfu/mL穆汀斯克罗诺杆菌纯培养菌液检测结果的OD值之比为6.01,而103cfu/mL和104cfu/mL的比值都小于2.1,因此,得出双抗夹心ELISA对穆汀斯克罗诺杆菌纯培养菌液的检出限为105cfu/mL,从加入待测抗原到得出结果只需要3h。
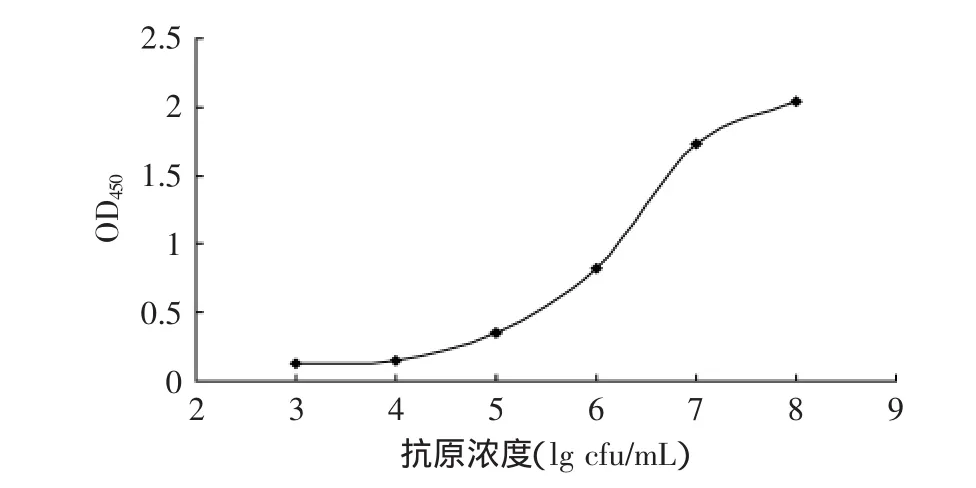
图2 双抗夹心ELISA检测穆汀斯克罗诺杆菌的灵敏度Fig.2 Sensitivity of detecting C.muytjensii by double-antibody sandwich ELISA
2.3 双抗夹心ELISA的特异性检测
选取穆汀斯克罗诺杆菌及其他菌株作为抗原用来检测双抗夹心ELISA的特异性,结果如图3。结果表明穆汀斯克罗诺杆菌呈显著阳性反应,吸光值与阴性孔值之比为6.01,大肠杆菌等其它菌株均呈阴性反应,吸光值与阴性孔值比均小于2.1,即抗体同非穆汀斯克罗诺杆菌没有交叉反应,说明双抗夹心ELISA方法对穆汀斯克罗诺杆菌具有很高的检测特异性。

图3 双抗夹心ELISA检测穆汀斯克罗诺杆菌的特异性Fig.3 Specificity of detecting C.muytjensii by double-antibody sandwich ELISA
2.4 人工接种全脂乳品的检测

表2 增菌后双抗夹心ELISA检测穆汀斯克罗诺杆菌结果Table 2 The results of detecting C.muytjensii by doubleantibody sandwich ELISA after enrichment
按10、1、0.1cfu/g三个标准接种量分别接种穆汀斯克罗诺杆菌在全脂乳粉中,染菌样品经过37℃、180r/min选择性增菌11、14、17、20h后,分别取1mL用于双抗夹心ELISA检测。结果表明,样品在增菌14h时取样检测,10、1cfu/g样品接种量接种的样品检测结果呈阳性,0.1cfu/g样品接种量接种的样品无法检测到穆汀斯克罗诺杆菌的存在,17h时取样检测,10、1、0.1cfu/g样品接种量接种的样品检测均为阳性。
3 结论
本研究获得的抗穆汀斯克罗诺杆菌兔多克隆抗体纯化后效价为1∶80000。建立的双抗夹心ELISA方法稳定性、重复性良好,对纯培养菌液检出限为105cfu/mL,对2株阪崎肠杆菌属内菌株和7株非阪崎肠杆菌菌株都没有交叉反应,说明抗体特异性好。由于穆汀斯克罗诺杆菌主要存在于乳制品中,所以选择对全脂乳粉人工接种穆汀斯克罗诺杆菌并以双抗夹心ELISA方法检测,检测结果显示,经过17h的增菌过程,不同接种量的接种样品(10、1、0.1cfu/g样品接种量)都可以被检测到穆汀斯克罗诺杆菌的存在,延长培养时间对于检测结果无意义。相对与传统的培养检测方法,该ELISA方法检测快速、灵敏度高、特异性好,为乳粉检验提供了一种新方法,为快速检测穆汀斯克罗诺杆菌奠定了基础,有很好的应用前景。
[1]Farmer J J,Asbury M A,Brenner D J,et al.Enterobacter sakazakii:a new species of“Enterobacteriaceae”isolated from clinical specimens[J].InternationalJournalof Systematic Bacteriology,1980,30:569-584.
[2]Iversen C,Mullane N,Barbara M,et al.Cronobacter gen. nov.,a new genus to accommodate the biogroups of Enterobacter sakazakii,and proposal of Cronobacter sakazakii gen.nov.comb. Nov.,C.malonaticus sp.Nov.,C.turicensis sp.Nov.,C.muytjensii sp.Nov.,C.dublinensis sp.Nov.,Cronobacter genomospecies 1,and of three subspecies,C.dublinensis sp.Nov.subsp.dublinensis subsp.Nov.,C.dublinensis sp.Nov.subsp.lausannensis subsp. Nov.and C.dublinensis sp.Nov.subsp.Lactaridi subsp.Nov.[J]. Int J Systematic and Evolutionary Microbiol,2008,58:1442-1447.
[3]Nazarowec-White M,Farber J M.Enterobacter sakazakii:a review[J].International Journal of Food Microbiology,1997,34(2):103-113.
[4]Corti G,Panunzi I,Losco M,et al.Postsurgical osteomyelitis caused by Enterobacter sakazakii in a healthy young man[J]. Journal of Chemotherapy,2007,19(1):94-96.
[5]Drudy D,Mullane N R,Quinn T,et al.Enterobacter sakazakii:An emerging pathogen in powdered infant formula[J].Clinical Infectious Diseases,2006(42):996-1002.
[6]GurtlerJB,KornackiJ L,Beuchat L R.Enterobacter sakazakii:A coliform of increased concern to infant health[J].International Journal of Food Microbiology,2005,104:1-34.
[7]冯仁清,郭振泉,宓捷波.现代抗体技术及其应用[M].北京:北京大学出版社,2006.
Development of a double-antibody sandwich enzyme linked immunosorbent assay for detection of Cronobacter muytjensii in milk powder
SHI Man,SHENG Wei,DU Xin-jun,WANG Shuai,YANG Li,YU Gui-chun,GUO Bai-xue,WANG Shuo*
(Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China)
The polyclonal antibody(PcAb)for Cronobacter muytjensii was available by intravenous injection with New Zealand rabbit with C.muytjensii ATCC51329 strains,a double-antibody sandwich enzyme-linked immunosorbent assay(ELISA)was developed.The detection limits were 105cfu/mL in pure culture of C.muytjensii ATCC51329 and without any cross reaction with the non-C.muytjensii strains.With 17h enrichment procedure,C.muytjensii recovered well from inoculated whole milk powder at levels of 0.1cfu/g.The results demonstrated that the double-antibody sandwich ELISA was a sensitive and specific method for detecting C.muytjensii in dairy products.
C.muytjensii;double-antibody sandwich ELISA;whole milk powder;detect
TS252.7
A
1002-0306(2012)01-0335-03
2011-01-11 *通讯联系人
石曼(1986-),女,硕士,研究方向:营养与食品卫生学。
“十一五”科技支撑课题计划资助项目(2009BADB9B03,2009BADB9B06);天津市科技计划项目(10SYSYJC28300)。

