胆囊癌患者术后放疗对免疫及炎性状态的综合影响观察
杨 倞 叶云飞 周海华 孙永健 孟 岩
第二军医大学附属东方肝胆外科医院放疗中心,上海 200438
胆囊癌患者术后放疗对免疫及炎性状态的综合影响观察
杨 倞 叶云飞 周海华 孙永健 孟 岩▲
第二军医大学附属东方肝胆外科医院放疗中心,上海 200438
目的 探讨术后放疗对胆囊癌患者免疫及炎性状态的综合影响。 方法 选取2007年8月~2011年6月于本院采用适形调强放疗(IMRT)的40例胆囊癌患者为观察组,同期采用三维适形放疗(3DCRT)的40例患者为对照组,将两组患者放疗前及放疗结束后1、4周的外周血T淋巴细胞亚群、红细胞免疫功能、免疫球蛋白及其补体、血清超敏 C 反应蛋白(hs-CRP)、肿瘤坏死因子 α(TNF-α)、白介素 6(IL-6)、γ 干扰素(IFN-γ)、白介素 4(IL-4)水平进行检测及比较。 结果 观察组放疗前至放疗结束后1、4周外周血T淋巴细胞亚群、红细胞免疫功能、免疫球蛋白及其补体、血清hs-CRP、TNF-α、IL-6、IFN-γ、IL-4水平波动幅度小于对照组,且放疗后4周优于放疗前(均P<0.05)。 结论 适形调强放疗较三维适形放疗对胆囊癌患者免疫抑制及炎症反应更为轻微,说明其对患者的不良影响更小。
术后放疗;三维适形放疗;适形调强放疗;胆囊癌;免疫;炎症状态;综合影响
胆囊癌具有恶性程度高、发病隐匿及易早期转移等特点,且其对化疗不敏感,治疗效果不理想。目前部分学者认为放射治疗可对其恶劣预后达到一定的生存获益,但疗效仍有争议。随着放射治疗技术及设备的不断发展改进,胆囊癌放疗疗效的研究日益受到关注[1-3],但其对于胆囊癌患者免疫及炎性状态改变的研究却少有报道。本文中笔者就术后放疗对胆囊癌患者免疫及炎性状态的综合影响进行观察,分析总结如下:
1 资料与方法
1.1 一般资料
选取2007年8月~2011年6月我院胆道外科行根治性手术治疗胆囊癌患者共80例。术后行适形调强放疗(IMRT)的40例胆囊癌患者为观察组,同期采用三维适形放疗
(3DCRT)的40例患者为对照组。对照组的40例患者中,男18例,女 22例,年龄 35~76 岁,平均(62.3±4.8)岁,其中腺癌33例,鳞癌5例,其他2例。观察组的40例患者中,男17例,女 23例,年龄 34~76 岁,平均(62.6±4.7)岁,其中腺癌 32例,鳞癌5例,其他3例。根据AJCC分期标准,对照组患者中,Ⅲ期13例、Ⅳ期27例;观察组患者中,Ⅳ期14例、Ⅴ期26例。两组患者的年龄、性别比、分类及分期等差异均无统计学意义(P>0.05),具有可比性。本资料经医院伦理委员会通过,患者均知情同意。
1.2 方法
1.2.1 治疗方法 本组胆囊癌患者均采用胆囊癌根治性切除术,包括胆囊切除,胆囊切除+区域淋巴结清扫,胆囊切除+肝段+肝外胆管/十二指肠胰头切除。两组患者均于术后1~3个月行放射治疗。对照组行术后3DCRT放疗,而观察组则进行术后IMRT放疗。患者行常规定位及CT扫描,将获得的图像资料和相关数据输入治疗计划系统,进行三维重建。照射靶区CTV1为胆囊床术区及肝门区淋巴引流区,CTV2包括胰头、十二指肠周围、肠系膜上动脉及腹腔干周围淋巴引流区;术中未见淋巴结转移者勾画至左肾静脉水平以上的淋巴引流区。计划靶体积(PTV)在CTV基础XY轴方向外扩1.0 cm,Z 轴(头脚方向)外扩 1.5cm。CTV1 剂量分割为 1.8~2.0Gy/(f·5 d),总剂量为50~66 Gy,中位剂量为56 Gy。照射至40~46 Gy剂量时复查CT模拟定位,缩野补量照射10~16 Gy。CTV2照射总剂量为40~56 Gy,中位剂量为50 Gy。利用剂量体积直方图(DVH)进行剂量优化,90%等剂量曲线完全覆盖PTV,PTV内部剂量差异控制在±5%以下,危及器官如胃肠道及脊髓等剂量均在可接受范围内。将两组患者放疗前及放疗结束后1、4周的免疫及炎性状态进行检测及比较。
1.2.2 检测方法 两组患者的免疫状态检测包括外周血T淋巴细胞亚群、红细胞免疫功能、免疫球蛋白及其补体方面的检测,炎性状态则通过检测其血清超敏C反应蛋白 (hs-CRP)、肿瘤坏死因子 α(TNF-α)、白介素 6(IL-6)、γ 干扰素(IFN-γ)、白介素 4(IL-4)水平来显示,均取患者的晨起空腹血5 mL于半小时内送检,其中外周血T淋巴细胞亚群均采用 Beckman Coulter流式细胞仪进行 CD3+、CD4+、CD8+、CD4/CD8等指标的检测,红细胞免疫功能则采用郭峰法检测其RC3bRR、RICR、RFER及RFIR水平,免疫球蛋白及其补体则采用酶联免疫法进行检测,另外血清炎症因子则采用酶联免疫法进行血清 hs-CRP、TNF-α、IL-6、IFN-γ、IL-4 水平方面的检测。
1.3 统计学方法
统计学软件包选用SAS 9.0,计量资料数据以均数±标准差(±s)表示,比较采用t检验,计数资料采用百分率表示,组间对比采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者放疗前至放疗结束后1、4周外周血T淋巴细胞亚群比较
放疗前两组患者的 CD3+、CD4+、CD8+、CD4/CD8 等外周血T淋巴细胞亚群指标差异均无统计学意义(均P>0.05),而放疗结束后1周及4周观察组CD3+、CD4+及CD4/CD8均高于对照组,而CD8+低于对照组,另外观察组放疗后后4周优于放疗前(均P<0.05)。见表1。
2.2 两组患者放疗前至放疗结束后1、4周红细胞免疫功能比较
放疗前两组患者的RC3bRR、RICR、RFER及RFIR等红细胞免疫功能指标均无差异(均P>0.05),而放疗结束后1周及4周观察组RC3bRR及RFER均高于对照组,RICR及RFIR均低于对照组(均P<0.05)。另外观察组放疗后4周优于放疗前(均P<0.05)。见表2。
表1 两组患者放疗前至放疗结束后1、4周外周血T淋巴细胞亚群比较(±s)
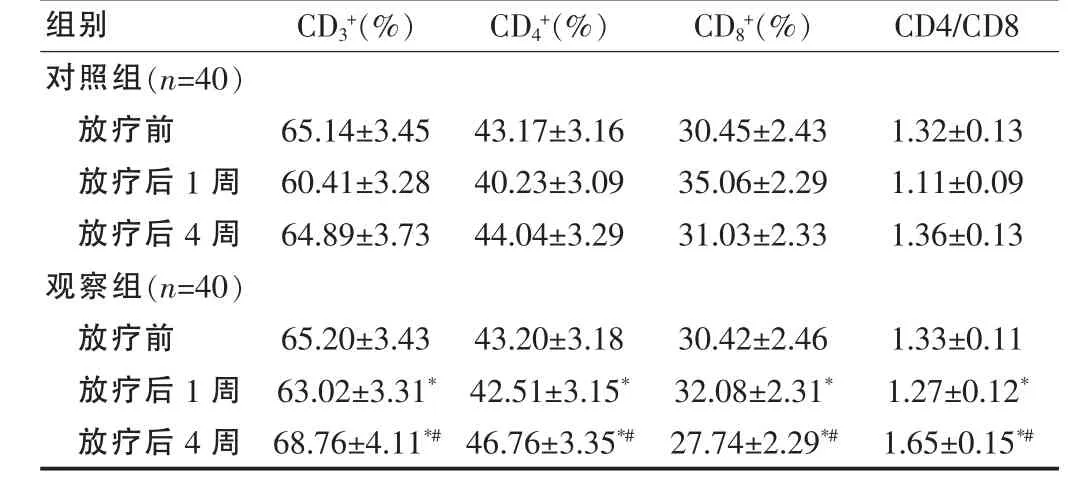
表1 两组患者放疗前至放疗结束后1、4周外周血T淋巴细胞亚群比较(±s)
注:与对照组同期比较,*P<0.05;与同组放疗前比较,#P<0.05
组别 CD3+(%) CD4+(%) CD8+(%) CD4/CD8对照组(n=40)放疗前放疗后1周放疗后4周观察组(n=40)放疗前放疗后1周放疗后4周65.14±3.45 60.41±3.28 64.89±3.73 43.17±3.16 40.23±3.09 44.04±3.29 30.45±2.43 35.06±2.29 31.03±2.33 1.32±0.13 1.11±0.09 1.36±0.13 65.20±3.43 63.02±3.31*68.76±4.11*#43.20±3.18 42.51±3.15*46.76±3.35*#30.42±2.46 32.08±2.31*27.74±2.29*#1.33±0.11 1.27±0.12*1.65±0.15*#
表2 两组患者放疗前至放疗结束后1、4周红细胞免疫功能比较(±s,%)
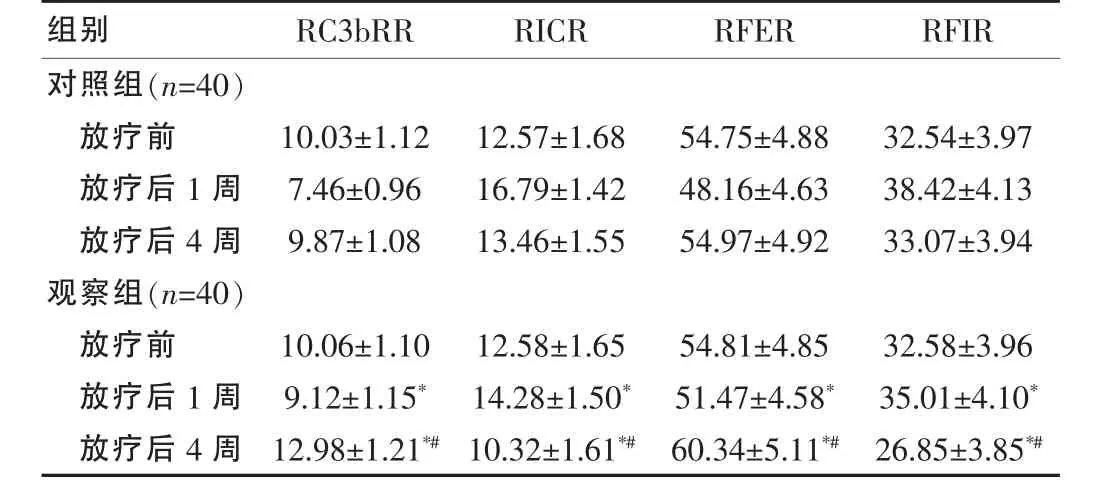
表2 两组患者放疗前至放疗结束后1、4周红细胞免疫功能比较(±s,%)
注:与对照组同期比较,*P<0.05;与同组放疗前比较,#P<0.05
组别 RC3bRR RICR RFER RFIR对照组(n=40)放疗前放疗后1周放疗后4周观察组(n=40)放疗前放疗后1周放疗后4周10.03±1.12 7.46±0.96 9.87±1.08 12.57±1.68 16.79±1.42 13.46±1.55 54.75±4.88 48.16±4.63 54.97±4.92 32.54±3.97 38.42±4.13 33.07±3.94 10.06±1.10 9.12±1.15*12.98±1.21*#12.58±1.65 14.28±1.50*10.32±1.61*#54.81±4.85 51.47±4.58*60.34±5.11*#32.58±3.96 35.01±4.10*26.85±3.85*#
2.3 两组患者放疗前至放疗结束后1、4周免疫球蛋白及其补体比较
放疗前两组患者的IgA、IgM、IgG及其补体C3、C4等指标均无差异(均P>0.05),而放疗结束后1周及4周观察组上述指标均高于对照组(除外放疗后1周的IgA),其放疗后4周明显高于放疗前(均P<0.05)。见表3。
2.4 两组患者放疗前至放疗结束后1、4周血清hs-CRP、TNF-α、IL-6、IFN-γ、IL-4水平比较
放疗前两组患者的血清 hs-CRP、TNF-α、IL-6、IFN-γ、IL-4水平等炎症状态指标均无差异(均P>0.05),而放疗结束后1周及4周观察组上述指标均低于对照组,其放疗后4周明显低于放疗前(均P<0.05)。见表4。
表3 两组患者放疗前至放疗结束后1、4周免疫球蛋白及其补体比较(±s,g/L)
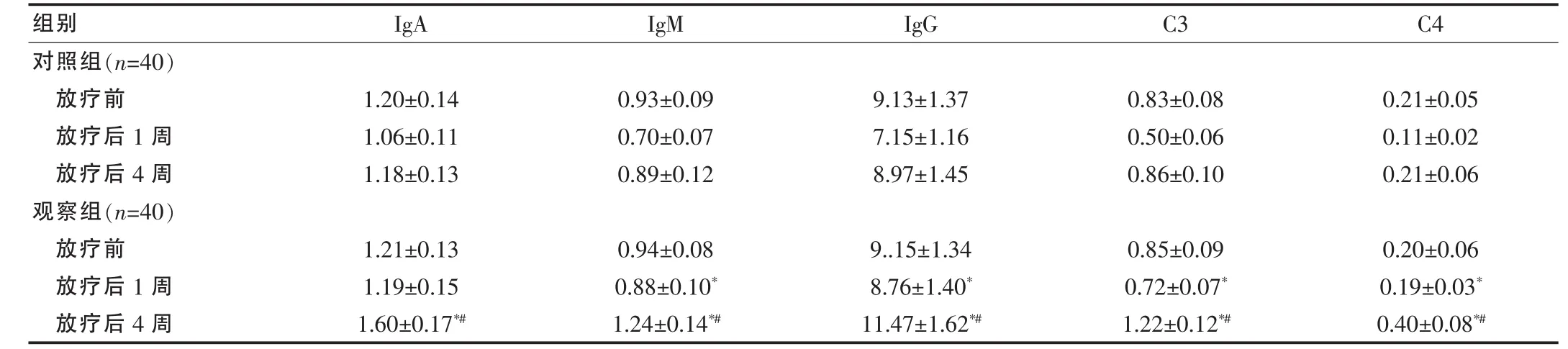
表3 两组患者放疗前至放疗结束后1、4周免疫球蛋白及其补体比较(±s,g/L)
注:与对照组同期比较,*P<0.05;与同组放疗前比较,#P<0.05
组别 IgA IgM IgG C3 C4对照组(n=40)放疗前放疗后1周放疗后4周观察组(n=40)放疗前放疗后1周放疗后4周1.20±0.14 1.06±0.11 1.18±0.13 0.93±0.09 0.70±0.07 0.89±0.12 1.21±0.13 1.19±0.15 1.60±0.17*#0.94±0.08 0.88±0.10*1.24±0.14*#9.13±1.37 7.15±1.16 8.97±1.45 0.83±0.08 0.50±0.06 0.86±0.10 0.21±0.05 0.11±0.02 0.21±0.06 9..15±1.34 8.76±1.40*11.47±1.62*#0.85±0.09 0.72±0.07*1.22±0.12*#0.20±0.06 0.19±0.03*0.40±0.08*#
表4 两组放疗前至放疗结束后1周、4周血清超敏C反应蛋白、肿瘤坏死因子α、白介素6、干扰素γ、白介素4比较(±s)
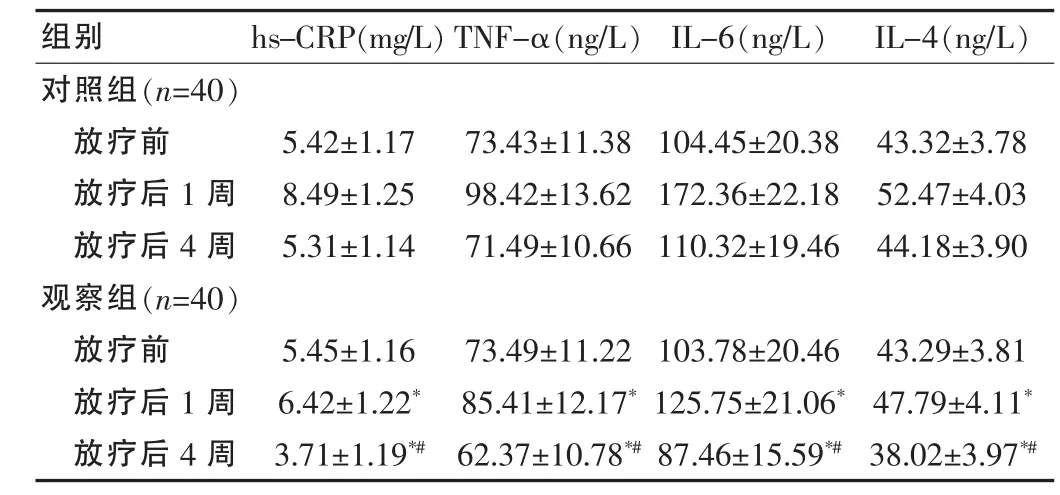
表4 两组放疗前至放疗结束后1周、4周血清超敏C反应蛋白、肿瘤坏死因子α、白介素6、干扰素γ、白介素4比较(±s)
注:与对照组同期比较,*P<0.05;与同组放疗前比较,#P<0.05
组别 hs-CRP(mg/L)TNF-α(ng/L) IL-6(ng/L) IL-4(ng/L)对照组(n=40)放疗前放疗后1周放疗后4周观察组(n=40)放疗前放疗后1周放疗后4周5.42±1.17 8.49±1.25 5.31±1.14 73.43±11.38 98.42±13.62 71.49±10.66 104.45±20.38 172.36±22.18 110.32±19.46 43.32±3.78 52.47±4.03 44.18±3.90 5.45±1.16 6.42±1.22*3.71±1.19*#73.49±11.22 85.41±12.17*62.37±10.78*#103.78±20.46 125.75±21.06*87.46±15.59*#43.29±3.81 47.79±4.11*38.02±3.97*#
3 讨论
原发性胆囊癌的发生率在胆道系统中居首位,近年来发病率有逐步增升高的趋势。临床工作中,入院诊治的胆囊癌患者大多数已处于进展期或晚期,其预后较差[4-5]。鉴于胆囊癌的解剖学、肿瘤学特点,Ⅲ、Ⅳ期胆囊癌患者行根治性切除均存在较高的复发风险[6]。近年来,随着放疗技术的不断发展和完善,放疗在多数恶性肿瘤的治疗中效果日益突出。其中IMRT不仅能够对肿瘤病灶进行有效的杀伤,且对病灶周围正常组织的保护较好[7],目前较普遍的应用于临床治疗中。但是对于其对胆囊癌患者全身状况的影响程度报道的对较少,且仍存在一定争议[8-10]。
本文中笔者就IMRT对胆囊癌患者免疫及炎性状态的综合影响进行研究,并与3DCRT对机体上述指标的影响进行比较。结果表明,IMRT患者放疗结束后1周的免疫状态(包括外周血T淋巴细胞亚群、红细胞免疫功能、免疫球蛋白及其补体)等均较3DCRT显示出优势,但较放疗前存在一定的免疫抑制现象,分析原因,与放疗对机体的不良影响有关,表现出机体免疫力较差的状态,而放疗结束后4周,IMRT患者的上述免疫指标已经大幅度改善,突出表现为其已经明显优于放疗前,说明患者的免疫功能得到有效改善,也说明机体抗感染的能力得到增强。同时对血清炎性因子的研究显示,放疗前至放疗结束后1、4周其呈现先升后降的趋势,且IMRT的变化幅度要小于3DCRT,说明机体对外界的这种不良影响的反应程度较小的同时,也说明了这种放疗方式对机体不良影响程度相对较小的优势,而放疗后4周患者的炎性因子水平已经显著低于放疗前,说明患者的恢复程度较大且恢复速度较快,进一步肯定了IMRT的优势[11-12]。因此,综合这些优势,笔者认为IMRT较3DCRT对胆囊癌患者免疫抑制及炎性反应更为轻微,说明其对患者的不良影响更小,在胆囊癌患者中具有较高的临床价值。
[1]陶建伟,吴红卫,王晓杰.放疗辅助热疗治疗晚期消化道肿瘤[J].医用放射技术杂志,2006,(12):5-60.
[2]孙艳军,孟翔凌,孙登群,等.PUMA在胆囊腺癌中的表达及其临床意义[J].中华肝胆外科杂志,2011,17(7):585-587.
[3]雷荣强,贵玉,赵晶,等.超声造影在胆囊息肉样病变鉴别诊断中的价值[J].临床和实验医学杂志,2011,10(20):1589-1591.
[4]葛含天.三维适形放疗同步节拍化疗治疗中晚期食管癌近期疗效观察[J].齐齐哈尔医学院学报,2009,30(16):1996-1997.
[5]Zhang Zhimian,Li Yingjie,Guan Xiao,et al.Down-regulation of human leukocyte antigens class I on peripheral T lymphocytes and NK cells from subjects in region of high-incidence gastrointestinal tumor[J].Chinese Medical Journal,2011,124(12):1813-1817.
[6]谢小铭,吕宝军,苟新敏,等.胆囊癌中微淋巴管密度与HIF-1α表达的相关性[J].中国医学创新,2011,8(29): 15-16.
[7]雷雨激,彭益,吕海涛.血液储存时间对消化道肿瘤手术患者红细胞免疫功能的影响[J].中国现代医生,2011,49(32):41-43.
[8]任培土,傅宏.原发性胆囊癌111例临床分析[J].中华普通外科杂志,2011,26(11):947-949.
[9]刘刚,任宏,孙学军,等.胆囊癌患者外周血与局部组织细胞免疫状态的变化及意义[J].四川大学学报:医学版,2007,38(2):337-338.
[10]朱海军,李飞舟,黄井岗.论三维适形放疗技术在肿瘤治疗上的应用[J].中国中医药咨讯,2011,3(23):449.
[11]周培芳,何银华.消化道肿瘤患者肿瘤标志物和肿瘤坏死因子等水平的测定[J].上海医学检验杂志,2001,16(4):236-237.
[12]蔡勇,刘长青,张珊文,等.28例不能手术的肝外胆道系统肿瘤放化疗疗效分析[J].中华放射肿瘤学杂志,2006,15(2)117-119.
Observation on the comprehensive influence of three-dimensional conformal radiotherapy for the immune and inflammatory state of patients with gallbladder carcinoma
YANG Jing YE Yunfei ZHOU Haihua SUN Yongjian MENG Yan▲
Center of Radiotherapy,the Eastern Hepatobiliary Surgery Hospital Affiliated to the Second Military Medical University,Shanghai200438,China
Objective To study the comprehensive influence of postoperative radiotherapy for the immune and inflammatory state of patients with gallbladder carcinoma.Methods 40 patients with gallbladder carcinoma who were treated with IMRT in our hospital from August 2007 to June 2011 were selected as observation group,and 40 patients treated with 3DCRT at the same time were selected as control group,then the peripheral blood T lymphocyte subsets,erythrocyte immune function,immunoglobulin and its complements,serum serum high-sensitivity c-reactive protein(hs-CRP),tumor necrosis factor α (TNF-α),interleukin 6(IL-6),Interferon γ (IFN-γ),interleukin 4(IL-4)of two groups before and after the radiotherapy at first and forth week were detected and compared.Results The fluctuation range of peripheral blood T lymphocyte subsets,erythrocyte immune function,immunoglobulin and its complements,hs-CRP,TNF-α,IL-6,IFN-γ,IL-4 of observation group before the radiotherapy to after the radiotherapy at first and forth week were smaller than those of control group,and the levels after the radiotherapy at the forth week were better than those before the radiotherapy,there were all significant differences(all P<0.05).Conclusion The immunosuppression and inflammatory response of IMRT for the patients with gallbladder carcinoma is smaller than that of 3DCRT,and it shows that the harmful effects for the patients is smaller.
Postoperative radiotherapy;3DCRT;IMRT;Gallbladder carcinoma;Immune;Inflammatory state;Comprehensive influence
R735.8
A
1673-7210(2012)08(b)-0052-03
▲通讯作者
2012-04-26 本文编辑:郝明明)