大鼠视网膜干细胞转染绿色荧光蛋白的实验研究
王淑荣,王晨光,齐首楠,苏冠方
(吉林大学第二医院 眼科,吉林 长春130041)
体外实验研究证明哺乳动物的视网膜干细胞(retinal stem cells,RSCs)具有自我更新的能力,并可被诱导分化成为多种类型的视网膜细胞,为治疗眼科领域内的致盲性眼底疾病带来了希望,在本实验中,我们应用含有绿色荧光蛋白(green fluorescent protein,GFP)的质粒对RSC进行转染,观察细胞表达后的生长情况及分化情况,为将来进一步应用基因修饰的RSC进行基因治疗及细胞治疗的研究奠定基础。
1 材料和方法
1.1 材料 出生10d的Wistar大乳鼠(体重约45 g),由吉林大学白求恩医学院动物实验中心提供。胎牛血清、DMEM/F12培养基、B27添加剂(Gibco),胰蛋白酶、G418、EDTA(Sigma),pGCsilencerTM U6/Neo/GFP(上海吉凯公司),BrdU、多聚赖氨酸,nestin、NSE、GFAP兔抗大鼠多克隆抗体,小鼠抗大鼠BrdU单克隆抗体,SABC、DAB试剂盒(武汉博士德公司),倒置相差显微镜(Olympus),CO2培养箱(SANYO)等。
1.2 方法
1.2.1 RSCs的分离、培养 断颈处死Wistar大乳鼠(出生10d的),应用750ml/L乙醇消毒5min,取出眼球,在角膜缘后约3mm处环形剪开,分离取出睫状体区组织,剪碎后应用含有0.5ml含有2.5 g/L胰蛋白酶及0.2g/L EDTA的消化液于37℃下消化15min,期间震荡3次。应用含有100ml/L胎牛血清的DMEM/F12培养液终止消化,离心弃上清后应用无血清培养液洗涤最终制成单细胞悬液,调整细胞密度为109/L,于37℃、50ml/L CO2、饱和湿度条件下进行培养,并添加20μg/L大鼠碱性成纤维生长因子(bFGF),20μg/L大鼠表皮生长因子(EGF)及1×B27添加剂。大约3d时半量换液,当细胞团较大时予以传代,传代应用含有2.5g/L胰蛋白酶及0.2g/L EDTA的混合消化液消化细胞。
1.2.2 RSCs的鉴定 应用免疫细胞化学法进行鉴定。细胞爬片预先经多聚赖氨酸处理,检测BrdU时需在固定细胞前1d向培养液中加入BrdU,调整其浓度为10μmol/L,爬片取出后PBS冲洗、40 g/L多聚甲醛室温固定20min,PBS冲洗3次,每次5 min,2g/L triton X-100作用10min,0.1mol/L PBS洗3次,每次5min,300ml/L过氧化氢及纯甲醇混合液(1∶50)室温阻断30min,蒸馏水洗2次,每次5 min。检测BrdU的细胞爬片需用2NHCl 37℃孵育10min,BSA室温封闭20min,倾去血清后加入nestin及BrdU一抗 (1∶200)4℃孵育过夜。用PBS代替一抗做空白对照,余步骤按照SABC试剂盒说明书操作,DAB发色后苏木精复染、乙醇脱水、二甲苯透明、封片液封片后显微镜下观察。
1.2.3 RSCs细胞转染及筛选 实验分为转染组(转染带有绿色荧光蛋白的质粒),转染试剂对照组(Lipofectamine 2000)。转染前将细胞团制成单细胞悬液,调整浓度约4×105细胞/孔。应用24孔板参照转染试剂说明书的技术参数进行细胞转染。每2-3d更换一次含有G418的筛选培养基。最佳筛选浓度为在筛选7d内能够杀死所有细胞的最小G418浓度。
1.2.4 GFP转染后细胞分化及神经标志物鉴定转染并筛选后的RSCs应用含50ml/L胎牛血清的DMEM/F12培养液进行诱导分化,观察转染后细胞分化情况,分化第7日应用前述的免疫细胞化学方法检测NSE及GFAP的表达情况。
2 结果
2.1 RSCs的体外培养、鉴定
原代培养2d后可以观察到呈悬浮生长的小球状细胞团,折光性强(图1)。细胞团数量在4-5d后逐渐增多,体积逐渐增大,至7-9d左右进行细胞传代。传代后48h即可形成新的与原代相似的细胞团,随传代次数增加细胞生长逐渐变缓。第2代RSCs细胞内可检测到nestin、BrdU均呈现阳性的棕黄色染色,空白对照组未见染色(图2、3)。

图1 原代视网膜干细胞(×200)
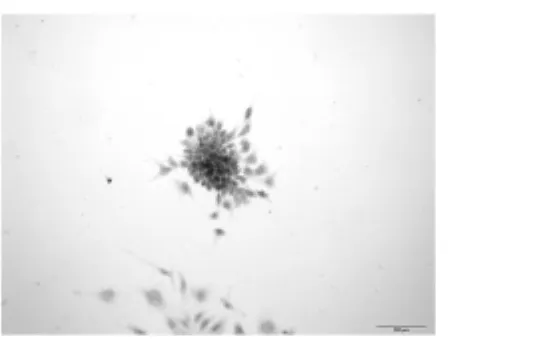
图2 第2代视网膜干细胞nestin免疫细胞化学染色阳性(×200)
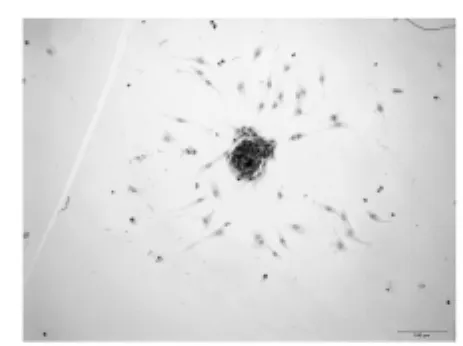
图3 第2代视网膜干细胞BrdU免疫细胞化学染色阳性(×200)
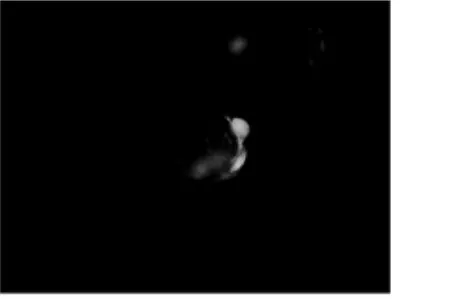
图4 转染GFP的视网膜干细胞(×200)
2.2 RSCs转染与筛选
经过优化确定应用 DNA(μg):转染试剂(μl)1∶2.5比例进行细胞转染,并确定应用150μg/ml为最佳G418筛选浓度对转染后第2日的细胞进行筛选。转染后大部分细胞形态比较接近于原始情况,未发生明显变化,少部分细胞变为贴壁生长,还有少部分细胞逐渐死亡(图4),各实验组改变相似。更换筛选培养基后不带有绿色荧光的干细胞逐渐死亡,带有绿色荧光的细胞改变无明显,细胞重新积聚成团状生长,一周后存活的细胞基本均为带有绿色荧光的细胞,不表达绿色荧光的RSCs基本已全部死亡(图5)。
2.3 转染后的RSCs的体外诱导分化
应用前述方法对转染并已筛选后的RSCs进行诱导分化,诱导后大部分细胞变为贴壁生长,第3d时可见部分细胞出现小突起,随着诱导分化时间的延长小突起不断延伸,部分交织成网状,分化7-10 d时可观察到较多细胞具有神经细胞形态。GFP转染组与转染试剂对照组细胞分化情况相似,无明显差别。应用免疫细胞化学方法分别检测到两组细胞分化后均不同程度表达NSE及GFAP(图6-8)。

图5 转染并筛选一周后的RSCs均表达GFP(×200)
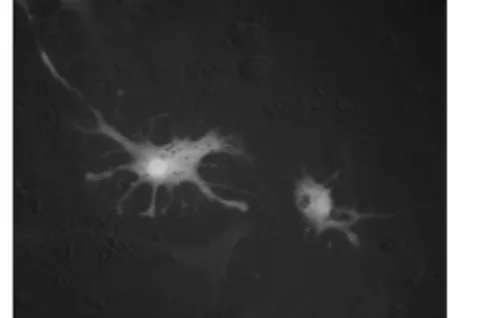
图6 转染并筛选后的RSCs可诱导分化为神经样细胞(×400)
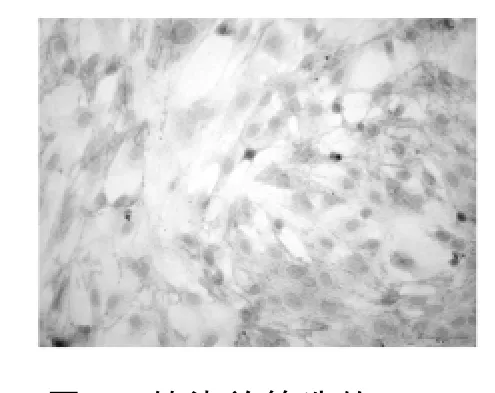
图7 转染并筛选的RSC诱导分化后细胞NSE免疫化学染色阳性(×400)

图8 转染并筛选的RSC诱导分化后细胞GFAP免疫化学染色阳性(×400)
3 讨论
近年来一些研究认为,存在于哺乳动物胚胎视网膜内及成年哺乳动物的睫状区[1-4]的干细胞或前体细胞具有一定的增殖能力,并可在体内外诱导条件下分化为多种视网膜细胞[5-6],并且某些特定基因的修饰将改变RSCs的分化特性,Jomary C[7]等将外源性转录因子Crx基因导入到小鼠及人类睫状区来源的RSCs,发现可促进RSCs分化出光敏感性光感受器细胞类型。Inoue等[8]将OTX2及CRX基因共同修饰的RSCs移植到小鼠眼内时,发现基因修饰的干细胞的视网膜整合能力和分化能力得到增强。因此,RSCs定向分化机理的探索将为致盲性眼病的细胞治疗与基因治疗方法研究奠定理论基础。
本实验通过体外分离、培养,在体外成功扩增出RSCs,具体表现为可自我更新的悬浮生长的细胞团,并且免疫细胞化学染色显示体外扩增的细胞均表达神经干细胞标志物nestin,BrdU染色阳性提示细胞具有一定的体外增殖的能力。在完成RSCs的分离、培养及鉴定后,本实验选取生长状态较佳的第2代RSCs,经过优化DNA量与脂质体的比例后成功将带有GFP的质粒导入到RSCs内,转染后细胞内出现的绿色荧光提示转染成功并表达外源性蛋白质,虽然通过转染优化后转染率约在20%左右,但经过转染后的G418筛选,可有效的将未转染外源性DNA的细胞清除,待转染1w时,基本细胞均表达绿色荧光,提示经过G418筛选后可使RSCs得到有效的富集及纯化。
转染GFP后细胞的形态及生长特性无明显改变,并且和对照组一致,在存在血清等诱导条件下,带有绿色荧光的RSCs也可分化为具有神经细胞形态的细胞,并表达神经元标志物NSE及神经胶质细胞标志物GFAP,提示本实验转染含有GFP的外源性DNA后没有对细胞的生长、增殖及分化等特性发生明显影响。本实验证明应用脂质体转染法可成功将外源性基因导入到RSCs内并表达外源性蛋白质,为下一步将一些具有治疗功能的基因或对干细胞定向分化具有重要意义的特定基因导入到细胞内进行表达的实验研究奠定了理论基础,并希望通过特定基因修饰改变干细胞的某些特性,为将阐明干细胞定向分化机理及应用特定基因修饰的干细胞进行细胞治疗及基因治疗提供了理论依据。
[1]Vincent T,Brenda LKC,Bernard JC,et al.Retinal stem cells in the adult mammalian eye[J].Science,2000,287:2032.
[2]Yang P,Seiler MJ,Aramant RB,et al.In vitro isolation and expnsion of human retinal progenitor cells[J].Exp Neurol,2002,177:326.
[3]Gu P,Harwood LJ,Zhang X,et al.Isolation of retinal progenitor and stem cells from the porcine eye[J].Mol Vis,2007,13:1045.
[4]Jian Q,Xu H,Xie H,et al.Activation of retinal stem cells in the proliferating marginal region of RCS rats during development of retinitis pigmentosa[J].Neurosci Lett,2009,465(1):41.
[5]Canola K,Angénieux B,Tekaya M,et al.Retinal stem cells transplanted into models of late stages of retinitis pigmentosa preferentially adopt a glial or a retinal ganglion cell fate[J].Invest Ophthalmol Vis Sci,2007,48(1):446.
[6]Mansergh FC,Vawda R,Millington-Ward S,et al.Loss of photo-receptor potential from retinal progenitor cell cultures,despite improvements in survival[J].Exp Eye Res,2010,91(4):500.
[7]Jomary C,Jones SE.Induction of functional photoreceptor phenotype by exogenous Crx expression in mouse retinal stem cells[J].Invest Ophthalmol Vis Sci,2008,49(1):429.
[8]Inoue T,Coles BL,Dorval K,et al.Maximizing functional photoreceptor differentiation from adult human retinal stem cells[J].Stem Cells,2010,28(3):489.

