羧基隐性孔雀石绿半抗原及全抗原的合成鉴定
张佳艳,伍金娥,常 超
(武汉工业学院食品科学与工程学院,湖北武汉430023)
羧基隐性孔雀石绿半抗原及全抗原的合成鉴定
张佳艳,伍金娥*,常 超
(武汉工业学院食品科学与工程学院,湖北武汉430023)
以4-羧基苯甲醛,N,N-二甲基苯胺为原料合成羧基化隐性孔雀石绿(COOH-LMG),经薄层色谱、红外光谱、紫外光谱、液质联用仪鉴定该羧基化隐性孔雀石绿为目标产物。羧基隐性孔雀石绿经碳二亚胺法与牛血清白蛋白(BSA)、卵清蛋白(OVA)载体蛋白相结合,分别得到免疫原与包被原。通过紫外分光光度计鉴定,人工抗原偶联物的吸收峰较反应前的反应物的吸收峰发生了漂移,证明耦合成功。新西兰大白兔经免疫原5次免疫后,得到针对隐性孔雀石绿的抗体,效价达1∶64000,为LMG的单抗的制备及其免疫学分析方法提供了重要依据。
隐性孔雀石绿,合成,半抗原,人工抗原,多克隆抗体
1 材料与方法
1.1 材料与仪器
4-羧基苯甲醛、N,N-二甲基苯胺、二甲基亚砜、牛血清白蛋白、卵清蛋白、酪蛋白、N,N-二环己基碳二亚胺(DCC)、DMF(二甲基甲酰胺)、N-羟基琥珀酰亚胺(NHS)、吐温-20、四甲基联苯胺、过氧化氢脲国药集团化学试剂有限公司上海分公司;弗氏完全佐剂、弗氏不完全佐剂 sigma公司;羊抗兔IgG-辣根过氧化物酶偶合物(GaR IgG-HRP) 碧云天生物技术研究所。
85-2型磁力搅拌器、DF-101S集热式恒温加热磁力搅拌器、RE52CS旋转蒸发器 巩义市英峪予华仪器厂;自动双重纯水蒸馏器 上海亚荣生化仪器厂;NEXUS670红外光谱仪 美国Nicolet仪器公司;Lambda25紫外分光光度仪 美国PerkinEimer公司;高效液相色谱-质谱联用仪(LC-MS/MS) 美国Waters公司;酶标仪 美国Bio-Rad公司。
1.2 实验方法
1.2.1 羧基化隐性孔雀石绿的合成 借鉴羧基隐性孔雀石绿的合成路线[14],合成路线如图1。取对醛基苯甲酸1.8g(0.01mol),N,N-二甲基苯胺7.2mL(0.05mol),无水氯化锌7.2g,无水乙醇180mL于三口圆底烧瓶中,将其置于集热式恒温加热磁力搅拌器中,氮气保护下,100℃回流24h。反应完毕后趁热将产物倒至烧杯,将烧杯置于-20℃冰箱中,24h后绿色沉淀析出,抽滤。用二甲基亚砜和乙醇的混合溶液对该沉淀重结晶,得到浅绿色结晶为羧基化隐性孔雀石绿,将其置于密闭容器中4℃下避光保存。
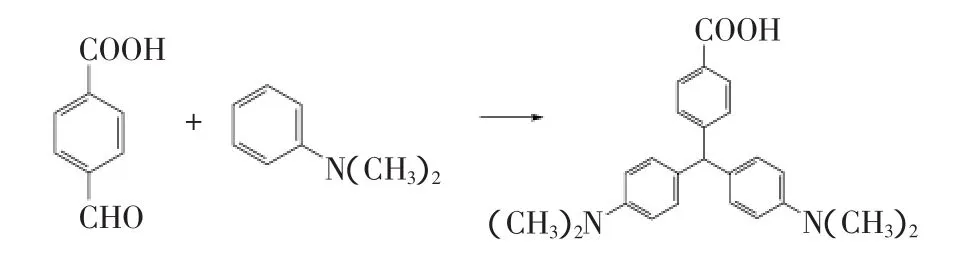
图1 隐性孔雀石绿半抗原合成路线Fig.1 Synthesis of leucomalachite green derivative
1.2.2 羧基化隐形孔雀石绿结构的鉴定 用薄层色谱、紫外分光光度仪、红外光谱仪、液质联用仪,鉴定该合成产物的结构。其中,液质联用仪的色谱条件:柱温:20℃;进样量:10μL;流速:0.2mL/min;流动相:乙腈+0.05mol/L乙酸铵缓冲液(pH4.5,75+25);质谱条件:离子源ESI(+)参数:喷雾电压4.5kV;毛细管电压16.5V;毛细管电流温度300℃;鞘气30arb;辅助气反吹气流量0arb;源内碰撞电压8.0V;毛细管透镜电压55V。
1.2.3 隐性孔雀石绿完全抗原的制备及鉴定 使用碳二亚胺法将COOH-LMG上的羧基与载体蛋白上的氨基进行偶联[15](见图2),取羧基隐性孔雀石绿37.5mg(0.1mmol)溶于2mL DMF中,磁力搅拌下加入DCC 30.9mg(0.15mmol),NHS 17.25mg(0.15mmol),于4℃下反应过夜。4000r/min离心10min,取上清液为A液。取BSA 135mg(0.002mmol)溶于pH为8.0的PBS缓冲液中为B液。磁力搅拌下将A液倒入B液,4℃下反应过夜。4000r/min离心10min,取上清液置于透析袋中4℃下用pH为7.2的PBS缓冲液透析一个星期,除去未反应的COOH-LMG、DCC、NHS、DMF等小分子物质后分装,于-20℃下保存,供免疫使用。
包被原的合成将BSA换成90mg(0.002mmol)的OVA即可。
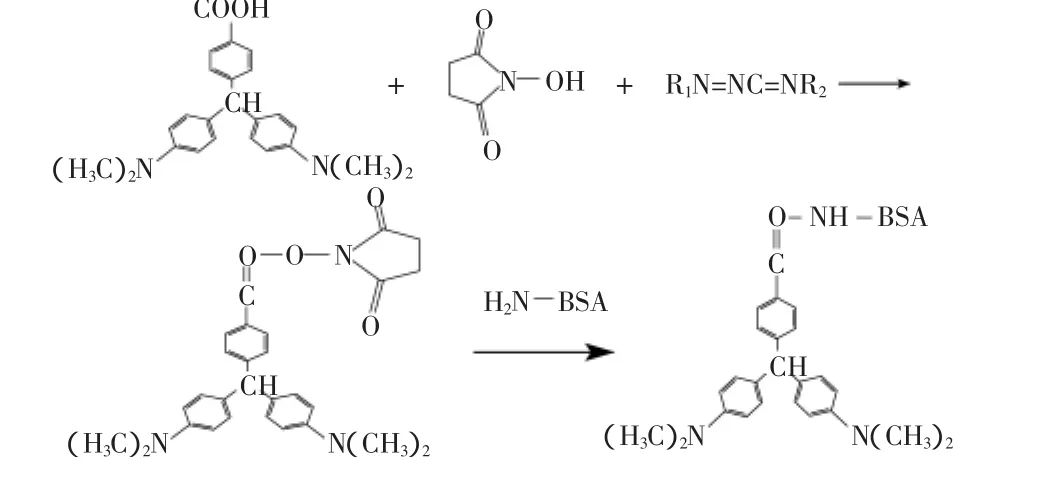
图2 隐性孔雀石绿免疫原合成路线Fig.2 Synthesis of leucomalachite green’s immunogen
1.2.4 人工抗原的鉴定 使用PBS缓冲液调零,对人工抗原做紫外扫描分析,并与半抗原及蛋白质的紫外图谱作比较,推算结合比,计算公式[16]如下:
偶联比=(A偶联物@最大吸收波长/ε半抗原@最大吸收波长)/[(A偶联物@280nm-A偶联物@最大吸收波长×ε半抗原@280nm/ε半抗原@最大吸收波长)/ε载体蛋白@280nm]
1.2.5 多克隆抗体的制备
1.2.5.1 抗血清的制备 将羧基隐性孔雀石绿完全抗原对新西兰大白兔进行免疫。初次免疫取1mL完全抗原与2mL PBS溶液混合,取混合液1mL与等量的弗氏完全佐剂混合,配成1mg/mL浓度的混合液,将乳化完全的溶液对兔子进行背部多点皮下注射,注射量为1mL/只。二周后用弗氏不完全佐剂代替弗氏完全佐剂进行二次免疫,之后每隔一个月进行一次免疫,在每次免疫后的7~10d进行采血,利用双向琼脂扩散法测定抗体效价。
1.2.5.2 抗血清的纯化、保存 辛酸-硫酸铵法从血清中纯化抗体[17]:抗血清用4倍体积乙酸-乙酸钠缓冲液稀释,用0.1mol/L NaOH调至血清稀释液为pH4.5,室温下边搅拌(磁力搅拌器),边缓慢滴加辛酸(25mL/L血清稀释液),滴加完后继续搅拌30min。离心(10000r/min,30min),收集上清夜,弃去沉淀;上清液用多层纱布过滤;按1/10体积加入PBS,用5mol/L NaOH调至pH7.4。上清液4℃预冷,在4℃按277g/L加入硫酸铵粉沫(45%饱和度),边加边搅拌,加完后继续搅拌30min。离心(5000r/min,15min),弃去上清液,收集沉淀。沉淀用少量透析液溶解(血清体积的1/10),透析并更换两次透析液或用Sephadex G-50脱盐。Ig溶液在50~55℃水浴中加热20min,离心(5000r/min,20min),上清液冻干保存。
1.2.6 抗体抗体效价测定 间接ELISA程序测定抗血清效价。将包被原NH2-OVA包被于96孔酶标板中(100μL)4℃过夜,用PBST洗板5次,200μL每孔,每次5min。加入封阻液,300μL每孔,37℃2h,洗板。加入抗体,100μL每孔,37℃反应1h,洗板。加入GaR IgGHRP,100μL每孔,37℃1h,洗板。加入显色液,100μL每孔,避光反应,显色10~15min。加入5%硫酸终止液,终止反应,酶标仪450nm下测定吸光值。
2 结果与分析
2.1 COOH-LMG的结构鉴定
COOH-LMG的分离鉴定用薄层色谱对反应原料4-羧基苯甲醛,N,N-二甲基苯胺,以及产物COOH-LMG进行分析,展板后,分别都只获得一个点,说明分离纯化达到一定的要求,且合成出与原料不同的新的产物。
2.1.1 紫外鉴定 用PBS溶液调零,得到COOH-LMG的紫外最大吸收峰为261.71nm,这与沈玉栋等[18]报道的COOH-LMG的紫外吸收峰一致。
2.1.2 红外鉴定 用红外光谱对COOH-LMG进行分析,红外图谱(图3)显示3314、1690、1400~1600cm-1处有强吸收峰,3314cm-1为O-H的伸缩振动峰,1690cm-1为C=O的伸缩振动峰,1400~1600cm-1为苯环上的C=C的伸缩振动峰,与COOH-LMG的官能团一致。
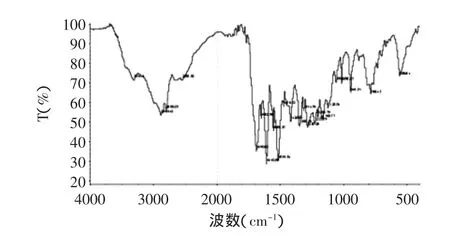
图3 COOH-LMG红外图谱Fig.3 The analysis of COOH-LMG by infrared spectrophotometry
2.1.3 液质鉴定 液相图(图4)中,1.13min处得到一强吸收峰,将该吸收峰用质谱仪进行鉴定,在一级质谱图中得到一分子量为375.2的离子峰,该分子量与COOH-LMG分子量一致。以母离子375.2m/z进行二级质谱鉴定,其分析结果如下:m/z 360.2(M+-CH3),m/z 238.6(M+-COOH-C6H5-CH3),多级质谱分析结构与COOH-LMG分子量相符合。
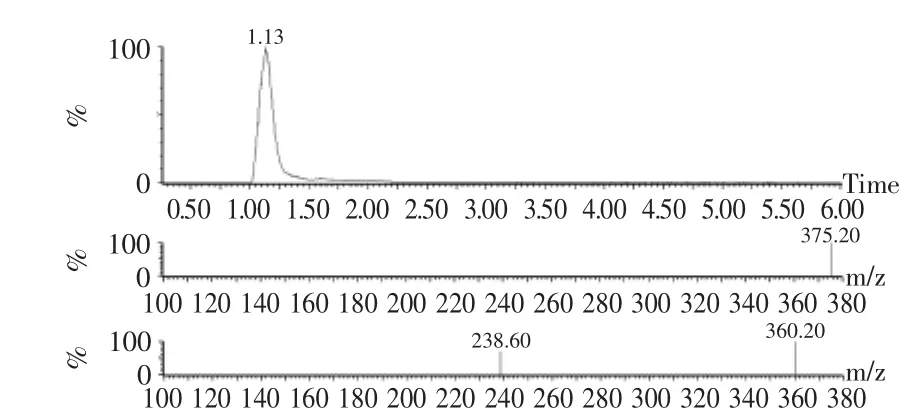
图4 COOH-LMG液质图谱Fig.4 The analysis of COOH-LMG by liquid chromatographymass spectrometry
2.2 人工抗原鉴定
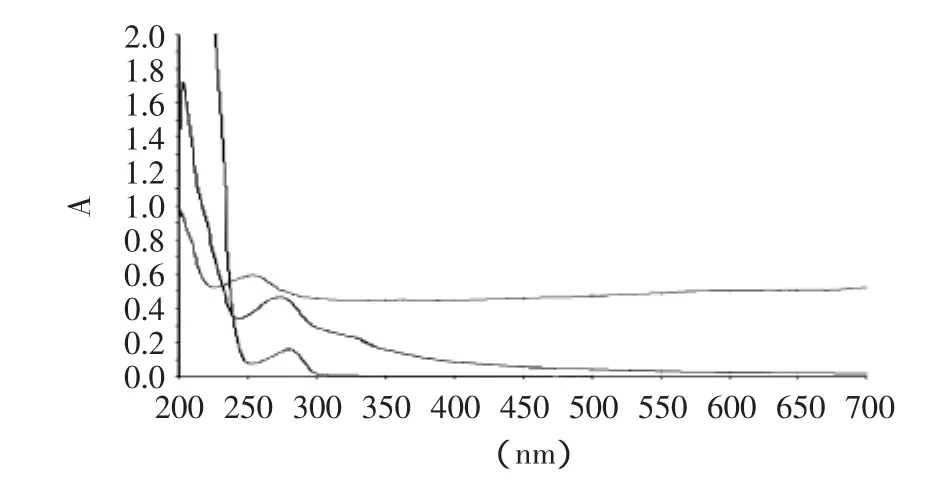
图5 半抗原、牛血清白蛋白及偶联物的紫外图谱Fig.5 The ultraviolet adsorption spectra of hapten,bovine serumalbumin(BSA)and the conjugate
用PBS调零,分别将COOH-LMG、BSA、COOHLMG-BSA进行紫外扫描。结果如图5所示,最大吸收峰分别为261.71、280、276.21nm,即COOH-LMG-BSA吸收峰分别介于COOH-LMG及BSA之间。证明耦合成功,用公式计算偶联比,其与BSA、OVA偶联比分别为11.42、14.37。
2.3 多抗血清效价测定
由方阵实验结果得到,包被原工作浓度以0.125μg/mL为佳。当包被原浓度为0.125μg/mL时,血清稀释度为1∶64000。
3 结论
隐形孔雀石绿是小分子物质,需与大分子物质如蛋白质连接后才具备免疫原性。本研究针对隐性孔雀石绿的化学结构进行改造,以4-醛基苯甲酸、N,N-二甲基苯胺为原料合成羧基化隐形孔雀石绿,经薄层色谱、紫外光谱、红外光谱、液质联用仪鉴定,获得高纯度的羧基化隐形孔雀石绿,并以碳二亚胺法制备全抗原。经动物免疫后得到针对隐性孔雀石绿的抗血清,用间接ELISA程序测定抗血清效价高达1∶64000,在此基础上所生产出的试剂盒可直接检测孔雀石绿的代谢产物隐性孔雀石绿,因而在现场筛选和大量样本的快速监测中显示了独特的优势。
[1]Alderman D J.Malachite green:a review[J].Fish Dis,1985(8):289-298.
[2]Plakas S M,El Said K R,Stehly G R,et al.Uptake,tissue distribution,and metabolism of malachite green in the channel catfish(Ictalurus punctatus)[J].Fish Aquat Sci,1996,53:1427-1433.
[3]高露姣,蔡友琼,姜朝军,等.孔雀石绿及其主要代谢产物在欧洲鳗鲡肌肉中的蓄积及消除规律[J].水产学报,2007(9):104-108.
[4]Culp S J,Beland F A.Malachite green:A toxicological review [J].Am Coll Toxicol,1996,15:219-238.
[5]Sandra J C,Paul W M,Ronald W T,et al.Carcinogenicity of malachite green chloride and leucomalachite green in B6C3F1 mice and F344 rats[J].Food and Chemical Toxicology,2006(44):1204-1212.
[6]Culp S J,Blankenship L R,Kusewitt D F,et al.Toxicity and metabolism of malachite green and leucomalachite green during short-term feeding to Fischer 344 rats and B6C3F1 mice[J]. Chem Biol Interact,1999,122:153-170.
[7]Mittelstaedt R A,Mei N,Webb P J,et al.Genotoxicity of malachite green and leucomalachite green in female Big Blue B6C3F1 mice[J].Mutat Res,2004,561:127-138.
[8]Kamila Mitrowska, AndrzejPosyniak, Jan Zmudzki. Determination of alachite green and leucomalachite green in carp muscle by liquid chromatography with visible and fluorescence detection [J].Journal of Chromatography A,2005,1089:187-192.
[9]Tarbin J A,Barnes K A,Bygrave J,et al.Screening and confirmation of triphenylmethane dyes and their leuco-metabolites in trout muscle using HPLC-vis and ESPLCMS[J].Analyst, 1998,123:2567-2571.
[10]Uis Valle,Cecilia Diaz,Antonio L,et al.Determination of the sum of malachite green and leucomalachite green in salmon muscle by liquid chromatography-atmospheric pressure chemical ionisation-mass spectrometry[J].Chromatography A,2005,1067:101-105.
[11]Geraldine Dowling,Patrick P J Mulder,Conor Duffy,et al. Confirmatory analysis of malachite green,leucomalachite green,crystal violet and leucocrystal violet in salmon by liquid chromatography-tandem mass spectrometry[J].Analytica Chimica Acta,2007,586:411-419.
[12]Kim-Chung Lee,Jian-Lin Wu,Zongwei Cai.Determination of malachite green and leucomalachite green in edible goldfish muscle by liquid chromatography-ion trap mass spectrometry[J]. Journal of Chromatography B,2006,843:247-251.
[13]Van de Riet J M,Murphy C J,Pearce J N,et al.Determination of malachite green and leucomalachite green in a variety of aquacultured products by liquidchromatography with tandem mass spectrometry detection[J].AOAC Int,2005,88:744-749.
[14]Yang M C,Fang J M,Kuo T F,et al.Production of antibodies for selective detection of malachite green and the related triphenylmethane dyes in fish and fishpond water[J].Journal of Agricultural and Food Chemistry,2007,55(22):8851-8856.
[15]李晓丽,陈雪岚,刘春梅,等.孔雀石绿单克隆抗体的制备及直接竞争ELISA方法的建立[J].食品科学,2009,30(24):283-286.
[16]杨利国,胡少昶,魏平华,等.酶联免疫测定技术[M].南京:南京大学出版社,1998:95-96.
[17]朱立平,陈学清.免疫学常用实验方法[M].北京:人民军医出版社,2000:32-33.
[18]沈玉栋,王宇,孙远明,等.隐性孔雀石绿半抗原与全抗原设计、合成及鉴定[J].食品科学,2008,29(7):263-266.
Preparation and identification of hapten and complete antigens of carboxy-leucomalachite green
ZHANG Jia-yan,WU Jin-e*,CHANG Chao
(College of Food Science and Engineering,Wuhan Polytechnic University,Wuhan 430023,China)
Carboxy-leucomalachite green(COOH-LMG)was synthesized facilely with N,N-dimethylanilin and 4-Carboxybenzaldehyde as raw materials,and it was identified by the thin layer chromatography(TLC),infrared spectrometry(IRS),ultraviolet spectrum(UV)and liquid chromatography-mass spectrometer(LC-MS). COOH-LMG was conjugated to bovine serum albumin(BSA),ovalbumin(OVA)to form antigen and immunogen,and they were identified by UV spectra analysis.The antibodies against leucomalachite green(LMG)were obtained from rabbits after five times immunizations.The titer of the polyclonal antibody against the LMG was about 1∶64000 by indirect ELISA.It laid the foundation for further gain monoclonal anti-LMG and its immunological assay.
leucomalachite green;synthetize;hapten;complete antigens;polyclonal antibody
Q939.91
A
1002-0306(2012)09-0171-04
孔雀石绿(Malachite green,MG)是一种合成的三苯基甲烷类工业染料,具有高效广谱杀菌作用,在水产养殖中用途非常广泛,经常用它进行水体的消毒,杀灭寄生虫,预防鱼的水霉病、鳃霉病、小瓜虫病等,效果非常好[1]。孔雀石绿进入水生物体内很快代谢成隐性孔雀石绿(Leucomalachite green,LMG),并且隐性孔雀石绿消除速度较母体药物慢,在很多国家被视为残留标示物[2-3]。随着研究的深入,孔雀石绿和隐性孔雀石绿潜在致癌、致畸、致突变等毒副作用受到关注。隐性孔雀石绿难溶于水,难于排出体外,其残留毒性比孔雀石绿更强[4-7]。目前隐性孔雀石绿检测主要使用的是仪器方法,如HPLC[8-9]、LC-MS[10-13],然而仪器方法所需样品处理复杂,检测成本较高,一般的实验室难于满足设备要求,不适合大量样品的快速筛选。酶联免疫吸附测定法(ELISA)主要应用抗原抗体特异性反应原理检测小分子化合物,具有快速、灵敏、高通量等优点,广泛用于大批量药物残留筛选。国外已经开始研究孔雀石绿ELISA检测方法,并有商品化的试剂盒上市,如美国Bioo Scientific研制的Max Signal TM孔雀石绿ELISA试剂盒已经在中国进行销售,用于鱼、虾等水产品的检测。该试剂盒检测的靶物质为孔雀石绿,不能直接检测代谢产物隐性孔雀石绿,在检测之前,需将隐性孔雀石绿转变成孔雀石绿,使样品前处理变得复杂。因此研究具有自主知识产权的隐性孔雀石绿试剂盒具有广阔的应用前景和经济价值。本研究通过合成羧基化的隐性孔雀石绿免疫原,免疫家兔获得高效价的隐性孔雀石绿多克隆抗体。
2011-08-22 *通讯联系人
张佳艳(1986-),女,硕士研究生,研究方向:食品质量与安全。
湖北省自然科学基金(2008CDB357);武汉工业学院研究生创新基金(09cx024)。

