系统Ⅱ乙烯对采后番茄果实抗冷过程中抗氧化酶的影响
吕胜男,赵瑞瑞,申 琳,赵丹莹,生吉萍,2,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国人民大学农业与农村发展学院,北京 100872;3.北京市西城区疾病预防控制中心,北京 100011)
系统Ⅱ乙烯对采后番茄果实抗冷过程中抗氧化酶的影响
吕胜男1,赵瑞瑞1,申 琳1,赵丹莹3,生吉萍1,2,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国人民大学农业与农村发展学院,北京 100872;3.北京市西城区疾病预防控制中心,北京 100011)
以反义ACS2 番茄、野生型丽春果实和经乙烯利处理的反义ACS2 番茄果实分别作为系统Ⅱ乙烯缺失模型、系统Ⅱ乙烯正常合成模型和系统Ⅱ乙烯补偿模型,研究系统Ⅱ乙烯对低温胁迫下氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性的影响。研究发现,丽春果实和经乙烯利处理的反义ACS2果实较未处理的反义ACS2果实组冷害指数低,电解质渗透率的增长被抑制,CAT、APX、SOD平均活性水平提高,而两组的POD活性增长分别被抑制和诱导。这说明系统Ⅱ乙烯能提高CAT、APX、SOD活性水平并调控POD活性变化,对增强低温胁迫下番茄果实的抗冷能力有积极作用。
乙烯;抗氧化酶;氧化胁迫;抗冷性;番茄
低温贮藏能有效抑制采后果蔬的呼吸作用和致病菌的生长,并广泛应用于果蔬保鲜,但同时也会对冷敏感型果蔬造成伤害。采后果蔬受到低温胁迫后,多种生理生化代谢失调,果蔬表面出现水浸斑,凹陷,组织褐变或崩溃,果实不能正常转色,引起腐烂等冷害症状[1],使其失去商品价值。低温对细胞造成的伤害主要来源于其引发的氧化胁迫[2]。正常情况下,植物细胞可通过多条途径不断产生超氧阴离子自由基(O2-·)、过氧化氢(H2O2)和羟自由基(·OH)等活性氧类物质(reactive oxygen species,ROS),并且通过由清除活性氧的酶类和非酶类物质构成的抗氧化系统清除使之处于动态平衡状态[3]。当温度低于冷害临界点时,植物细胞内的这种平衡会被打破,大量的活性氧积累并以其极强的氧化性对细胞膜质分子、大分子蛋白及其他活性分子造成破坏[4-5],而抗氧化清除系统则能保护细胞延迟或阻止伤害。戴金平等[6]发现,低温下经冷锻炼的黄瓜幼苗超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)仍保持高活性从而避免受害,而未经低温锻炼的幼苗这些酶的活性均下降,导致幼苗受到伤害甚至死亡;Zhao等[7]研究发现,抗氧化酶(catalase,CAT)、POD活性的高低与番茄果实品种的抗冷性存在正相关。可见,高活性的抗氧化酶有助于植物抵御低温胁迫,对提高采后果实抗冷过程十分重要。
乙烯在采后果实的抗冷过程中同样起到重要作用。Dong等[5]用乙烯受体抑制剂1-MCP(1-methylcyclopropene)处理加重了油桃果实冷害、内部褐变以及果肉海绵化程度;1-MCP处理也致使‘Shamouti’柑橘和香蕉果实更容易受到低温胁迫的伤害[8-9];而500mg/L乙烯利则可减轻5℃贮藏芒果果实冷害发生[10]。可见,乙烯对于植物暴露在低温环境中抗冷能力的增强能起到重要作用。相反,也有研究表明在部分种类的采后果实中乙烯会降低果实抗冷性。Pesis等[11]用外源乙烯处理梨果实后置于低温条件下,梨果皮褐色斑点增多、腐烂加速、冷害加重,而1-MCP处理能有效抑制冷害发生;在呼吸跃变型李果实中降低内源乙烯释放量也可以缓解冷害发生,而呼吸越变型与非跃变型的采后李果实相比更易受到低温伤害[12]。产生这种差异的原因在于植物对乙烯的调控具有敏感的浓度效应,高浓度的乙烯反而会加重胁迫伤害。
呼吸跃变型果实成熟和逆境诱导过程中乙烯自我催化大量生成的系统Ⅱ乙烯浓度远大于系统Ⅰ乙烯,其在番茄抗冷过程中对抗氧化酶的作用未见报道。番茄ACS2基因在系统Ⅱ乙烯的合成途径中起主导作用[13]。ACS2的反义抑制会使番茄中乙烯的合成下降99.5%,导致果实的不成熟表型[14]。本实验采用反义ACS2番茄果实作为系统Ⅱ乙烯缺失模型,同基因型的丽春果实作为系统Ⅱ乙烯正常合成模型,经乙烯利处理的反义ACS2番茄果实作为系统Ⅱ乙烯补偿模型,分别研究各模型在低温胁迫下耐低温胁迫的能力,CAT、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、POD和SOD的活性变化,为掌握系统Ⅱ乙烯在果实抗冷过程中的作用提供理论依据。
1 材料与方法
1.1 材料及处理
转反义ACS2番茄由中国农业大学食品科学与营养工程学院果蔬采后生物技术实验室提供,其野生型品种为丽春(Lycopersicon esculentum cv Lichun)。所用试材播种于自小汤山特菜基地,花期标记,于绿熟期采摘。挑选大小均匀、无病虫害和机械伤的果实作为实验材料,运至中国农业大学食品学院地下冷库(15℃)预冷24h后,于3%次氯酸钠溶液中浸泡2min 进行表面消毒,随后用清水洗净。处理组用0.04%乙烯利浸泡果实1min,对照组用清水浸泡,自然晒干。处理后的果实贮藏于冷库中)(4℃±1℃,相对湿度85%),定期取样,进行酶活测定及冷害指数统计。
1.2 试剂与仪器
40 %乙烯利水剂 四川国光农化有限公司;其他常用试剂和药品为国产分析纯。
20G高速台式冷冻离心机 上海安亭科学仪器厂;UV-1800型紫外-可见光分光光度计 日本岛津制作所;恒温水浴锅 北京靖卫科学仪器厂;PB-10型pH计 北京奥多利斯科学仪器有限公司。
1.3 方法
1.3.1 冷害指数(chilling injury index,CI)
统计采用Ding等[15]的方法,每次从各组中随机抽取8个果实进行冷害指数统计并加以计算。冷害分级见表1。统计各冷害级别果实个数后,按下式计算冷害指数:
冷害指数=∑(冷害级别×该级别果数)/(4×总果数)
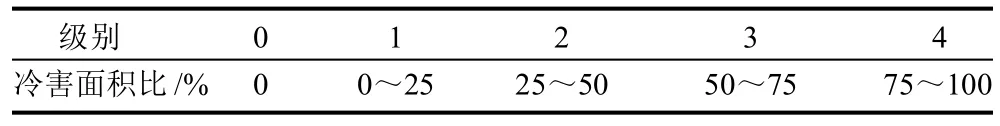
表1 番茄果实冷害分级表Table 1 Cold injury grading of tomato fruit
1.3.2 电解质渗透率的测定
参考Zhao等[16]的方法。
1.3.3 过氧化氢酶(CAT)活性测定
参照Aebi[17]的方法,略有改动。将1mL 酶液与1mL缓冲液(50mmol/L 磷酸缓冲液, pH7.0)混合,加入1mL 0.1% H2O2,立即混匀,测定在240nm波长处2min 内吸光度的变化。一个酶活力单位:以1min内A240减少0.1的酶量为1U,酶比活力以U/g表示。
1.3.4 抗坏血酸过氧化物酶(APX)活性测定
参照Nakano等[18]的方法,略有改动。3mL反应液(50mmol/L pH7.0 磷酸缓冲液,0.1mmol/L H2O2,0.5mmol/L抗坏血酸)加入0.2mL 的酶液启动反应。测定在290nm 波长处1min 内吸光度的变化。酶比活力以U/g表示,以1min 内A290减少0.1 的酶量为一个活力单位(U)。
1.3.5 过氧化物酶(POD)活性测定
采用愈创木酚法[19]测定,略有改动。37℃酶反应底物(1mL 0.1mol/L pH 5.0醋酸缓冲液+1mL 0.1% 的愈创木酚+1mL 0.08% H2O2)加入0.5mL 酶提取液,立即混匀,测定在470nm 波长处3min内吸光度的变化。酶活性以U/g表示,以1min 内A470减少0.1的酶量为一个活力单位(U)。
1.3.6 超氧化物岐化酶(SOD)活性
采用NBT法[20],略有改动。3mL酶反应液:50mmol/L pH7.8 的磷酸缓冲液(含13mmol/L甲硫氨酸、75μmol/L NBT、4μmol/L核黄素和100nmol/L EDTA)加入200μL酶提取液,光照10min 后,在560nm波长处比色,以抑制NBT光还原50%为一个活力单位(U)。
1.4 统计分析
采用Excel软件对检测数据进行统计分析与制图;采用SPSS 17.0进行差异显著性分析。
2 结果与分析
2.1 不同模型番茄果实在低温胁迫下冷害指数和电解质渗透率变化
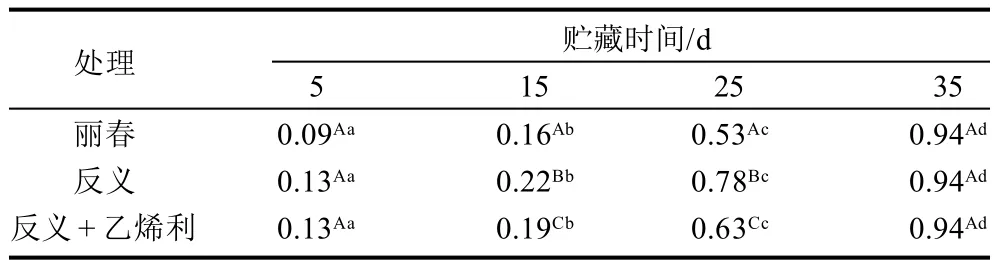
表2 不同模型番茄果实低温(4℃)贮藏下的冷害指数Table 2 Changes in chilling injury index of tomato fruit during cold storage
随着低温胁迫时间的增加,3组番茄果实的冷害指均呈上升趋势,并在25d时上升幅度较大(表2)。贮藏期间,反义ACS2番茄果实冷害指数高于丽春组,在25d时相差最大,比丽春组冷害指数高出47.2%(P<0.05)。贮藏初期,反义ACS2果实的冷害指数与其乙烯利处理组相比差别不大,但在15d和25d,乙烯利处理组的冷害指数低于未处理组,仅分别为未处理组的85.8%和80.0%(P<0.05)。贮藏结束时,3组果实的冷害指数均达到0.94。
电解质渗透率反应植物细胞膜受损程度[7]。低温贮藏15d开始,与反义ACS2组番茄相比,丽春组番茄电解质渗透率的增加受到了抑制,经过乙烯利处理的反义ACS2处理组番茄中的电解质渗透率也低于未经处理的反义组果实,并且在15d和35d时差异显著(P<0.05)(图1)。从各组的冷害指数和电解质渗透率的变化情况可见,丽春组和经乙烯利处理后的反义ACS2果实对低温的耐受能力均高于未经处理的反义ACS2果实组。
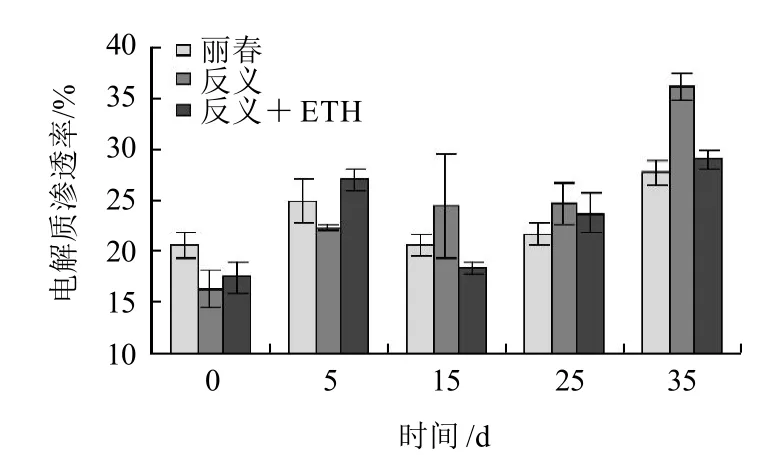
图1 低温(4℃)胁迫下丽春、反义ACSZ、乙烯利处理反义ACSZ番茄果实电解质渗透率的变化Fig.1 Changes in electrolyte leakage of tomato fruit during cold storage
2.2 不同模型番茄果实在低温胁迫下过氧化氢酶(CAT)活性变化
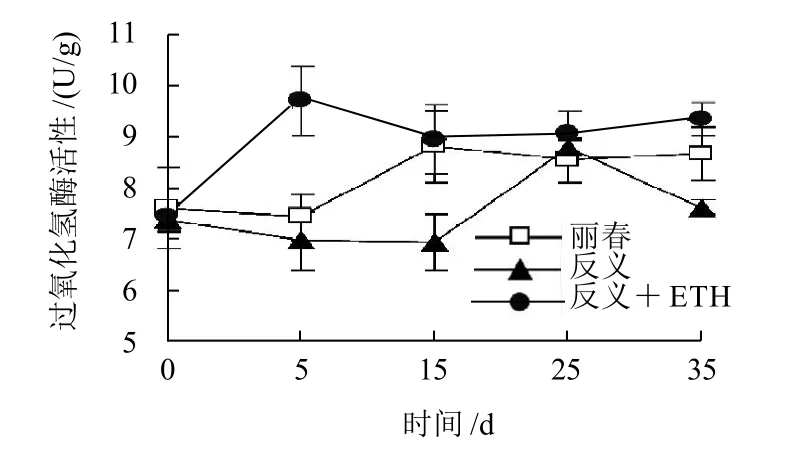
图2 低温(4℃)胁迫下丽春、反义ACSZ、乙烯利处理反义ACSZ番茄果实过氧化氢酶(CAT)活性变化Fig.2 Changes in CAT activity of tomato fruit during cold storage
丽春组、反义ACS2及其乙烯利处理组的番茄果实CAT活性在低温贮藏开始时无明显差异(图2)。丽春果实CAT活性在低温5~15d显著上升,15d时其活性为整个贮藏期的峰值,高出5d时的18.6%(P<0.05);15d后CAT活性小幅度下降并维持在较高水平。反义ACS2果实中CAT活性在贮藏前期略有下降,低温25d才出现峰值,35d时活性又急剧下降。虽然反义ACS2组与丽春组的CAT活性峰值水平相差不大,但反义ACS2番茄果实的峰值出现时间较丽春组迟10d。另外,在整个贮藏期内,丽春果实中的CAT活性平均水平也要高于反义ACS2番茄果实组。乙烯利处理后的反义ACS2果实CAT活性在整个低温贮藏期处于较高水平,在低温5d时,处理组的CAT活性就出现整个贮藏期活性的高峰,比未经处理的反义ACS2果实组活性峰值提前20d出现,并且显著高于未处理组的峰值(P<0.05)。15d时该组的CAT活性下降为其峰值的92.3%(P<0.05),贮藏中后期(15~35d),该组的CAT活性又呈现小幅度趋势。未处理组在5d、15d CAT活性分别低于乙烯利处理组28.1%和22.4%(P<0.05)。
2.3 不同模型番茄果实在低温胁迫下的抗坏血酸过氧化物酶(APX)活性变化
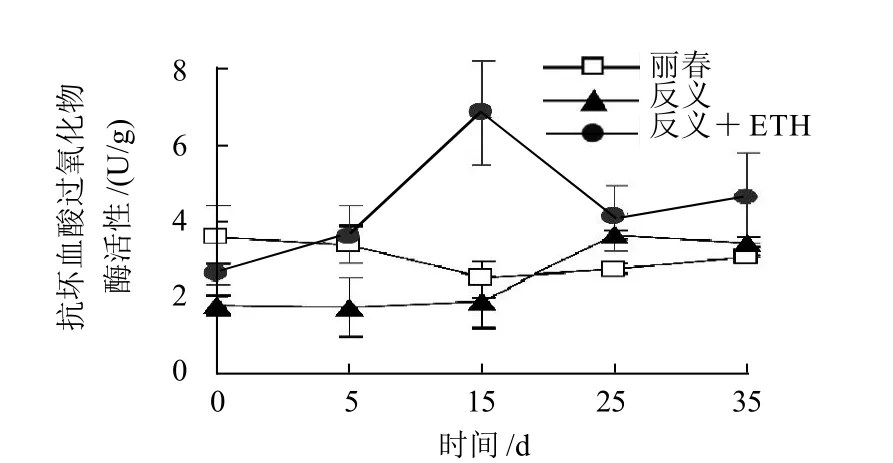
图3 低温(4℃)胁迫下丽春、反义ACSZ、乙烯利处理反义ACSZ番茄果实抗坏血酸过氧化物酶(APX)活性变化Fig.3 Changes in APX activity of tomato fruit during cold storage
丽春果实APX活性在贮藏初期最高,低温5~15d时下降,15d后又呈现缓慢上升趋势(图3)。在低温贮藏前期,反义ACS2果实中APX活性低于丽春组,5d和15d 时差异显著(P<0.05);25d 时反义ACS2果实中APX活性才上升至与丽春组在5d时的活性水平相当,但贮藏后期反义ACS2果实组APX活性又呈现下降趋势。乙烯利处理后的反义ACS2番茄果实中APX活性在低温15d时显著上升并出现峰值(P<0.05),比未处理组在25d出现的峰值提前10d,并高出86.1%(P<0.05)。处理组的APX活性在贮藏末期35d 仍有小幅度上升趋势。未处理组除了在25d峰值及以后的时间与处理组无显著差异,贮藏前期APX活性均显著低于处理组(P<0.05)。2.4 不同模型番茄果实在低温胁迫下的过氧化物酶(POD)活性变化

图4 低温(4℃)胁迫下丽春、反义ACSZ、乙烯利处理反义ACSZ番茄果实过氧化物酶(POD)活性变化Fig.4 Changes in POD activity of of tomato fruit during cold storage
低温胁迫下,3组果实的POD活性变化趋势各不相同(图4)。丽春果实组POD活性在低温15d时活性水平显著增加,为5d 时的1.7倍(P<0.05),随后贮藏中其活性变化不大。反义ACS2果实POD活性在15d 时显著下降(P<0.05),与丽春果实组POD活性相当,15d后又呈现上升趋势。低温贮藏期内,反义ACS2果实中POD活性的平均水平要高于丽春组。反义ACS2果实经过乙烯利处理补偿系统Ⅱ乙烯后,其POD活性在低温5d前上升,随后下降,15d后又开始上升,该组的POD活性在5、15、35d时显著高于未处理组(P<0.05)。未处理组POD活性在5、15、35d时仅分别为处理组活性的84.5%、63.3%和79.3%(P<0.05)。
2.5 不同模型番茄果实在低温胁迫下的超氧化物岐化酶(SOD)活性变化
低温胁迫初期,丽春组SOD活性小幅度上降,5d后其活性呈现下降趋势,25d时其活性已经下降为5d时的56%(P<0.05)。贮藏35d时,丽春组的SOD活性又上升至与5d时的水平相当(图5)。反义ACS2果实组SOD活性在低温胁迫前期显著下降(P<0.05),15d 后其变化趋势与丽春番茄中的SOD活性变化趋势较为相似,先下降,25d时活性最低,后期又呈现上升趋势。尽管在35d贮藏结束时两组的SOD活性基本相当,丽春果实中的SOD活性在低温胁迫5d开始要高于反义ACS2果实组,并且这种差异在低温第5天时显著(P<0.05)。乙烯利处理组的反义ACS2果实SOD活性在5~15d时上升,随后下降,贮藏末期25~35d 时继续上升,35d时其SOD活性比5d时的高32.6%(P<0.05)。未处理组的SOD活 性总体水平低于处理组,并且在35d时显著低于处理组(P<0.05)。

图5 低温(4℃)胁迫下丽春、反义ACSZ、乙烯利处理反义ACSZ番茄果实超氧化物岐化酶(SOD)活性变化Fig.5 Changes in SOD activity of of tomato fruit during cold storage
3 讨 论
由各组番茄的冷害指数和电解质渗透率的变化可知,低温下反义ACS2果实系统Ⅱ乙烯的合成缺失使其较系统Ⅱ乙烯正常合成的丽春果实遭受了更严重的低温伤害,用乙烯利处理补偿系统Ⅱ乙烯的反义ACS2果实抗冷能力也高于反义ACS2组。这证明对于番茄而言,系统Ⅱ乙烯正向调控番茄的抗冷能力。这与陈鑫瑶等[21]的结论相符,内源乙烯的生物合成对番茄抵御低温的过程有积极作用。
氧化胁迫是植物组织对低温胁迫的一种早期响应,由各种抗氧化酶相互协同完成活性氧的清除:首先SOD通过歧化反应清除O2-·生成无毒的O2和毒性较低的H2O2,后者再被CAT、POD或APX还原为H2O,从而限制O2-·与H2O2反应生成毒性更强的·OH[2,22]。各种抗氧化酶酶活水平和峰值出现时间影响番茄对低温胁迫的耐受程度,酶活水平越高、对细胞的保护越好,果实受到的低温伤害越小。除POD外,系统Ⅱ乙烯正常合成的丽春果实组CAT、APX、SOD活性在低温下诱导上升出现高水平酶活的时间较系统Ⅱ乙烯缺失的反义ACS2果实的早,并且SOD峰值水平也高于反义ACS2组。经过乙烯利补偿系统Ⅱ乙烯的反义ACS2果实组出现了同样的情况,3种酶的高峰也要早于未经补偿的反义ACS2果实组或诱导了更高的活性水平的出现。另外,在贮藏末期丽春组和乙烯利处理反义ACS2组这3种酶的活性也都呈现上升趋势。以上说明系统Ⅱ乙烯在受低温胁迫的果实中能够提前CAT、APX、SOD高水平的活性到来时间或增强其酶活水平,这也是反义ACS2果实组冷害指数高于其他两组的原因。乙烯利处理的反义ACS2组POD活性平均水平高于未经处理的反义组,说明补偿系统Ⅱ乙烯后诱导了POD活性的增强,与其抗冷能力正相关。而丽春组的POD活性在低温贮藏期间大部分时间内反而显著低于反义ACS2果实组(P<0.05),在樱桃番茄[23]、黄瓜[24]、柠檬[25]、桃[26]果实中也发现过同样的现象,抗冷能力强的果实中POD活性反而受到抑制。低温胁迫下POD 变化的不确定性,可能与POD功能多样性有关,POD除了能减少代谢自由基,也参与活性氧的产生和膜脂过氧化[27],但POD活性变化对植物抗冷能力影响的作用机制仍需进一步探索。
由以上可见,系统Ⅱ乙烯对低温胁迫下果实抗氧化酶系统具有重要的调控作用,进而增强番茄果实的抗冷能力。但是系统Ⅱ乙烯在番茄抗冷过程中对其他生理生化过程和抗冷过程相关基因表达的调控情况如何,仍有待进一步研究。
[1] WANG C Y, BUTA J G. Methyl jasmonate reduce chilling injury in cucurbita pepo through its regulation of abscisic acid and polyamine levels[J]. Environ Exp Bot, 1994, 34(4): 427-432.
[2] HARIYADI P, PARKIN K L. Chilling-induced oxidative stress in cucumber fruits[J]. Postharvest Biol Technol, 1991, 1(1): 33-45.
[3] 曹锡清. 膜质过氧化对细胞与机体的作用[J]. 生物化学与生物物理学进展, 1986, 13(2): 17-23.
[4] 赵天宏, 孙加伟, 付宇. 逆境胁迫下植物活性氧代谢及外源调控机理的研究进展[J]. 作物杂志, 2008(3): 10-13.
[5] DONG L, ZHOU H W, SONEGO L, et al. Ethylene involvement in the cold storge disorder of ‘Flavortop’ nectarine[J]. Postharvest Bio Technol, 2001, 23(2): 105-115.
[6] 戴金平, 沈征言. 低温锻炼对黄瓜幼苗几种酶活性的影响[J]. 植物学报, 1991, 33(8): 627-632.
[7] ZHAO Danying, SHEN Lin, FAN Bei, et al. Physiological and genetic properties of tomato fruits from 2 cultivars differing in chilling tolerance at cold storage[J]. J Food Sci, 2009, 74(5): 348-352.
[8] PORAT R, WEISS B, COHEN L, et al. Effects of ethylene and 1-methylcyclopropene on the postharvest qualities of ‘Shamouti’ oranges [J]. Postharest Biol Technol, 1999, 15(2): 155-163.
[9] JIANG Y M, JOYCE D C, JIANG W B, et al. Effects of chilling temperatures on ethylene binding by banana fruit[J]. Plant Growth Regul, 2004, 43(2): 109-115.
[10] NAIR S, SINGH Z, TAN S C. Aroma volatiles emission in relation to chilling injury in ‘Kensington Pride’ mango fruits[J]. J Hort Sci Biotechnol, 2003, 78(6): 866-873.
[11] PESIS E, ACKERMAN M, BEN-ARIE R, et al. Ethylene involovement in chilling injury sympotoms of avcado during cold storage[J]. Postharest Biol Technol, 2002, 24(2): 171-181.
[12] CANADAN A P, GRAELL J, LARRIGAUDIERE C. Roles of climacteric ethylene in the development of chilling injury in plums[J]. Postharvest Bio Technol, 2008, 47(1): 107-112.
[13] BARRY C S, LLOP-TOUS M I, GRIERSON D. The regulation of 1-aminocyclopropane-1-carboxylic acid synthase gene expression during the transition from system-1 to system-2 ethylene synthesis in tomato [J]. Plant Physiol, 2000, 123(3): 979-986.
[14] OELLER P W, WONG L M, TAYLOR L P, et al. Reversible inhibition of tomato fruit senescence by antisense RNA[J]. Science, 1991, 254 (5030): 437-439.
[15] DING Changkui, WANG C, GROSS K C, et al. Jasmonate and salicylate induce the expression of pathogenesis-related-protein genes and increase resistance to chilling injury in tomato fruit[J]. Planta, 2002, 214 (6): 895-901.
[16] ZHAO Danying, SHEN Lin, FAN Bei, et al. Ethylene and cold participate in the regulation of LeCBF1 gene expression in postharvest tomato fruits[J]. FEBS Lett, 2009, 583(20): 3329-3334.
[17] AEBI H. Catalase in vitro[J]. Methods Enzynol, 1984, 105: 121-126. [18] NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by ascorbate specific peroxidase in spinach chlorplasts[J]. Plant Cell Physiol, 1981, 22(5): 867-880.
[19] ZAUBERMAN G, RONEN R, AKERMAN M, et al. Postharvest retention of the red colour of litchi fruit pericarp[J]. Sci Hortic, 1984, 47(1/2): 89-97.
[20] DHINDSA R S, PLUMB P, THORPE T A. Leaf senescence:correlated with increased levels of membrane permeability and lipid peroxi- dation and decreased levels of superoxide dismutase and catalase[J]. J Exp Bot, 1981, 32(1): 93-101.
[21] 陈鑫瑶, 生吉萍, 胡朋, 等. 外源乙烯和1-MCP处理对番茄采后贮藏期抗冷性的影响[J]. 食品科学, 2008, 29(7): 466-469.
[22] 赵丹莹, 申琳, 于萌萌, 等. 采后番茄果实抗氧化酶活与抗冷性的关系[J]. 食品科学, 2009, 30(14): 309-313.
[23] ZHANG Xinhua, SHEN Lin, LI Fujun , et al. Up-regulating arginase contributes to amelioration of chilling stress and the antioxidant system in cherry tomato fruits[J]. J Sci Food Agric, 2010, 90(13): 2195-2202.
[24] WANG L, CHEN W J, WANG Q, et al. Coronatine enhances chilling tolerance in cucumber (Cucumis Sativus L.) seedlings by improving the antioxidative defence system[J]. J Agronomy Crop Sci, 2009, 195(5): 377-383.
[25] SAFIZADELA M R, RAHEMI M, AMINLARI. Effect of postharvest calcium and hot-water treatments on catalase, peroxidase and superoxide dismutase in chilled Lisbon lemon fruit[J]. Int J Agric Res, 2007, 2(5): 440-449.
[26] JIN Peng, WANG Kaituo, SHANG Haitao, et al. Low-temperature conditioning combined with methyl jasmonate treatment reduces chilling injury of peach fruit[J]. J Sci Food Agric, 2009, 89(10): 1690-1696.
[27] NIINOMI A, MORIMOTO M, SHIMIZU S. Lipid peroxidation by the [peroxidase/ H2O2/ phenolic] system[J]. Plant Cell Physiol, 1987, 28 (4): 731-734.
Effect of System-2 Ethylene on Antioxidant Enzyme Activities in Cold Resistance Process of Tomato Fruits
To analyze the effect of system-2 ethylene on the activities of catalase (CAT), ascorbate peroxidase (APX), peroxidase (POD) and superoxide dismutase (SOD) during exposure to cold stress, anti-sense ACS2, wild-type Lichun and ethephon-treated anti-sense ACS2 tomato fruits were used to the models of non-system-2 ethylene synthesis, normal system-2 ethylene synthesis and compensative system-2 ethylene synthesis, respectively. It was indicated that wild-type Lichun and ethephon-treated anti-sense ACS2 tomato fruits decreased chilling injury index, inhibited the increase of electrolyte leakage and increased the average activities of CAT, APX and SOD compared with native anti-sense ACS2 tomato fruits. The increase of POD activity was inhibited in wild-type Lichun but induced in ethephon-treated anti-sense ACS2. From these results, it can be concluded that system-2 ethylene can improve the cold resistance of tomato during exposure to cold stress by increasing CAT, APX and SOD activities and regulating POD activity.
ethylene;antioxidant enzymes;oxidative stress;cold resistance;tomato
TS255.3
A
1002-6630(2012)08-0296-05
2011-04-11
国家自然科学基金面上项目(31071623;30972065);国家公益性行业(农业)科研专项(200803033)
吕胜男(1986—),女,硕士研究生,研究方向为果蔬采后生理与食品生物技术。E-mail:lvshengnan06@gmail.com
*通信作者:生吉萍(1967—),女,教授,博士,研究方向为果蔬采后生理与生物技术。E-mail:pingshen@cau.edu.cn

