反相高效液相色谱法测定5种藏羌五加菜中金丝桃苷的含量
李艳丹,黄艳菲,丁 玲,左 旭,刘 圆*
(西南民族大学民族医药研究院,四川 成都 610041)
反相高效液相色谱法测定5种藏羌五加菜中金丝桃苷的含量
李艳丹,黄艳菲,丁 玲,左 旭,刘 圆*
(西南民族大学民族医药研究院,四川 成都 610041)
目的:建立5种藏羌五加菜中金丝桃苷的反相高效液相色谱法含量测定方法,并比较其金丝桃苷的含量差异。方法:采用液相色谱-质谱定性鉴别红毛五加、糙叶藤五加和蜀五加中金丝桃苷。金丝桃苷提取物通过60%乙醇溶液回流提取105min制得;Kromasil C18柱(4.6mm×250mm,5μm)、柱温30℃,流动相甲醇(A)-0.5%磷酸溶液(B),梯度洗脱;检测波长355nm,流速1mL/min。结果:金丝桃苷在0.17~2.55mg范围内峰面积与进样量具有良好的线性关系,回归方程Y=2×106X+1.94883×106(r=0.9990,n=6)。平均回收率100.31%,RSD为0.95%(n=9)。结论:本法简便、准确、重复性好,可用于五加菜质量的控制方法研究。四川阿坝藏族羌族自治州、四川甘孜藏族自治州的五加属植物中金丝桃苷含量:老叶远低于嫩叶;糙叶藤五加嫩叶(低温烘干品)≈蜀五加嫩叶(低温烘干品)>红毛五加嫩叶(低温烘干品)>无梗五加嫩叶(低温烘干品);糙叶藤五加的不同加工工艺:阴干>茶叶>烘干>热烫≈微波干燥≈晒干>>盐渍>冻藏1个月≈热烫后冻藏1个月。
藏羌五加菜;金丝桃苷;反相高效液相色谱;液相色谱-质谱;含量
在四川藏、羌族地区民间广泛食用一类在当地称为五加菜的嫩叶,认为具有驱风除湿、强壮筋骨的作用。当地藏、羌族牧民一般将其直接炒食或煮汤或热烫后凉拌食用或热烫后家用冰箱冷冻保藏一年慢慢食用等。经鉴定该类嫩叶为五加科五加属植物红毛五加Acanthopanax giraldii Harms、糙叶藤五加A. leucorrhigus var. fulvescens Harms & Rehd和蜀五加A. setchuenensis Harms ex Diels等同属植物的嫩叶,三者均有作为五加皮类药材的文献记载;红毛五加A. giraldii Harms主要分布于四川、甘肃、青海、宁夏等省;糙叶藤五加分布在湖南、广东、广西、四川等以茎皮或根入药;蜀五加主要分布在四川和陕西等地,以茎皮入药[1]。原主产于黑龙江省山区,现主产于东北的刺五加嫩叶开发成刺五加茶,并申请了相关的专利[2-4],而四川藏、羌族地区五加属植物的茶叶和相关食品研究和专利申请仍是空白,是极具开发价值和前景的新药食同源植物,因此对四川产的藏羌五加菜的系统研究与开发利用具有较大的经济价值和学术价值。金丝桃苷(hyperoside)是黄酮醇苷类化合物,结构为槲皮素-3-半乳糖苷[5],又名田基黄苷、海棠因,现代药理研究[6-10]表明具有局部镇痛、抗乙肝病毒、抗氧化作用,对肝脏、心肌、脑缺血损伤和脑梗塞等均有保护作用,对神经系统、循环系统、消化系统、免疫系统等具有调节活性,临床上主要用于治疗抗菌、抗炎、止咳、平喘、祛痰、心脑血管疾病等,近年来,将金丝桃苷开发用于治疗抑郁、乙肝等疾病已成为国内外研究热点[11-12]。课题组前期对四川产红毛五加进行了比较系统的相关研究[13-15]。
本实验拟先采用液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)联用技术对红毛五加、蜀五加和糙叶藤五加中的金丝桃苷进行定性鉴别;进而采用反相高效液相色谱(reverse phase-high performance liquid chromatography,RP-HPLC)测定并比较红毛五加、蜀五加和糙叶藤五加的老叶、嫩叶及不同种嫩叶的不同加工工艺中金丝桃苷的含量,以期为藏羌五加菜新资源食品和功能食品开发、金丝桃苷的新来源和资源综合利用提供参考。
1 材料与方法
1.1 材料
无梗五加嫩叶由宽甸天奥短梗五加种植基地提供,是目前有市售的五加属植物嫩叶,刺五加老叶自采于湖北省,其余样品采自于四川阿坝藏族羌族自治州、四川甘孜藏族自治州,经刘圆教授鉴定,具体来源信息见表1。各样品均根据嫩叶的采摘方法,一般在10时左右。选择形态整齐美观、无斑点、无害虫、有光泽的叶片进行采摘。
1.2 试剂与仪器
金丝桃苷 中国食品药品检定研究院;乙醇为色谱纯,其余试剂均为分析纯。
W2695 Separations Module高效液相色谱(W2996二极管阵列检测器;Empower色谱工作站) 美国Waters公司;LCQ型质谱仪 美国Finigan;Milli-Q超纯水系统仪;AE240电子分析天平 梅特勒-托利仪器(上海)有限公司。
1.3 方法
1.3.1 加工工艺
烘干:将采摘的藏五加菜叶于40℃电热鼓风干燥箱中干燥48h,定期翻动。
晒干:将采摘的藏五加菜置于日光白天温度18~32℃下晒干,晒干处理持续2d,定期翻动。
阴干:将采摘的藏五加菜放在阴凉通风处干燥1个月,定期翻动。
微波干燥:将采摘的藏五加菜放于家用微波炉(功率为900W)蔬菜键下中干燥7~15min。
热烫或热烫后冷藏:将采摘的藏五加菜置入沸水中,热烫2~5min;晾凉后放入-18℃的冰箱中储藏。
腌渍:采用干腌法。腌制前将藏五加菜晾半干。取一定量食盐均匀撒在五加菜上,拌匀,使菜体中部分汁液外渗,挤出汁液。入缸时采用放一层菜加一层干盐的方式,先在缸底铺一层底盐,再在盐层上放一层蔬菜,压紧,然后再撒一层盐,再铺一层菜,把菜体压紧。如此反复,将菜腌至缸口,最后在菜体上面撒一层食盐,再压上重物,挤出渗出的汁液。腌制中要注意掌握,上层用盐量比下层多一些。当食盐吸收菜体中的水分而溶化后,盐水下淋,使盐分均匀地渗入到原料中去。一般加盐量应为10%左右。

表1 5种五加属植物来源(n=3)Table 1 Details of 5 Acanthopanax species tested in the present study
制茶叶:挑选出更嫩的藏五加菜嫩叶,去掉较老的叶柄。摊凉与萎凋:将采摘的五加新叶摊放开,定期轻翻动2~3次,当顶叶下垂并失去光泽、水分减少10%左右、手捏有弹性时即可。高温杀青:杀青温度为200~220℃,杀青时间为5~8min。揉捻:将杀青后的五加嫩叶采用轻、重、轻的原则,揉捻5~6min,使叶片卷成条索,破碎叶细胞挤出汁,粘附于叶表面,易于冲泡。烘干:将形成球形的藏五加叶茶用不锈钢筛网盘装好,厚度为2cm左右,置入烘干箱中烘干,温度设定为60~70℃,时间4~5h。取出即得。
冻藏:将采摘的藏五加菜嫩叶直接放入-18℃冰箱中储藏。
1.3.2 溶液的配制
对照品溶液的制备:精密称取金丝桃苷对照品适量,加乙醇配制成0.17mg/mL溶液。
供试品溶液制备:精密称定药粉(过40目筛)0.5g,置圆底烧瓶中,加入50mL 60%乙醇溶液,回流105min,取出,放冷,过滤,取续滤液,定容至50mL,用微孔滤膜(0.45μm)滤过,即得。
1.3.3 仪器条件
质谱条件为电喷雾电离源(electrospray ionization source,ESI),鞘气为N2,流速为30L/min;辅助气为N2,流速为5L/min;雾化电压3.5kV;毛细管电压9.66V;毛细管温度300℃;离子极性为负离子。Krosmasil C18色谱柱(4.6mm×250mm,5μm),柱温30℃。流动相为乙醇(A)-0.5%磷酸水溶液(B),梯度洗脱,程序为:基线(A:B=30:70)、0~4min(A:B=35:65)、5~18min(A: B=40:60)、19~30min(A:B=50:50);检测波长355nm,流速1mL/min。
2 结果与分析
2.1 金丝桃苷质谱分析
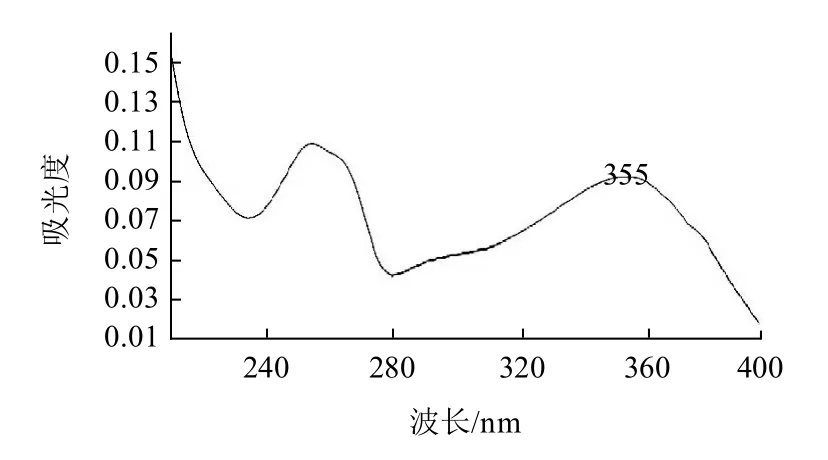
图1 金丝桃苷紫外吸收谱图Fig.1 Ultraviolet absorption spectrum of hyperoside

图2 金丝桃苷质谱图Fig.2 Mass spectrum of hyperoside

图3 金丝桃苷对照品(A)和糙叶藤五加嫩叶低温烘干品(B)色谱图Fig.3 Mass spectra of hyperoside reference substance (A) and hyperoside extracted from low-temperature dried tender leaves of A. leucorrhizus (Oliv.) Harms var. fulvescens Harms & Rehd (B)
金丝桃苷紫外吸收见图1、质谱图见图2,金丝桃苷的[M-H]-为m/z 462.95。对照品及样品溶液的色谱图见图3。
2.2 提取方法优化
2.2.1 提取溶剂的选择
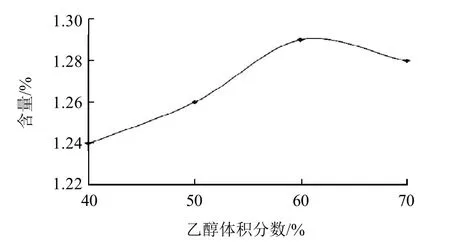
图4 不同乙醇体积分数对提取糙叶藤五加嫩叶(烘干品)金丝桃苷含量的影响Fig.4 Effect of ethanol concentration on determination of hyperoside content in low-temperature dried tender leaves of A. leucorrhigus var. fulvescens Harms & Rehd
分别精密称取糙叶藤五加烘干品粉末(40目)0.5g,分别用40%、50%、60%、70%乙醇溶液50mL作提取溶剂,回流2h,最后定容至50mL,用微孔滤膜(0.45μm)滤过,即得。考察结果见图4,表明当乙醇体积分数为60%时,样品金丝桃苷提取率最大,故本实验选择60%的乙醇溶液作为提取溶剂。
2.2.2 提取时间的选择
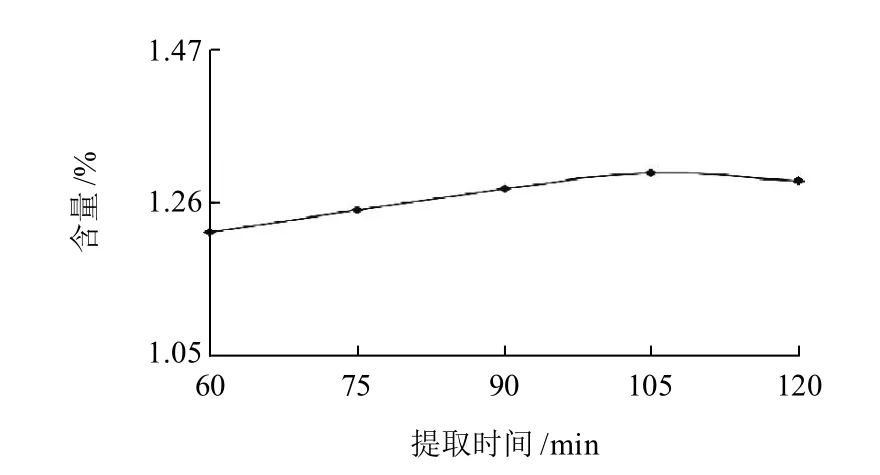
图5 不同提取时间对提取糙叶藤五加烘干品金丝桃苷含量的影响Fig.5 Effect of extraction time on determination of hyperoside content in hyperoside in low-temperature dried tender leaves of A. leucorrhigus var. fulvescens Harms & Rehd
分别精密称取糙叶藤五加烘干品粉末(40目)约0.5g,加入60%乙醇溶液50mL,分别回流60、75、90、105、120min,最后定容至50mL,用微孔滤膜(0.45μm)滤过,即得。考察结果见图5,表明当回流105min时,样品金丝桃苷提取率最大,故本实验选择提取时间为105min。
2.3 方法学考察
2.3.1 线性关系
按1.3.3节色谱条件,分别精密量取金丝桃苷对照品溶液1、2、4、6、10、15μL,注入液相色谱仪,测定峰面积。以进样量/μg为横坐标,峰面积为纵坐标绘制标准曲线,回归方程为Y=2×106X -1.94883×106,R2=0.9990。金丝桃苷线性范围为0.17~2.55mg。
2.3.2 精密度实验
精密吸取对照品溶液10μL(n=6),测得峰面积的RSD为0.99%,结果表明仪器精密度良好。
2.3.3 稳定性实验
精密量取样品溶液10μL,分别于0、2、4、6、8、10h按1.3.3节色谱条件测定。按照金丝桃苷峰面积计算RSD为1.01%(n=6)。结果表明样品溶液在配制后10h内稳定。
2.3.4 重现性实验
取糙叶藤五加嫩叶低温烘干品6份,按1.3.2节方法制备样品溶液,按1.3.3节色谱条件测定。结果样品中金丝桃苷的含量平均值为1.30%,RSD为1.12%(n=6),表明该分析方法重现性良好。
2.3.5 加样回收率实验
精密称取已测定的样品9份,每份1g,依次加入低、中、高3种质量浓度金丝桃苷对照品溶液,按1.3.2节方法制备样品溶液,按1.3.3节色谱条件测定。结果平均回收率为100.31%,RSD为0.95%(n=9)。
2.4 样品测定
按1.3.2节方法制备样品溶液,按1.3.3节色谱条件测定,每次进样10μL,测定结果见表2。
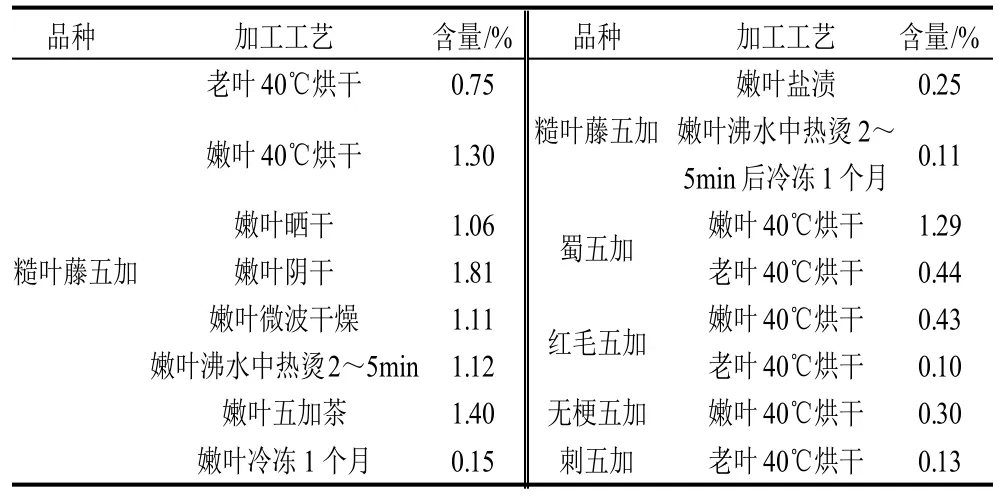
表2 各样品的金丝桃苷含量Table 2 Hyperoside contents in different samples
3 结论与讨论
3.1 根据本课题组前期的研究[16],金丝桃苷提取工艺为石油醚回流,再用一定体积分数的乙醇回流提取的方法;本实验对所有嫩叶样品进行了相同的提取工艺对比,发现石油醚回流对嫩叶中金丝桃苷含量影响不大,因此考察用不同乙醇体积分数的溶液进行、不同提取方法和不同的回流时间来提取样品中金丝桃苷的含量,结果表明60%乙醇溶液回流提取105min对金丝桃苷的提取最完全。
3.2 实验结果表明:五加属的老叶含量甚低,与课题组前期发表的文献[16]结果一致,而嫩叶中的含量很高。糙叶藤五加嫩叶(低温烘干品)≈蜀五加嫩叶(低温烘干品)>>红毛五加嫩叶(低温烘干品)>无梗五加嫩叶(低温烘干品),提示四川阿坝藏族羌族自治州、四川甘孜藏族自治州实地考察发现的“五加菜”(尤其是糙叶藤五加)可以作为金丝桃苷的新来源,具有很好的开发前景。
3.3 不同加工方法对糙叶藤五加的金丝桃苷的含量的影响,从本次实验结果表明:阴干>茶叶>烘干>热烫≈微波干燥≈晒干>盐渍>冻藏1个月;茶叶的金丝桃苷含量较高,但是川产五加属类植物的茶类产品仍然是空白,因此具有很大的市场开发价值。
3.4 不同加工方法的探讨
3.4.1 当地藏、羌族牧民一般将其直接炒食或煮汤或热烫后凉拌食用或家用冰箱冷冻保藏一年食用。本实验结果表明:热烫后的藏羌五加菜金丝桃苷含量较高,提示该传统食用方法具有科学性;藏羌五加茶叶金丝桃苷含量也较高,提示值得进一步开发;家用冰箱冷冻保藏一年慢慢食用,本实验结果表明:藏羌五加菜直接冻藏1个月之后,其金丝桃苷含量很低;热烫之后再采用家用冰箱冷冻储贮含量更低,可能因为冷冻温度加速了金丝桃苷的降解,因此从金丝桃苷含量的变化来看提示该食用方法不一定科学,但是藏羌五加菜中除含有金丝桃苷外还含有其他多种生物活性成分,因此具体结论还有待课题组的进一步系统综合评价。
3.4.2 烘干、晒干、阴干均为食材干燥比较传统的干燥方法,晒干和阴干受天气影响较大,阴干虽然时间长,但是对保存“五加菜”中的金丝桃苷效果很好;微波干燥方法简便、快捷,但会一定程度上降低五加菜的金丝桃苷含量。目前国内对金丝桃苷在植物体内的代谢研究较少,本工艺再次提示金丝桃苷在植物体内的代谢有可能与温度有关,过高或者过低的温度都影响了金丝桃苷的含量。
3.4.3 按照传统的盐渍工艺加工结果表明:金丝桃苷含量很低,提示一定程度上盐渍工艺破坏了藏羌五加菜的金丝桃苷活性成分,但是有待课题组进一步的系统综合评价。
[1] 楼之岑, 秦波. 常用中药材品种整理和质量研究[M]. 北京: 北京医科大学, 北京大学医学出版社, 1995: 672-675.
[2] 张育松, 刺五加及刺五加茶的保健功效与加工工艺[J]. 亚热带农业研究, 2009, 5(1): 56-59.
[3] 刘玉平. 刺五加茶: 中国, A23F3/34; A61K35/78; A61P37/02[P]. 2001-10-24.
[4] 谢德圣, 谢春阳. 名贵山珍: 刺嫩芽罐头的研制[J]. 特产研究, 1990 (3): 26-27; 50.
[5] 蒋忠良, 朱胄远, 伍越环, 等. 金丝桃甙的合成研究[J]. 药学学报, 1994, 29(11): 874-876.
[6] 李庆林, 桂新, 陈志武, 等. 金丝桃苷对大鼠心肌缺血再灌注损伤的保护作用[J]. 中国药学杂志, 2002, 37(11): 829-832.
[7] 彭国平, 魏尔清, 葛求富, 等. 金丝桃苷对离体缺氧/缺糖再灌注脑损伤的保护作用[J]. 中国药学杂志, 2005, 4(6): 434-437.
[8] YANG Yin. Studies on the effect of Hypercium Chinese on anti1ipidperoxidaton[J]. Acta Univ Med, 2001, 6(3): 211-215.
[9] MAREK O B, LYDIA I, HOLKOV A, et al. Anti1ipoxygenase activity of compounds from Hypericum perforatum[J]. Section Celluar Molecular Biology, 2006, 61(3): 331-332.
[10] WU Linlin, YANG Xinbo, HUANG Zhengming, et al. In vivo and in vitro antiviral activity of hypezoside extrated from Abelmoschus manihot (L.) medik[J]. Acta Pharmacol Sin, 2007, 28(1): 404-409.
[11] 袁丽春, 刘斌, 石任兵. HPLC法测定不同市售荷叶材料中金丝桃苷和异槲皮苷的含量[J]. 药物分析杂志, 2010, 30(1): 41-44.
[12] 冯颖, 孟宪军, 王建国. 无梗五加果金丝桃昔的分离制备和鉴定[J].食品科学, 2007, 28(5): 285-300.
[13] 刘圆, 孟庆艳, 彭镰心, 等. 共有峰率和变异峰率双指标序列法分析藏药材红毛五加特定(指纹)图谱[J]. 药物分析杂志, 2007, 27(8): 1182-1185.
[14] 刘圆, 孟庆艳, 任朝琴. RP-HPLC法测定川产藏药不同产地红毛五加茎皮中腺苷的含量[J]. 药物分析杂志, 2007, 27(10): 1586-1588.
[15] 刘圆, 孟庆艳, 彭镰心, 等. 川产藏药材不同产地红毛五加多糖的比较[J]. 中草药, 2007, 38(2): 283-284.
[16] 李莹, 袁玮, 刘超, 等. 反相高效液相色谱法测定藏药材红毛五加中金丝桃苷的含量[J]. 时珍国医国药, 2009, 20(7): 1617-1619.
Determination of Hyperoside in Tibetan Acanthopanax Leaves from Five Species by RP-HPLC
LI Yan-dan,HUANG Yan-fei,DING Ling,ZUO Xu,LIU Yuan*
(Institute of Ethnic Medicine, Southwest University for Nationalities, Chengdu 610041, China)
Objective: To establish a reversed-phase high-performance liquid chromatography (RP-HPLC) method for the determination of hyperoside in Tibetan Acanthopanax leaves from 5 different species. Methods: Hyperoside was identified by liquid chromatography-mass spectrometry (LC-MS). Hyperoside in samples were extracted by refluxing with 60% ethanol for 105 min. The chromatographic separation was achieved on a Kromasil C18 column at 30 ℃ through gradient elution using methanol as mobile phase A and 0.5% phosphoric acid at a flow rate of 1 mL/min. The detection wavelength was set at 355 nm. Results: A calibration curve equation describing the relationship between hyperoside concentration (Y) and peak area (X) was established as follows: Y=2 × 106X + 1.94883 (r=0.990, n=6). The calibration curve was linear over the concentration range of 0.17-2.55. The average spike recovery rate of hyperoside was 100.31% with a RSD of 0.95% (n=9). Conclusion: A simple, accurate and repeatable method to determine hyperoside in Tibetan Acanthopanax leaves has been developed. Tender leaves of Tibetan Acanthopanax from the same species grown in Tibetan and Qiang Autonomous Prefecture and Ganzi Tibetan Autonomous Prefecture, Sichuan Province were found to be much richer in hyperoside than old ones. Low-temperature dried tender leaves of A. leucorrhizus (Oliv.) Harms var. fulvescens Harms & Rehd and A. setchuenensis Harms ex Diels had approximately equal hyperoside levels followed by tender leaves of A. giraldii Harms; tender leaves of A. sessiliforus Rupr had the lowest hyperoside level. Different drying methods were ranked in descending order from the highest to the lowest hyperoside content in dried A. leucorrhizus (Oliv.) Harms var. fulvescens Harms & Rehd as follows: shade drying > processing into tea > oven drying > blanching ≈ microwave drying ≈ sun drying >> salting >1-month frozen storage ≈ 1-month frozen storage after blanching.
Tibetan Acanthopanax;hyperoside;RP-HPLC;LC-MS;content
R284.2
A
1002-6630(2012)16-0106-05
2012-01-16
“十二五”国家科技支撑计划重点项目(2012BAI27B07);四川省科技支撑计划项目(2011SZ0233);四川省中医药管理局科技专项(2008-32)
李艳丹(1989—),女,硕士研究生,研究方向为民族药物。E-mail:beanbean-li@hotmail.com
*通信作者:刘圆(1968—),女,教授,博士,研究方向为民族药物。E-mail:yuanliu163@yahoo.com.cn

