应温度和时间对抗坏血酸/精氨酸MAILLARD反应体系中挥发性化合物形成的影响
谭志伟,余爱农
(湖北民族学院化学与环境工程学院,湖北恩施 445000)
应温度和时间对抗坏血酸/精氨酸MAILLARD反应体系中挥发性化合物形成的影响
谭志伟,余爱农
(湖北民族学院化学与环境工程学院,湖北恩施 445000)
采用顶空固相微萃取-气相色谱-质谱联用技术对抗坏血酸/精氨酸反应体系在不同反应温度和时间下的产物进行鉴定,共鉴定出包括吡嗪、醛、呋喃、醇和吲哚在内的24种化合物,其中14种吡嗪化合物为主要香味化合物。考察了反应温度和时间对产物特别是对吡嗪化合物的影响。结果表明,随着反应温度的升高和反应时间的延长,吡嗪类化合物的总量均增加;其中,随反应温度的升高,相对其他吡嗪化合物2-乙基-6-甲基吡嗪、3-乙基-2,5-二甲基吡嗪的量明显增加;随反应时间的延长,2-乙基-6-甲基吡嗪的量明显增加。
Maillard反应,抗坏血酸/精氨酸,反应温度,反应时间,吡嗪化合物
Maillard反应是一类重要的非酶褐变反应,在食品的烹煮、焙烤和烘烤等加工过程中产生色素和特征香气,赋予食品以色、香和特定的风味,但在食品的贮运过程发生此类反应,会加速食品的变质,因而,一直是食品加工与贮运、食品化学和香料化学等领域的研究热点。抗坏血酸本身在水果、蔬菜及动物肝脏等许多食品中广泛存在,且常作为食品添加剂如抗氧化剂添加到食品中,因此继还原糖之后,基于抗坏血酸/氨基酸Maillard反应体系的研究越来越多[1-14],但对该反应产物中香味化合物的报道却较少,MíkováK.等[1]在抗坏血酸与氨的反应中发现5种咪唑衍生物,并鉴定出其中3种的结构。Davidek等[2]将L-脱氢抗坏血酸分别与氨和甘氨酸反应,共分离鉴定出甲基吡嗪等五种吡嗪化合物。Seck等[3]从抗坏血酸与苯丙氨酸反应中分离鉴定出丙基苯、糠醛等9种化合物。Rogacheva等[10]报道了抗坏血酸分别与赖氨酸、甘氨酸和谷氨酸反应,分离鉴定了11个、10个和7个挥发性化合物,并考察了反应时间对挥发性产物的影响。Adams A.等[14]研究了抗坏血酸与20种氨基酸在K2CO3存在条件下烘焙产生的吡嗪类化合物,其中抗坏血酸与精氨酸反应体系共鉴定出12种烷基吡嗪。最近,我们课题组报道了在不同pH条件下抗坏血酸与苏氨酸、丝氨酸、丙氨酸和半胱氨酸反应体系中香味化合物的形成[15-17]。影响Maillard反应的因素有pH、反应温度、反应时间、压力和反应物比例等,研究发现pH主要影响反应生成香味物质的本性而最终影响产品的香味[15-17]。加热温度和时间是食品的热处理过程中影响产品颜色和香味的两个重要加工工艺参数。Jousse等[18]认为反应温度和时间主要影响Maillard反应的动力学,而对挥发性产物的本性影响较小。Ellis[19]认为高温对Maillard反应有利。到目前为止,没有发现反应温度和时间对抗坏血酸与精氨酸反应体系中挥发性产物,特别是吡嗪类化合物影响的报道。Maillard反应生成的吡嗪化合物通常具有坚果和烤香等特征香气,是许多蒸煮、煎烤类食物中如煮熟的大马哈鱼[20]、烤咖啡[21]和炒麦芽[22]等的主要香气成分。鉴于此,本文基于抗坏血酸与精氨酸反应体系,以顶空固相微萃取-气相色谱-质谱联用(HS-SPME-GCMS)技术为研究手段,研究了反应温度和时间对模式反应形成香味化合物,特别是吡嗪类化合物的影响,并对吡嗪类化合物的形成机理进行合理的推测,为抗坏血酸与氨基酸反应体系中吡嗪类化合物的形成机理和动力学研究奠定基础,并为含有抗坏血酸的食品的热加工工艺的研究提供指导。
1 材料与方法
1.1 材料与仪器
抗坏血酸 上海国药集团化学试剂有限公司,分析纯;精氨酸 分析纯,上海源聚生物科技有限公司;Na2HPO4、NaH2PO4、NaOH 均为分析纯;C5~C22正构烷烃标准物 购自Pure Chem ical Analysis有限公司;实验用水 皆为二次蒸馏水。
毛细管色谱柱 DB-5MS(30m×0.25mm× 0.25μm),气相色谱-质谱联用仪[GC(6890N)-MS (5975I)] 美国Agilent科技有限公司;固相微萃取萃取头DVB/CAR/PDMS(50/30μm thickness),固相微萃取手动进样器 美国Supelco公司;P160004厚壁耐压反应瓶 北京欣维尔玻璃仪器有限公司;精密电子天平 瑞士Startorius公司;PHSJ-4A型实验室pH计 上海金鹏分析仪器有限公司;MSC-400型磁力加热搅拌器 德国W iggen hauser公司。
1.2 实验方法
1.2.1 样品的制备 准确称取0.7045g(4.0mmol)抗坏血酸溶于 40m L 0.20mol·L-1的 Na2HPO4-NaH2PO4缓冲溶液(pH 8),用NaOH将溶液的pH调至8.00,然后加入0.6968g(4.0mmol)精氨酸,搅拌,使其完全溶解,用100m L P160004厚壁耐压反应瓶密封,在不同温度[(80±2),(100±2),(120±2),(140±2),(160±2)℃]油浴中搅拌加热,反应120min后用冷水快速冷却至室温,调节反应液的pH至7.00,在冰箱中保存冷藏以待HS-SPME-GC-MS分析,以考察反应温度对反应体系中香气成分的影响。制备同样的反应液,在(140±2)℃下反应不同时间(30、60、90、120、150、180min),以考察反应时间对反应体系中香气成分的影响。每个样品平行制备2份。
1.2.2 HS-SPME-GC-MS分析 取7m L反应液置于15m L专用萃取瓶中,在40℃下平衡15min后,插入固相微萃取头 DVB/CAR/PDMS(50/30μm thickness),在40℃下顶空萃取40m in,随即采用GCMS联用技术进行分析,挥发物用DB-5MS毛细管色谱柱分离。固相微萃取头插入气相色谱进样口在250℃下解析4.0m in;采用分流进样,分流比为1∶30。柱室温度采用程序升温:40℃下保温 5m in,再以5℃·m in-1升温至260℃,然后以15℃·m in-1升温至280℃,保温1m in。GC-MS接口温度为280℃;质谱EI:70eV;电子倍增电压:1753V;质量扫描范围: 30~400amu;扫描速率:1scan·s-1。C5~C22正构烷烃在相同条件下分析,以计算待测化合物的线性保留指数(LRI)。分析检测出来的化合物经计算机检索与标准谱图库NIST08谱库和W iley275谱库相匹配,对正反匹配度均大于800(最大值为1000)的化合物计算LRI并与文献中(http://webbook.nist.gov/ chemistry/name-ser.htm L)报道的LRI进行比较,进一步辅助定性。被分离鉴定化合物的总离子流峰峰面积(GC-TIC Peak areas)采用Agilent GC-MS工作站在设定积分阈值为16.5时积分获得。每个样品平行分析2次,实验结果以平均值±标准偏差表示。
2 结果与讨论
图1为抗坏血酸/精氨酸反应体系在pH 8、(140 ±2)℃下反应150m in所产生挥发性产物的总离子流图,该反应体系在pH 8、不同反应温度[(80±2),(100±2),(120±2),(140±2),(160±2)℃]时反应120m in所得挥发性产物的分离鉴定结果如表1所示,在pH 8、反应温度为(140±2)℃时反应不同时间(30、60、90、120、150、180m in)所得挥发性产物的分离鉴定结果如表2所示,化合物的编号与其流出顺序一致。共分离鉴定出24种化合物,其中包括14种吡嗪类化合物、3种醛类化合物、3种呋喃、3种醇和1种吲哚类化合物,吡嗪类化合物是该反应体系中产生的主要香味化合物。

图1 抗坏血酸/精氨酸反应体系在pH 8和(140±2)℃下反应150min生成的挥发性成分的总离子流图Fig.1 Total ion chromatograms of volatiles generated from model system containing ascorbic acid with arginine at pH 8 and(140±2)℃ for 150min
2.1 反应温度对吡嗪化合物形成的影响
如表1所示,抗坏血酸/精氨酸反应体系在80℃和100℃下反应120m in时,产物中只有乙醛(1),呋喃(2),2-甲基呋喃(3),2-乙基-1-己醇(13),二丁基羟基甲苯(23),2,4-二叔丁基苯酚(24)共6种挥发性产物。反应温度达到120℃时,产物中有壬醛(19)、癸醛(22)两种醛类化合物、2,3-二氢-1H-吲哚(20)检出,同时检出吡嗪(4)、2-甲基吡嗪(5)、2,5-二甲基吡嗪(6)、2-乙基吡嗪(7)、2-乙基-5-甲基吡嗪(11)和2-乙烯基-6-甲基吡嗪(12)六种吡嗪化合物。反应温度达到140℃时,共分离鉴定出24种挥发性产物,反应温度达到160℃时,挥发性产物的种类并没有增加。反应温度达到140℃之前,随温度的升高,反应产物的种类增加,其可能原因为:在该反应体系中,生成各种产物的反应的活化能不同,活化能高的反应需要达到一定反应温度才能发生。当反应温度达到一定程度后,反应温度主要影响Maillard反应的动力学,而对挥发性产物的本性影响较小,与前述Jousse等[18]的结论是一致的。
如图2a所示,随着反应温度的升高,产物中总吡嗪的量随之增加,总吡嗪GC-TIC峰面积从120℃时的66.7×106增加到160℃时的606.3×106。结果表明,该反应体系,较高的反应温度有利于吡嗪类香味化合物的形成。如图2b所示,随反应温度升高,产物中吡嗪(4)、2-甲基吡嗪(5)、2,5-二甲基吡嗪(6)、2-乙基吡嗪(7)、2-乙基-6-甲基吡嗪(10)、2-乙基-5-甲基吡嗪(11)、3-乙基-2,5-二甲基吡嗪(14)和2,6-二乙基吡嗪(15)八种吡嗪化合物的量增加较快。其中,2-乙基-6-甲基吡嗪(10)、3-乙基-2,5-二甲基吡嗪(14)在120℃时还没有检出,反应温度由140℃升高到160℃时,其GC-TIC峰面积分别从49.5×106、5.6×106增加到149.0×106、61.5 ×106,增加最为明显;其次是2,5-二甲基吡嗪(6)和2-乙基-5-甲基吡嗪(11),反应温度从120℃升高到160℃时,GC-TIC峰面积分别从9.6×106、1.6×106增加到77.7×106、63.2×106;另外,值得注意的是2-甲基吡嗪(5),反应温度从120℃升高到160℃时,其GC-TIC峰面积从39.9×106增加到98.3×106,虽然随反应温度的升高增加不是特别明显,但在120℃被检出时的量较高。结果表明,对该反应体系,主要吡嗪类产物为2-乙基-6-甲基吡嗪(10)、3-乙基-2,5-二甲基吡嗪(14)、2,5-二甲基吡嗪(6)、2-乙基-5-甲基吡嗪(11)和2-甲基吡嗪(5),升高反应温度,更有利于这五种吡嗪化合物的生成。另外,2-甲基吡嗪(5)的量较多但随温度影响不大的可能原因是2-甲基-3,6-二氢吡嗪与氧气发生氧化反应的活化能相对较小。

图2 反应温度对吡嗪产量的影响Fig.2 The effect of reaction temperature to the formation of pyrazines
2.2 反应时间对吡嗪化合物形成的影响
如表2所示,反应30m in时,产物中2-乙烯基吡嗪(8)、2-乙基-6-甲基吡嗪(10)、2-乙烯基-6-甲基吡嗪(12)、3-乙基-2,5-二甲基吡嗪(14)、2,6-二乙基吡嗪(15)、2-乙基-3,5-二甲基吡嗪(16)、5-乙基-2,3-二甲基吡嗪(17)、2-烯丙基-5-甲基吡嗪(18)和3,5-二乙基-2-甲基吡嗪(21)共九种吡嗪类化合物和2,3-二氢苯并呋喃(9)没有检出,反应60m in时,2,6-二乙基吡嗪(15)、2-乙基-3,5-二甲基吡嗪(16)、5-乙基-2,3-二甲基吡嗪(17)、2-烯丙基-5-甲基吡嗪(18)和3,5-二乙基-2-甲基吡嗪(21)共五种吡嗪类化合物没有检出,反应90min时,只有2-乙基-3,5-二甲基吡嗪(16)和5-乙基-2,3-二甲基吡嗪(17)两种化合物没有检出,反应到120m in后所有24种挥发性化合物均有检出。在较短反应时间内,一些产物没有检出与在该反应体系中生成这些产物的反应速率有关。
如图3a所示,随反应时间的延长,产物中总吡嗪的量随之呈线性增加,总吡嗪GC-TIC峰面积从30m in时的34.9×106增加到180m in时的477.6× 106。结果表明,该反应体系,延长反应时间对吡嗪类香味化合物的形成有利。如图3b所示,随反应时间的延长,产物中2-甲基吡嗪(5)、2,5-二甲基吡嗪(6)、2-乙基吡嗪(7)、2-乙基-6-甲基吡嗪(10)、2-乙基-5-甲基吡嗪(11)、2-乙烯基-6-甲基吡嗪(12)和2,6-二乙基吡嗪(15)七种吡嗪类化合物的量有较明显的增加。其中,2-乙基-6-甲基吡嗪(10)的GC-TIC峰面积从60m in的13.7×106增加到180m in的157.3×106,增加最为明显;其次是2-甲基吡嗪(5)、2,5-二甲基吡嗪(6)、2-乙基吡嗪(7),其GC-TIC峰面积分别从30m in的22.7×106、5.8×106和3.1×106增加到180m in的81.6×106、75.1×106和53.1×106。由此表明,对该反应体系,反应时间的延长有利于2-乙基-6-甲基吡嗪(10)、2-甲基吡嗪(5)、2,5-二甲基吡嗪(6)、2-乙基吡嗪(7)四种吡嗪化合物的生成。吡嗪类化合物的产量随反应时间的变化可能与吡嗪类化合物的形成机理、反应速率有关,随反应时间的延长其产量明显增加的吡嗪类化合物的生成速率较低,如2-乙基-6-甲基吡嗪(10)。
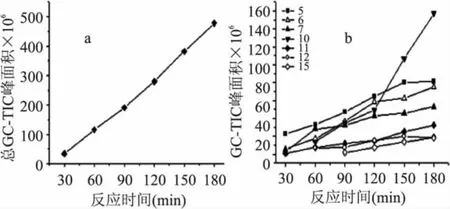
图3 反应时间对吡嗪产量的影响Fig.3 The effect of reaction time to the formation of pyrazines
2.3 吡嗪类化合物形成的可能路径
文献[23]报道了在食品热加工过程中吡嗪类化合物有多种可能的形成路径,一般认为在抗坏血酸/氨基酸反应体系中吡嗪类化合物按以下途径形成:抗坏血酸热降解产生乙二醛、丙酮醛和丁二酮等二羰基化合物[24],生成的二羰基化合物与氨基酸发生Strecker降解反应产生α-氨基乙醛、α-氨基丙酮和α-氨基丁二酮(如图4a);α-氨基乙醛自缩合反应产生3,6-二氢吡嗪,3,6-二氢吡嗪被氧气氧化生成吡嗪[25],与乙醛反应生成乙基吡嗪[26](如图4b);α-氨基丙酮自缩合反应生成的2,5-二甲基-3,6-二氢吡嗪[27]与氧气和乙醛反应分别生成2,5-二甲基吡嗪和3-乙基-2,5-二甲基吡嗪(如图4c);α-氨基乙醛和α-氨基丙酮缩合反应生成2-甲基-3,6-二氢吡嗪,2-甲基-3,6-二氢吡嗪被氧气氧化生成甲基吡嗪,与乙醛反应可以生成2-乙基-3-甲基吡嗪、2-乙基-5-甲基吡嗪和2-乙基-6-甲基吡嗪三种同分异构体(如图4d);α-氨基丙酮和α-氨基丁二酮缩合反应产物2-乙基-5-甲基-3,6-二氢吡嗪被氧气氧化可生成2-乙基-5-甲基吡嗪,与乙醛反应生成2,3-二乙基-5-甲基吡嗪和3,5-二乙基-2-甲基吡嗪(如图4e);反应中的乙醛可来自于精氨酸的Strecker降解反应[23]。结合上述温度对吡嗪类化合物形成的影响分析,反应温度升高,能促使抗坏血酸热降解生成乙二醛和甲基乙二醛,并与精氨酸反应生成氨基乙醛和氨基丙酮。从主要生成的吡嗪类化合物分析,高温能促进氨基乙醛和氨基丙酮的缩合反应以及氨基丙酮的自缩合反应。

表2 抗坏血酸/精氨酸反应体系在pH 8、(140±2)℃下反应不同时间形成的挥发性化合物(GC-TIC峰面积×106)Table 2 Volatiles from the Maillard reaction of ascorbic acid with arginine at pH 8 and(140±2)℃for different reaction time(GC-TIC peak areas×106)
3 结论
本文采用顶空固相微萃取-气相色谱-质谱联用技术对抗坏血酸/精氨酸反应体系在pH 8条件下生成的挥发性化合物进行了分离和鉴定,共鉴定出24种化合物,其中有14种吡嗪类香味化合物,大多为烷基吡嗪,如2-甲基吡嗪(5)、2,5-二甲基吡嗪(6)、2-乙基吡嗪(7)、2-乙基-6-甲基吡嗪(10)、2-乙基-5-甲基吡嗪(11)和3-乙基-2,5-二甲基吡嗪(14)等,进一步探讨了反应温度和反应时间对反应体系挥发性产物中吡嗪类香味化合物的影响,并对该反应体系中吡嗪类化合物形成的可能途径进行了探讨。研究发现,随反应温度的升高及反应时间的延长,总吡嗪的量都显著增加,随反应温度的升高,2-乙基-6-甲基吡嗪(10)、3-乙基-2,5-二甲基吡嗪(14)增加最为明显,随反应时间的延长,2-乙基-6-甲基吡嗪(10)增加最为明显。结果表明,反应温度和反应时间对该反应体系中吡嗪的形成有重要影响。研究结果可对抗坏血酸与氨基酸的Maillard反应体系中吡嗪类化合物形成机理的研究提供参考,对含抗坏血酸食品的热加工工艺的研究具有指导意义。
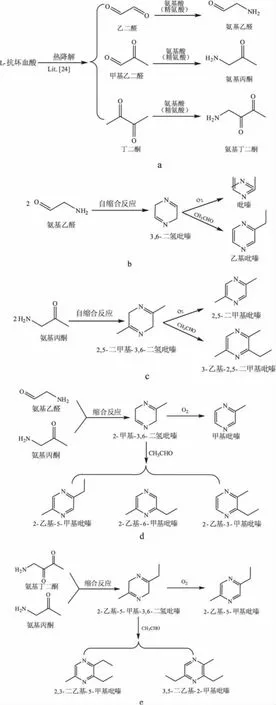
图4 吡嗪类化合物的形成路径Fig.4 Possible formation pathways of pyrazines
[1]MíkováK,Davidek J.Formation of alkylimidazoles in a system containing L-ascorbic acid and ammonia[J].Nahrung,1975,19: 155-161.
[2]Davidek J,Velisek J,Zelinkova Z,et al.Pyrazine in the reaction of L-dehydroascorbic acid with ammonia and glycine[J].JFood Sci,1977,42:277-278.
[3]Seck S,Crouzet J.Formation of volatile compounds in sugarphenylalanine and ascorbic acid-phenyllanine model systems during heat treatment[J].JFood Sci,1981,46:790-793.
[4]Hartmann G J,Scheide JD,Ho C T.Effectofwater activity on the major volatiles produced in a model system approximating cooked meat[J].JFood Sci,1984,49:607-613.
[5]Kennedy J F,Rivera Z S,Warner F P,et al.Analysis of carbohydrates and amino acids in aqueous solutions of L-ascirbic acid and correlation of their role in nonenzymic browning of vitamin C[J].JMicronutr Anal,1989(6):1-17.
[6]Loscher J,Kroh L,Westphal G,et al.L-ascorbic acid-A carbonyl component of nonenzymic browning reactions.Part 2.Amino-carbonyl reactions of L-ascorbic acid[J].Zeitschrift für Lebensm Unters For,1991,192:323-327.
[7]Yin D Z,Brunk U T.Oxidized ascorbic acid and reaction products between ascorbic and amino acidsmight constitute part of age pigments[J].Mech Ageing Dev,1991,61:99-112.
[8]Davies C G A,Wedzicha B L.Ascorbic acid browning:The incorporation of C1 from ascorbic acid intomelanoidins[J].Food Chem,1994,49:165-167.
[9]Rogacheva S,Kuncheva M,Panchev I,et al.L-Ascorbic acid in nonenzymatic reactions.Reaction with glycine[J].Zeitschrift für Lebensm Unters For,1995,200:52-58.
[10]Rogacheva S,Verhe R,Obretenov C.Aroma compounds formation in the interaction of L-ascorbic acid withα-amino acids[M].In Flavour Science:Recent Developments;Taylor A,Mottram D,Eds;The Royal Society of Chemistry:Cambridge,UK,1996:250-253.
[11]Rogacheva S,Kuncheva M,Panchev I,et al.Melanoidin formation in L-ascorbic acid-amino acids interaction.A comparotive study[J].Nahrung,1999,43:105-108.
[12]Obretenov C,Demyttenaere J,Abbaspour T K,et al.Flavor release in the presence ofmelanoidins prepared from L-(+)-ascorbic acid and amino acids[J].JAgric Food Chem,2002,50: 4244-4250.
[13]Fan X,Reneker L W,Obrenovich M E,et al.Vitamin C mediates chemical aging of lens crystallins by the Maillard reaction in a humanized mousemodel[J].PNati Acad Sci USA,2006,103:16912-16917.
[14]Adams A,De Kimpe N.Formation of pyrazines from ascorbic acid and amino acids under dry-roasting conditions[J].Food Chem,2009,115:1417-1423.
[15]Yu A N,Deng Q H.Volatiles from the Maillard reaction of L-ascorbic acid and L-alanine at different pHs[J].Food Sci Biotechnol,2009(18):1495-1499.
[16]Yu A N,Zhang A D.The effect of pH on the formation of aroma compounds produced by heating amodel system containing L-ascorbic acid with L-threonine/L-serine[J].Food Chem,2010,119:214-219.
[17]Yu A N,Zhang A D.Aroma compounds generated from thermal reaction of L-ascorbic acid with L-cysteine[J].Food Chem,2010,121:1060-1065.
[18]Jousse F,Jongen T,Agterof W,et al.Simplified kinetic scheme of flavor formation by the Maillard reaction[J].J Food Sci,2002,67:2534-2542.
[19]Ellis G P.The Maillard reaction.In M.L.Wolfrom(Ed.),Advances in carbohydrate chemistry[M].New York:Academic Press,1959:63-134.
[20]Methven L,Tsoukka M,Oruna-Concha M J,et al.Influence of sulfur amino acids on the volatile and nonvolatile components of cooked salmon(Salmo salar)[J].J Agric Food Chem,2007,55: 1427-1436.
[21]De Oliveira A L,Eberlin M N,Cabral F A.Prediction of the solubility of aromatic compounds from brazilian roasted coffee(2-Methylpyrazine;2-Furfurylalcohol;2,5-Dimethylpyrazine; γ-Butyrolactone and 2-Furfurylacetate)in SC-CO2[J].JChem Eng Jpn,2009,42:219-230.
[22]Channell G A,Yahya H,Cook D J.Thermal volatile generation in barleymalt:On-line MS studies[J].JAm Soc Brew Chem,2010,68:175-182.
[23]Amrani H M,Cerny C,Fay L B.Mechanisms of formation of alkylpyrazines in the Maillard reaction[J].J Agric Food Chem,1995,43:2818-2822.
[24]Vemin G,Chakib S,Rogacheva S,et al.Themal decomposition of ascorbic acid[J].Carbohyd Res,1998,305:1-15.
[25]Abraham F J,Md Abul H S.Formation of pyrazines in hydroxyacetaldehyde and glycine nonenzymatic browning Maillard reaction:A computational study[J].Food Chem,2007,103: 1208-1216.
[26]Shibamoto T,Akiyama T,Sakaguchi M,et al.A study of pyrazine formation[J].JAgric Food Chem,1979,27:1027-1031.
[27]Md Abul H S.Formation of pyrazines in dihydroxyacetone and glycine Maillard reaction:A computational study[J].Food Chem,2006,98:403-415.
Effect of reaction tem perature and time on the formation of volatiles from the Maillard reaction of ascorbic acid w ith arginine
TAN Zhi-wei,YU Ai-nong
(School of Chemistry and Environmental Engineering,Hubei University for Nationalities,Enshi445000,China)
The identification of volatiles formed from the Maillard reac tion of ascorb ic acid w ith arginine at d ifferent reaction temperatures and time were performed by using a headspace solid-phase m icroextraction-gas chromatog raphy-mass spectrom etry(HS-SPME-GC-MS)technique.Twenty-four volatiles were identified as pyrazines,aldehydes,furans,alcohol and indoles,and fourteen pyrazines were the p rimary aroma com pound. Effec ts of reac tion tem perature and time on the form ation of volatiles,especially pyrazines,were investigated.The results showed that,the totalamount of pyrazine com pounds inc reased w ith the reac tion tem perature and reac tion time p rolonged.The formation of 2-ethyl-6-methylpyrazine and 3-ethyl-2,5-d imethylpyrazine inc reased significantly relative to other pyrazines formed from the reaction of ascorbic acid w ith arginine w ith inc reasing tem perature,and the formation of2-ethyl-6-methylpyrazine increased significantly w ith reaction time.
Maillard reac tion;ascorb ic acid/arginine;reac tion tem perature;reaction time;pyrazines
TS201.2+4
A
1002-0306(2012)06-0143-07
2011-06-23
谭志伟(1977-),男,硕士,副教授,主要从事食品化学及食用香料合成方面的研究。
国家自然科学基金项目(20876036);湖北省教育厅自然科学研究项目(B2011901)。

