紫杉醇抗喉癌细胞作用及机制的实验研究
马永恒,袁逸铭
(兰州大学第二医院,甘肃 兰州 730030)
紫杉醇抗喉癌细胞作用及机制的实验研究
马永恒,袁逸铭
(兰州大学第二医院,甘肃 兰州 730030)
目的 研究紫杉醇(Taxol)抗人喉鳞状细胞癌细胞株Hep-2的作用及机制。方法 以不同浓度Taxol作用于体外培养的人喉鳞状细胞癌细胞株Hep-2,用MTT法测定Taxol对细胞的增殖抑制率,分光光度法测定癌细胞膜唾液酸含量、膜磷脂含量及胆固醇含量变化。结果 发现紫杉醇对人喉鳞状细胞癌细胞株Hep-2生长有明显抑制作用,且抑制作用呈浓度依赖性。癌细胞膜分析显示紫杉醇与细胞接触24 h,可显著提高膜磷脂含量,降低细胞膜唾液酸含量,但是对胆固醇含量没有影响。结论 紫杉醇明显抑制人喉鳞状细胞癌细胞株Hep-2增殖,其作用机制可能与膜生化特性改变有关。
紫杉醇;人喉鳞状细胞癌;细胞增殖
紫杉醇(Taxol)是从红豆杉属植物的树皮和针叶中提取分离的生物活性成分。有临床研究显示,其对卵巢癌、黑色素瘤、非小细胞性肺癌和乳腺癌有明显的抑制作用。虽然Taxol用于人喉癌临床治疗已有报道,但是其治疗喉癌的具体机制不是很清楚[1~4]。本文将观察紫杉醇对体外培养的人喉鳞状细胞癌细胞株Hep-2增殖的影响,并从癌细胞膜唾液酸、磷脂及胆固醇含量变化方面对其作用机制进行初步探讨,旨在为其在喉癌的临床应用提供试验依据。
1 材料与方法
1.1 材料
人喉鳞状细胞癌细胞株Hep-2(由中科院细胞所细胞库提供),紫杉醇(由兰州大学化工所化学教研室提供),其他试剂均为(进口或国产)分析纯。
1.2 细胞培养
人喉鳞状细胞癌细胞株Hep-2用含有1%非主要氨基酸、多种维生素、1%谷酰氨、1×10-5U·L~1青霉素、100 mg链霉素、20%灭活小牛血清的四季青公司RPMI1640培养液调配成一定浓度的细胞悬液,在37℃、100%相对湿度、95%空气、5%CO2的培养箱中孵育,进行细胞传代。
1.3 细胞增殖检验[5]
生长良好的细胞以1×104-6·L-1接种于96孔培养板(Falcon,USA),每孔100 μ l,再加入一定浓度的Taxol(5.1、11.1、……),对照组加入生理盐水20 μl后,两组都在条件为37℃、100%相对湿度、95%空气、5%CO2培养箱中孵育24 h,每孔加入5 g·L-1的四甲基唑蓝氮(MTT)10 μ l,继续培养 4 h 进行显色反应,以50%二甲基亚砜(DMSO)100 μl终止反应,再置培养箱中孵育16~18 h后于511型全自动酶标仪570 nm处测吸光度OD值,计算百分抑制率(计算公式:1-实验组平均吸光度T/细胞对照组平均吸光度C)%。
1.4 药物与细胞作用
离心收集体外培养24 h的人喉鳞状细胞癌细胞株Hep-2,用 RPMI1650 培养液调配成 1×104-6·L-1细胞悬液,取 20 μ l接种于100 ml培养瓶,不同的培养瓶中分别加入不同剂量的Taxol,使其终浓度分别为 5.1、11.1、21.4、42.7、85.4 μg·L-1,对照组加入相应体积的生理盐水,两组都在条件为37℃、100%相对湿度、95%空气、5%CO2的培养箱中孵育,每6 h更换一次含药物的培养液,24 h后收集细胞,用Tris-HCL缓冲液(0.01 mol·L-1Tris-HCl,0.1 mmol·L-1EDTA-2Na,10 mmol·L-1蔗糖,0.8%NaCl,pH 7.4)洗涤3次并悬浮,水浴中超声破碎细胞,30 000 g(离心力),4℃离心30 min制备细胞粗膜,用全自动生化分析仪测定蛋白含量(mg·ml-1)。
1.5 膜唾液酸含量测定
称取细胞粗膜用0.9%生理盐水配成10%悬浮液,按文献法[6]在不同试管分别加入500 mg·L-1唾液酸标准溶液或10%细胞膜悬浮液20μl,再加入混合反应液20 ml,置沸水浴中加热25min,以流水冷却终止反应,于585 nm处测定吸收度,按下式计算膜唾液酸含量:膜唾液酸/mg·g-1prot=OD样/OD标×500/蛋白含量。
1.6 膜磷酸含量测定
按文献法[7]进行,选择C1810μ m色谱柱,250mm×4.6 mm不锈钢柱;流动相为超临界CO2和改性剂(体积比为10∶1),其中改性剂为含0.05%(体积分数)三乙胺的乙醇溶液;流动相流速为1.1~1.3ml·min-1;柱温为30~60℃;压力为20~30 mPa;进样体积为10 μl;选择检测波长为214 nm。按下式计算膜磷酸含量:膜磷酸含量/μmol·g-1prot=(1.187×OD-0.004)×1 000/蛋白含量。
1.7 膜胆固醇含量测定
按文献法[8]进行,酶应用液用 0.1 mol·L-1PBS(pH7.76)配制,其中含 TritonX-1 005 ml,胆酸钠 3 mmol·L-1,4-AAP0.5 mmol·L-1,2,4-DCP1.25 mmol·L-1,三合一酶 10 ml。所需量按上述比例增减,冰箱保存可用一周。空白管、标准管及测定管分别加入蒸馏水、2 g·L-1胆固醇的异丙醇标准液或待测样品20 ml,再加入酶应用液3 ml后混匀,37℃保温15 min后用空白管调零,分光光度法510 nm处测吸光度。按下式计算膜胆固醇含量:膜胆固醇/μmol·g-1prot=OD样/OD标×2 000/蛋白含量。
2 结果
2.1 紫杉醇对人喉鳞状细胞癌细胞株Hep-2增殖的影响
紫杉醇与细胞接触24 h对细胞增殖的抑制率见表1。由表1可看出,紫杉醇对人喉鳞状细胞癌细胞株Hep-2的增殖具有显著的抑制作用,其抑制喉鳞状细胞癌细胞株Hep-2增殖的IC50为 21.25 μg·L-1,呈明显的浓度依赖性。
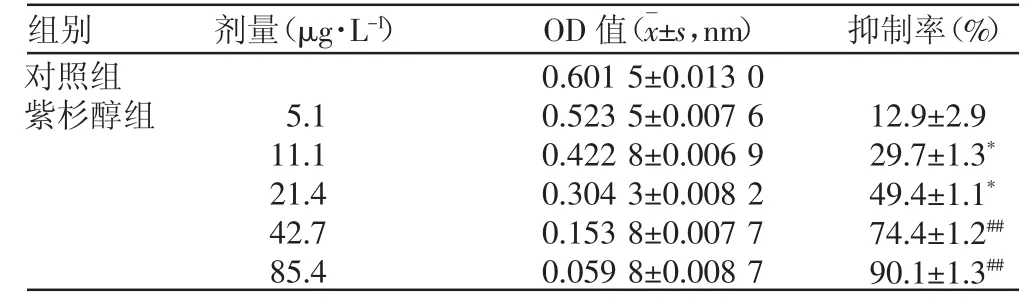
表1 紫杉醇对人喉鳞状细胞癌细胞株Hep-2增殖的抑制率(n=4)
2.2 紫杉醇对人喉鳞状细胞癌细胞膜唾液酸、膜磷脂及膜胆固醇含量变化的影响
21.4~85.4 μg·L-1紫杉醇与细胞接触24 h,能使人喉鳞状细胞癌细胞膜唾液酸含量不同程度降低,膜磷脂含量不同程度升高,但对胆固醇含量及反映膜流动性的C/P值无明显影响(见表2)。
表2 紫杉醇对人喉鳞状细胞癌细胞膜唾液酸、磷脂及胆固醇含量变化的影响(±s,n=4)

表2 紫杉醇对人喉鳞状细胞癌细胞膜唾液酸、磷脂及胆固醇含量变化的影响(±s,n=4)
注:与对照组比较,#P<0.05,##P<0.01
—21.4 42.7 85.4对照组紫杉醇组组别 唾液酸(μmol·g-1prot)磷脂(P)(μmol·g-1prot)胆固醇(C)(μmol·g-1prot)C/P值93.0±3.8 82.6±3.3#67.0±1.4##49.9±3.3##238.4±2.3 263.0±4.3##307.8±3.7##316.9±3.6##198.1±16.0 196.9±22.9 213.2±27.0 202.1±20.8剂量(μg·L-1)0.831 0 0.748 6 0.692 7 0.637 7
3 讨论
本文将紫杉醇与人喉鳞状细胞癌细胞接触24 h,通过检测细胞琥珀酸脱氢酶 (该酶将黄色的MTT还原为蓝紫色物质)活性及MTT比色法敏感度反映细胞存活和增殖状况,观察紫杉醇对人喉鳞状细胞癌细胞株Hep-2的抑制作用。结果表明,紫杉醇对人喉鳞状细胞癌细胞株Hep-2有明显的抑制作用。同时,对人喉鳞状细胞癌细胞膜生化特性变化的分析结果表明:紫杉醇能引起人喉鳞状细胞癌细胞膜唾液酸含量降低及膜磷脂含量升高。紫杉醇对人喉鳞状细胞癌细胞膜唾液酸含量的影响可能与其抗癌机制有一定关系,因为唾液酸减少可影响细胞表面电荷特性、膜的物质转运过程、抗原决定簇的暴露、免疫应答细胞活化、膜表面受体功能等与细胞增殖有关的因素[9]。胆固醇和磷脂是组成细胞膜脂质双层的重要成分,两者比值(C/P)是反映膜流动性大小的常用参数。已发现某些流动性肿瘤如腹水癌、白血病等的细胞膜流动性明显增大,降低膜流动性则动物移植瘤的恶性度也随之降低[4]。该研究表明,紫杉醇对C/P值无影响,紫杉醇在抑制人喉鳞状细胞癌细胞增殖的同时并不涉及细胞膜流动性的变化。本实验结果表明紫杉醇能引起人喉鳞状细胞癌细胞膜磷脂含量升高,提示膜磷脂的变化可能与紫杉醇的抗癌机制有关。可见紫杉醇可明显抑制人喉鳞状细胞癌细胞株Hep-2的增殖,其作用机制可能与膜生化特性改变有关,其中对膜唾液酸含量及膜磷脂含量的影响是重要环节。
[1]Holsinger F C,Kies M S,Diaz E M Jr.Durable long-term remission with chemotherapy alone for stage II to IV laryngeal cancer[J].Clin Oncol,2009,27(12):1933~1934.
[2]Dietz A,Rudat V,Dreyhaupt J,et al.Induction chemotherapy with paclitaxel and cisplatin followed by radiotherapy forlarynx organ preservation in advanced laryngeal and hypopharyngeal cancer offers moderate late toxicity outcome (DeLOS~I~trial)[J].Eur Arch Otorhinolaryngol,2009,266(8):1291~1300.
[3]李莉,董频,万夷,等.人喉癌紫杉醇耐药细胞株的建立及其生物学特性[J].临床耳鼻喉头颈外科杂志,2007,21(18):843~847.
[4]Gagnon P J,Galderisi C,Page B R,et al.Angiosarcoma developing after curative induction chemotherapy and radiotherapy for locally advanced squamous cell carcinoma of the larynx[J].Head Neck,2009,31(6):829~832.
[5]Knab B R,Salama J K,Solanki A,et al.Functional organ preservation with definitive chemoradiotherapy for T4 laryngeal squamous cell carcinoma[J].Ann Oncol,2008,19(9):1650~1654.
[6]徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002.
[7]王学军,赵锁奇,王仁安.超临界流体色谱法分析大豆磷脂[J].色谱,2001,19(4):344~346.
[8]张传涛,史业辉,佟仲生.紫杉醇联合肿瘤坏死因子相关凋亡诱导配体诱导MCF-7乳腺癌细胞系凋亡机制的研究[J].中华乳腺病杂志,2008,2(6):661~669.
[9]Xie M,Zhou L,Hu T,et al.Intratumoral delivery of paclitaxel~loaded poly(lactic-co-glycolic acid)microspheres for Hep-2 laryngeal squamous cell carcinoma xenografts[J].Anticancer Drugs,2007,18(4):459~466.
R979.1
B
1671-1246(2012)07-0112-02

