湖北地区花粉变应原在特应性皮炎患者中作用的研究
吴志洪,涂亚庭,陈宏翔,张 鹏,石 扬,康小平,薛 芹
特应性皮炎(atopic dermatitis,AD)是机体受到外界一个或多个特异性变应原作用后,诱发的一种变态反应性疾病,主要由吸入性变应原引起。有报道部分儿童在花粉季节面部容易出现湿疹;也有报道在密切接触吸入性变应原后AD皮损明显加重[1]。除变应原外,遗传背景在AD的发生、发展中也起重要作用,AD患者常合并过敏性鼻炎(allergic rhinitis,AR)和支气管哮喘(bronchial asthma,BA)[2]。有研究发现30.3%的AR患者有AD症状,而99.3% 的AR患者有BA病史[3]。70%的AD患者有家族过敏史;而有花粉过敏史的AD患者有50%~80%常伴有AR或BA病史[4],且多数表现为严重的面部湿疹样皮损。目前认为,特异性免疫治疗是唯一可能改变变应性疾病自然病程的治疗方法。关于花粉脱敏治疗AR或BA已有很多报道,但关于其在AD中的作用报道很少且存在诸多的争议。我们采用本地花粉变应原,研究其对AD患者(包括合并和不合并AR或BA患者)特异性脱敏治疗的临床疗效。
1 材料与方法
1.1 临床资料
选择2008年6月~2010年6月97例AD患者为研究对象,均符合Willimans 1994年提出的AD诊断标准;AR的诊断标准参照文献[5]。患者年龄为6~28岁,男 46例,女 51例。均排除真菌及细菌感染,治疗前 2周内无系统应用皮质类固醇激素及免疫抑制剂史。AD合并AR(37例)或BA(18例)55例(合并组);AD不合并AR或BA(不合并组)42例。正常健康人10例为正常对照组,年龄 13~30岁。
1.2 血清总IgE和过敏原特异性IgE的检测
采用Bayer公司的ACS:180总IgE检测试剂盒在ACS180PLUS免疫化学发光仪上用免疫发光法测定血清总IgE水平,操作按说明书进行,正常参考值范围为<120 IU/ml。采用德国欧盟公司提供的过敏原特异性IgE抗体检测试剂盒(中国组合),以免疫印迹法检测血清中过敏原特异性IgE抗体。吸入性过敏原特异性IgE包括:树组合、矮豚草、蒿、尘螨组合、屋尘、花粉组合、猫毛、狗上皮、蟑螂、真菌组合。实验操作方法严格按试剂盒说明书进行,根据实验膜条上出现的与参照物上标志相对应的清晰可见的条带进行结果判定。
1.3 过敏原治疗
经过医院医学伦理委员会审批,采用本地花粉变应原浸液,为秋季蒿属和豚草属花粉的混合抗原,合并组和不合并组患者同时给予特异性免疫治疗。初次抗原浓度为 1:108,每周免疫2次,逐渐增加剂量和浓度;开始剂量为0.1ml,每次递增 0.1ml,10次为一疗程;一个疗程结束后浓度相对于上一次增加10倍,治疗5个疗程后观察疗效。
1.4 疗效评分标准及判定标准
从以下3个方面对患者颈面部以及躯体两侧的治疗效果分别进行评分:①瘙痒改善情况:采用视觉模拟尺度评分法 (visual analogue scale,简称 VAS)将瘙痒分为4级(0~3分)每级1分;②临床症状改善情况:采用皮疹面积及严重程度指数(eczoma area and severity index, EASI)评分法[6],根据不同部位皮损面积和症状严重程度分为 4级(0~3级,每级1分);③患者自评:患者根据治疗前后症状改善的程度进行自我评分,分为非常满意、基本满意、不满意3个等级。主要参考EASI评分法,治疗指数=(治疗前积分-治疗后积分)/治疗前积分×100%。疗效指数≥90%为病情基本控制,60%~89%为显著改善,20%~59%为一般改善,<20%为无效。基本控制加显著改善例数的百分比计为有效率。
1.5 统计学方法
在治疗5个疗程前后检测血清中总IgE的水平,与患者的得分进行相关分析,采用 SPSS13. 0软件进行分析。两组治愈率比较采用X2检验和Ridit分析,两组 EASI评分采用配对t检验。
2 结果
2.1 血清总IgE和过敏原特异性IgE的检测结果
10例正常对照组总IgE抗体检测结果105.8IU/ml,接近于正常参考范围120 IU/ml。42例不合并组患者血清中总IgE抗体检测平均值为542.6IU/ml,55例合并组(有家族过敏史28例)明显高于其它两组,平均值1325.2 IU/ml。过敏原特异性IgE的检测结果显示97例患者中吸入性过敏原呈阳性69例,合并组主要以花粉(33例)和螨(10例)为主;而不合并组则是真菌组合(15例)和屋尘(9例)为主,其中AD合并AR或BA组与不合并组相比对花粉过敏的差异具有显著性意义(X2=12.4615,P<0.01),患者血清IgE与特异性IgE的检测结果见表1。
2.2 脱敏治疗前后疗效观察
完成常规脱敏治疗5个疗程后对97例患者进行疗效观察,其中AD合并AR或BA组病情基本控制21例(38.2%),显著改善 23例(41.8%),一般改善7例(12.7%),无效4例(7.3%),总有效率(痊愈+显效)为 92.7%。此外,合并组2例复发,而不合并组31例复发,不合并组复发率明显高于合并组,差异具有显著性意义(X2=6.2308, P<0.05)。两组有效性比较,合并组效果明显优于不合并组,差异有统计学意义(μ=3.0370,P<0.01)。此外,不合并组虽然以尘螨和真菌为主,但花粉变应原治疗亦有一定疗效,说明该组亦存在一定的花粉交叉过敏情况,值得进一步研究。
2.3 脱敏治疗前后IgE的变化
两组患者治疗前后外周血中IgE和特异性IgE的比较见表3。治疗前两组患者血清IgE和特异性IgE均高于正常,治疗后两组患者外周血IgE和特异性IgE水平均降低。治疗前后配对比较合并组t=2364.77,P<0.005;不合并组t=254.89,P<0.01,合并组治疗效果明显优于不合并组。两组患者治疗前后 EASI评分比较结果类似;而特异性IgE结果显示不合并组治疗前4例花粉++,治疗后为3例;而合并组治疗效果明显,治疗前33例过敏,治疗后3例为+±,治疗前后比较见表3。
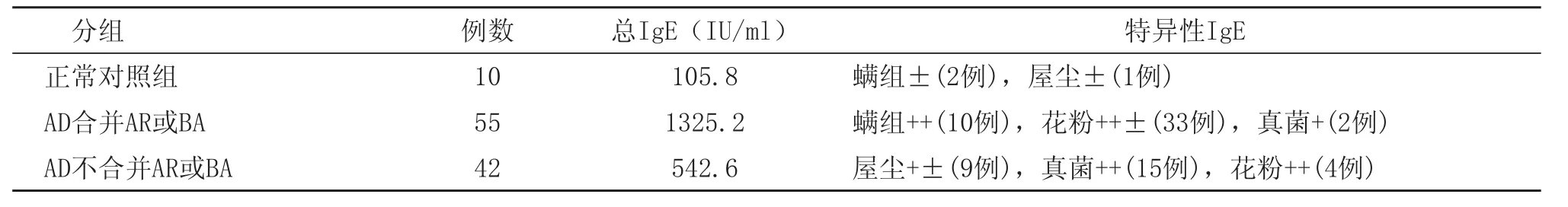
表1 97例AD合并或不合并AR或BA患者血清IgE与特异性IgE的检测结果
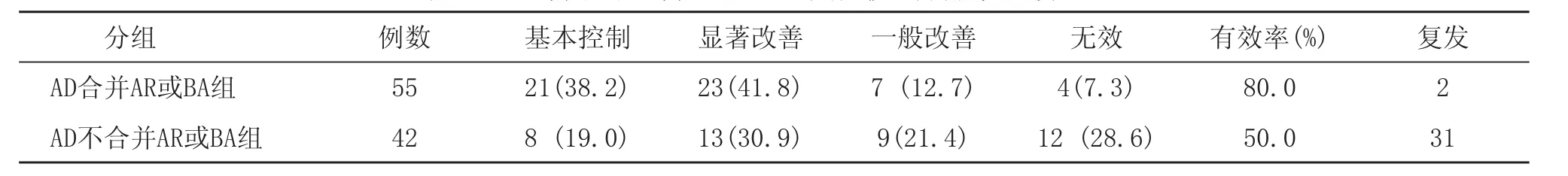
表2 AD合并和不合并AR或BA患者脱敏治疗疗效比较 (%)

表3 AD合并和不合并AR或BA患者脱敏治疗前后IgE及EASI积分比较
3 讨论
Roger Kapoor等对2270例特应性皮炎患者进行研究发现71.3%患者至少有一种形式的过敏哮喘或过敏性鼻炎,在一些患儿中特别是3岁左右的患儿尤为明显,且合并过敏哮喘或过敏性鼻炎的特应性皮炎患者难于治疗[7]。有研究表明AR和BA等过敏疾病和AD有共同或相似的遗传致病基因[8,9]。Lee 等对居住在新加坡地区257个中国家庭研究,发现家族史明显增加了患AD和AR的几率[10]。已发现AD或AD伴BA与染色体1q21,17q25和20p相连锁;AD患者基因位点与染色体3q14, 17q21 相连锁;AD伴哮喘、遗传过敏症与染色体13q14 相连锁[11]。而Shek等发现新加坡的中国人群中AD伴AR与5q31-33密切相关[12],这种基因关联表现为总IgE 和特异性IgE增高。本研究中我们对湖北地区的AD合并AR患者进行血清学检测,发现AD合并AR的患者症状严重程度和发病几率明显高于其他患者,且IgE水平符合这一规律。
长期以来,对AD患者尤其是中重度患者的治疗一直依赖于肾上腺糖皮质激素,但长期使用此类药物产生的皮肤萎缩变薄、毛细血管扩张和肾上腺抑制等副作用使其在临床使用受到一定的限制。钙调神经磷酸酶抑制剂可抑制抗原特异性 T细胞的活化和增殖,抑制免疫和炎症细胞中的细胞因子转录,治疗AD长期疗效可能超过中强效糖皮质激素;但美国FDA发布了关于外用吡美莫司和他克莫司与潜在肿瘤风险(主要是淋巴瘤和皮肤癌)相关性的警告,强调吡美莫司和他克莫司只有在一线药物治疗失败或患者不能耐受时才能使用[13]。目前认为特异性免疫方法是唯一可以改变变应性疾病自然病程的治疗措施,且具有上述方法中无法具有的优点。国外有文献报道皮下注射过敏原特异性免疫治疗可有效治疗对尘螨过敏的AD患者[14]。一般认为,食物性过敏原仅仅在小于2岁有严重湿疹的AD患者中起作用;而吸入性过敏原(尘螨和花粉)主要在成人起作用。日本学者发现Cedar花粉是特应性皮炎的一个很重要的加重因素[15]。
我们前期研究结果表明,花粉与AD合并AR或BA密切相关,且合并组颈面部的皮损情况明显高于不合并组。对于吸入变应原阳性的AD患者,往往由于患者难以完全避免接触吸入变应原,因此可以采用特异性脱敏治疗,通过抗原反复刺激患者机体来增强对抗原的适应性而达到治疗目的。花粉变应原存在地区特异性的特点,湖北大部分地区以蒿草占优势,以蒿属、葎草属、豚草属、禾本科草本植物为主;其中秋季优势花粉授粉期长,致敏原性强。而豚草近年在湖北迅速蔓延,有可能取代蒿属花粉成为湖北最重要的致敏花粉。本研究中我们采用本地花粉变应原浸液,为秋季蒿属和豚草属花粉的混合抗原,研究其对AD患者(包括合并和不合并AR或BA患者)特异性脱敏治疗试验的临床疗效,结果表明合并组完成常规脱敏治疗5个疗程后总有效率为80.0%,合并组治疗效果明显高于不合并组,且复发率低,说明花粉特异性脱敏可用于AD患者的治疗。
[1]Tan BB, Weald D, Strickland I, et al. Double-blind controlled trial of effect of housedust-mite allergen avoidance on atopic dermatitis [J]. Lancet, 1996,347(8993):15-18.
[2]Torres-Borrego J, Molina-Teran AB, Montes-Mendoza C.Prevalence and associated factors of allergic rhinitis and atopic dermatitis in children [J]. Allergol Immunopathol (Madr), 2008,36(2):90-100.
[3]Remes ST, Korppi M, Kajosaari M, et al. Prevalence of allergic rhinitis and atopic dermatitis among children in four regions of Finland [J]. Allergy, 1998, 53(7):682-689.
[4]Correale CE, Walker C, Murphy L, et al. Atopic dermatitis: a review of diagnosis and treatment [J]. Am Fam Physician, 1999,60(4):1191-1198, 1209-1210.
[5]中华耳鼻咽喉头颈外科杂志编辑委员会, 中华医学会耳鼻咽喉科分会. 变应性鼻炎诊治原则和推荐方案(2004年,兰州) [J].中华耳鼻咽喉科杂志, 2005, 40(3):166-167.
[6]Hanifin JM, Thurston M, Omoto M, et al. The eczema area and severity index (EASI): assessment of reliability in atopic dermatitis.EASI Evaluator Group [J]. Exp Dermatol, 2001, 10(1):11-18.
[7]Kapoor R, Menon C, Hoffstad O, et al. The prevalence of atopic triad in children with physician-confirmed atopic dermatitis [J]. J Am Acad Dermatol, 2008, 58(1):68-73.
[8]Callen J, Chamlin S, Eichenfield LF, et al. UA systematic review of the safety of topical therapies for atopic dermatitis [J]. Br J Dermatol, 2007, 156(2):203-21.
[9]Hanifin JM, Cooper KD, Ho VC, et al. Guidelines of care for atopic dermatitis, developed in accordance with the American Academy of Dermatology (AAD)/American Academy of Dermatology Association "Administrative Regulations for Evidence-Based Clinical Practice Guidelines" [J]. J Am Acad Dermatol, 2004, 50(3):391-404.
[10]Lee JT, Lam ZC, Lee WT, et al. Familial risk of allergic rhinitis and atopic dermatitis among Chinese families in Singapore [J].Ann Acad Med Singapore, 2004, 33(1):71-74.
[11]Leung DY, Boguniewicz M, Howell MD, et al. New insights into atopic dermatitis [J]. J Clin Invest, 2004, 113(5):651-657.
[12]Shek LP, Tay AH, Chew FT, et al. Genetic susceptibility to asthma and atopy among Chinese in Singapore-linkage to markers on chromosome 5q31-33 [J]. Allergy, 2001, 56(8):749-753.
[13]Aschoff R, Schwanebeck U, Brautigam M, et al. Skin physiological parameters confirm the therapeutic efficacy of pimecrolimus cream 1% in patients with mild-to-moderate atopic dermatitis [J]. Exp Dermatol, 2009, 18(1):24-29.
[14]Cadario G, Galluccio AG, Pezza M, et al. Sublingual immunotherapy efficacy in patients with atopic dermatitis and house dust mites sensitivity: a prospective pilot study [J]. Curr Med Res Opin,2007, 23(10):2503-2506.
[15]Kimura M, Obi M, Saito M. Japanese cedar pollen-specific interleukin-4 production develops immediately after the first exposure to pollens in infants with atopic dermatitis [J]. Clin Exp Allergy, 2004, 34(7):1032-1036.
[16]Darabi K, Hostetler SG, Bechtel MA, et al. The role of Malassezia in atopic dermatitis affecting the head and neck of adults [J]. J Am Acad Dermatol, 2009, 60(1):125-136.

