电位滴定法测定自来水水硬度——一个仪器分析实验的改进
王焕英
(衡水学院化工学院, 河北 衡水 053000)
随着人们生活质量的不断提高,人们对饮用水的健康关注度也越来越多,饮用水卫生质量好坏,直接影响着人们的健康,而水硬度(即水中钙、镁总量)是衡量水质好坏的一个重要指标。卫生部2001年《生活饮用水水质卫生规范》中将水硬度作为生活饮用水常规检测指标。
仪器分析实验中“标准曲线法测定水中钙离子”,只能使用钙离子选择性电极单独测定一种离子,无法实现水中钙、镁的连续分步滴定。
本文采用电位滴定法测定自来水中钙、镁含量,本法具有快速、简单的特点,结果准确可靠 ,重现性好,适用于检测水中总硬度的含量。
1 实验部分
(1)0.02mol/L EDTA 标准溶液的配制
(2)缓冲溶液及辅助配位液的确定
配位滴定过程中,溶液pH 值直接影响滴定结果。EDTA滴定钙、镁含量时,pH=10-11 时形成的配合物具有较大的稳定性,当溶液pH< 10 时,由于酸效应的存在,Ca2+、Mg2+与EDTA 生成的络合物不能定量形成;当溶液pH>12 时,一部分 Mg2+生成 Mg(OH)2沉淀,使测定结果偏低,所以选择pH≈10 为宜。
pH≈10 氨性缓冲溶液条件下,只有一个滴定终点,测定的是钙和镁的总含量,而在乙酸丙酮-Tris 介质中,滴定时分别得到钙、镁的两个滴定终点,从而实现混合溶液中Ca2+、Mg2+的连续测定。故选用 pH≈10 的乙酸丙酮-Tris 缓冲体系作为滴定反应介质。
(3)测量水样
准确移取50.00 水样于烧杯中,加入20.00ml 辅助配位液,摇匀,将电极插入溶液,连接电位滴定仪,用EDTA 标准溶液滴定,记录加入滴定剂过程中指示电极不断变化的电位,通过二阶微商法计算,确定滴定终点。
2 结果与讨论
2.1 实验数据

表1 电位滴定数据表
2.1 实验结果
通过二阶微商法即Δ2E/ΔV2=0 计算滴定终点,并根据EDTA 标准溶液的浓度计算出饮用水中钙镁含量。Ca2+含量为89.8 mg/L,Mg2+含量为25.3 mg/L,水硬度为312.0 mg/L。
2.2 方法的准确度
做了加标回收率实验,结果见表2,钙的加标回收率为98.12%-103.34%, 平均回收率为 100.83%,镁的加标标回收率为95.83%-102.14%,平均回收率为98.98%。
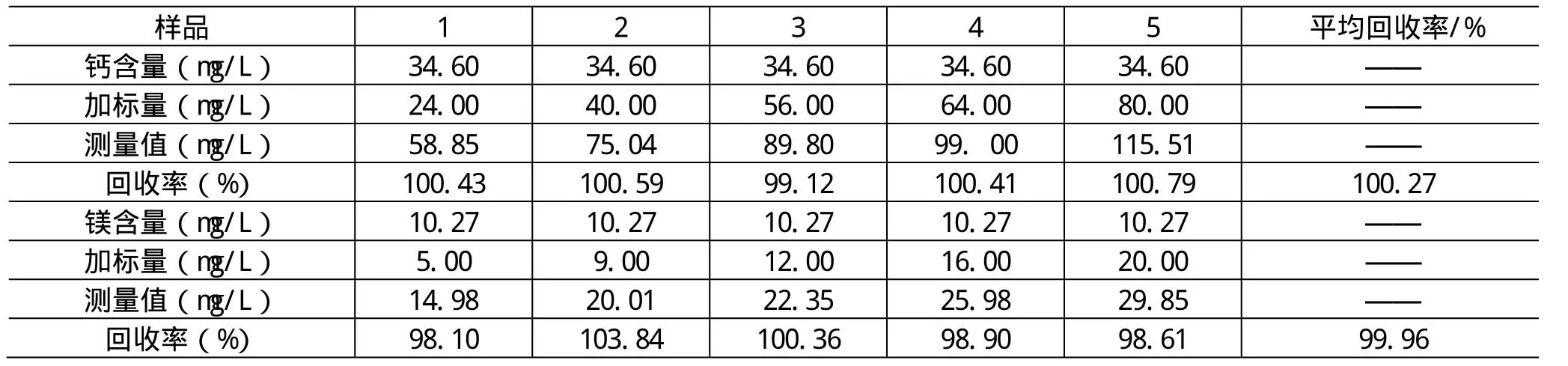
表2 加标回收试验结果
3 结论
以钙离子选择性电极为指示电极,Ag/AgCl 电极为参比电极, EDTA 为滴定剂在乙酸丙酮的Tris 缓冲溶液介质中,采用电位滴定法滴定水中钙、镁离子含量。该种方法具有仪器价格低廉、不需对样品进行预处理、操作简单、快速、结果准确等特点,并解决了水中钙镁离子连续分步滴定的问题。
[1]吴茂江.饮用水与人体健康[J].河北师范大学学报自然科学版.2002,26(3):316-318.
[2]武先锋,陶勇.GIS 在饮水与健康领域中的应用及开发[J].中国疾病预防控制中心农村改水技术指导中心,国外医学卫生学分册,2005,(5):285-289.

