血凝和血凝抑制试验常见问题及解决方法
蔡文杰 ,邱立新 ,邱美珍 ,杜丽飞
(1.湖南畜牧兽医研究所,湖南长沙 410131;2.湖南省动物疫病预防控制中心,湖南长沙 410007)
1 前言
血凝试验(H A)和血凝抑制试验(HI)由于能同时进行大量样本分析,试验过程易于操作以及结果快速、准确等特点而成为目前我国各地疫病诊断、流行病学调查、免疫程序制定及免疫效果监测等的主要手段之一,与酶联免疫吸附试验(ELISA)具有同样重要的作用。
近年来,经常在技能比武、兽医实验室考核和实验室比对试验中采用血凝和血凝抑制试验方法检测新城疫或禽流感抗体,试验所需时间不长,涉及到的实验因素在血清学试验中有一定的代表性。同时该试验具有可比较性和可重复性,试验结果容易观察和辨认,能客观反映出实验人员的水平和能力的优点。另外,由于近年来动物防疫工作的需要,各地广泛采用这一方法评价免疫抗体水平,有的把试验结果直接与目标管理考核和绩效考评挂钩,有时一个试验结果的好坏就决定排名先后,甚至是年度工作绩效和收入。因此,各地兽医实验室非常重视这一实验。不仅国内如此,其他国家也经常在教学和实验室技能比赛,比对试验(包括人员之间比对、实验室之间比对)等方面运用该试验。然而,这一看似简单的方法,如果不注意很可能不同的人做同一份血清,其结果有天壤之别。为了更好地掌握这项检验技术,现总结了一些经验,供同行参考与交流。
2 缓冲体系的配制
根据新城疫和禽流感的相关国家标准[1~2],H A、HI试验的缓冲体系是0.01 Mp H7.2 PBS,保持整个试验各步骤缓冲体系的一致性很重要,不论在洗鸡红细胞、配制1%鸡红细胞,还是在做H A试验或HI试验都应使用这种缓冲液。实验室的缓冲液最好现配现用,高压灭菌后使用,一般放置冷藏冰箱不超过1个月,当发现PBS中有絮状沉淀物时不宜再用。配制PBS时要注意的是,如果按照上述标准文本中磷酸氢二钠的用量是1.44 g/L,而我们常用的磷酸氢二钠中含12个水分子,因此用量要换算增加。
一般情况下PBS配好后不需调p H值,配好后高压灭菌,冷藏保存备用。若需要调则用1 N的N a O H调p H值到7.2。值得引起注意的是现在市面上买的p H试纸很多不准确,有条件的实验室最好用酸度计测试已经购买的p H试纸。现在市面上也有小包装的PBS粉购买,每包可配制1000 mL PBS溶液,使用非常方便。根据我国禽流感研究先驱唐秀英老师的经验,禽流感试验中包括琼扩和H A、HI试验,还是用略偏酸性的PBS较好(p H 6.8)。我们的经验是在没有PBS的情况下用复方氯化钠注射液(林格氏液)也有类似效果。
3 血凝板或微量振荡器的使用
采用一次性血凝板做实验是最好的,尤其是在做比对试验这种量小又是关键性的试验时。目前市面上可重复使用的聚苯乙烯有机玻璃板购买时要注意底角是否为90度,底面是否光滑,清洁,如果不清洁,清洗后可用棉签醮酒精把孔底擦干净。有机玻璃血凝板的好处是可以叠放,在做大批量检测试验时节省空间。用过的微量血凝板应立即用高压自来水把每个孔都冲洗干净,甩干,倒扣温箱中烘干以便下次使用。
微量振荡器使用时应注意振动不宜过大,时间不能太长,一般振动10秒钟即可。多块板同时振动时要注意压住上板,以防液体溅出而影响结果。
31%鸡红细胞悬液及抗凝剂
3.1 1%鸡红细胞悬液的配制
一般来说,使用3.8%的柠檬酸钠溶液作为抗凝剂是比较简单方便的。3.8 %柠檬酸钠的配制:称取3.8 g柠檬酸钠置三角烧瓶中,加纯水100 mL,15磅、15 min高压灭菌,分装到2 mL离心管中,冻存备用。
制作1%鸡红细胞时,取十分之一采血量的3.8%柠檬酸钠溶液到一次性注射器中,健康公鸡翅下静脉采血后立即混匀,将抗凝血加到离心管中,用10倍以上血量的PBS洗涤3次(2000 r/min,每次离心5 min),抽干红细胞泥上的上清液,采用红细胞压积的方法计算出配制1%鸡红细胞悬液的量。具体方法是用注射器抽取一定量PBS打散离心管底的红细胞泥,然后抽回到注射器中,这两种量的差就是红细胞的量。如抽取3mLPBS打散红细胞泥,抽回后得4mL,测得红细胞为1mL,这样可配制100mL1%鸡红细胞悬液。
3.2 配制经验
采用红细胞压积方法常因各实验室所用的离心机的转子半径有差异致离心力不同以及离心的速度不同,从而使红细胞压积量不同,也因红细胞压积时上清液没有抽干,或在洗涤红细胞弃去上清液时红细胞流失,配制时出现较大的误差,这是应该注意的。根据经验每采1mL鸡血可配成30 mL左右的1%鸡红细胞。如果超过了40 mL,则配制不准,如果超过的量更大,则实验将受到极大影响。配制1%鸡红细胞悬液是整个实验的关键之一,配准了,以后的实验一般会比较顺利。曾有某实验室采10 mL鸡血却配制出了800 mL“1%鸡红细胞”,这样的H A、HI实验难以成功。
4 血凝试验中常见问题
4.1 抗原配制
如果用冻干血凝抗原做H A、HI试验,需要重悬冻干抗原(冻干血清也同样):按瓶签要求的量加入灭菌注射用水,摇匀。最好提前重悬,冻存过夜,第2天解冻后使用,这样做的效果会稳定一些。有的实验室在重悬冻干抗原时用PBS或生理盐水,这是不正确的,因为冻干品中原液的盐分都留下来了,只需要加入注射用水或者灭菌纯水就行了。
4.2 血凝效价测定
做血凝试验是为了准确测量血凝效价,为配制四单位抗原和做血凝抑制试验而准备。为准确测量出血凝价,一般要求做三排相同的试验。有的为更加准确测量出血凝效价,也可以考虑将抗原三倍稀释与二倍稀释各做二排,二者结合起来计算出凝集终点(一单位抗原)的稀释倍数。血凝试验每孔液体总量为75 μL,抗原稀释后各孔要补充PBS至50 μL后再加25 μL 1%鸡红细胞。加红细胞时要注意防止“挂滴”现象的发生(红细胞没有全部加到孔中,而是有一部分挂在吸嘴尖上)。H A试验结果判断时要求将板倾斜45度,观察沉集红细胞流淌情况(图1中C、D所示),凡是有流淌的都不能算成100%凝集。掌握100%红细胞凝集作为血凝试验的终点很重要,如果终点孔中心有点状沉集,都对以后的试验有较大的影响。红细胞没有充分打散或采血后血液与抗凝剂没有充分混匀常出现这种情况。当红细胞配制浓度偏低时,终点判定很容易出现错误,这也多是找不到实验失败原因的主要问题。为了准确判断血凝终点、防止实验失败而重做,往往宁可严一点,也决不可放松判定,这也应该是有经验的实验员常常采取的策略。
4.3 血凝效价测定结果的有效时间
血凝试验的结果往往只是当批次有效,如果下午(尤其是在夏天)或第2天接着做实验的话就要重新测量血凝价了。血凝效价是与当时做H A试验时的红细胞悬液相配套的。如果换了一批红细胞悬液,就必须重新测试血凝抗原的效价;同理,如果换了抗原也同样需要重新测定。血凝试验做完,四单位抗原配制好后,要把剩余的抗原(冻干重悬的原液)立即冷冻保存才不至于抗原效价有大的损失。血凝试验一般在加鸡红细胞后不少于30 min看结果,冬季可适当延长至40 min,总之一定要待空白对照孔中液体清亮,才能读结果。
5 血凝抑制试验中常见问题
5.1 样品血清
新鲜的样品血清一般可以不需要灭活处理,然而有的送检血清已经变质,最好经过56℃水浴30分钟灭活处理,这样做出来的结果才会一致。冻存样品血清在解冻后出现分层的现象,摇匀才能用于检测。
5.2 阴性血清
试剂提供商一般不提供阴性对照血清。可用8倍稀释灭活的猪血清代替。
5.3 阳性血清
如果是冻干品按前述抗原稀释的方法重悬,摇匀后用于实验。
5.4 禽流感抗体检测

做禽流感抗体检测时,最好使用与被检血清相同的红细胞,如检测水禽血清最好用鸭红细胞。这样可以省去处理样品血清的麻烦。水禽血清在做HI试验时常有非特异性凝集(前凝集)发生,如图1所示。有的甚至可以达到5孔,给判定结果带来不便。为去掉非特异性凝集,在不方便取水禽红细胞时,常将血清进行处理。方法是:取5%~10%鸡红细胞与等量水禽血清混合30 min,取上清液做HI试验。结果判定时要比原方法高一个滴度。
一般说来,只要1%鸡红细胞和四单位抗原配制准确,血凝抑制试验只要按程序操作一般都会成功。在做大量样品检测时,常有将样品只做8孔的情况,虽然可以查出阳性率或合格率,但高效价的血清测量不到顶。
5.5 抗原回滴的操作
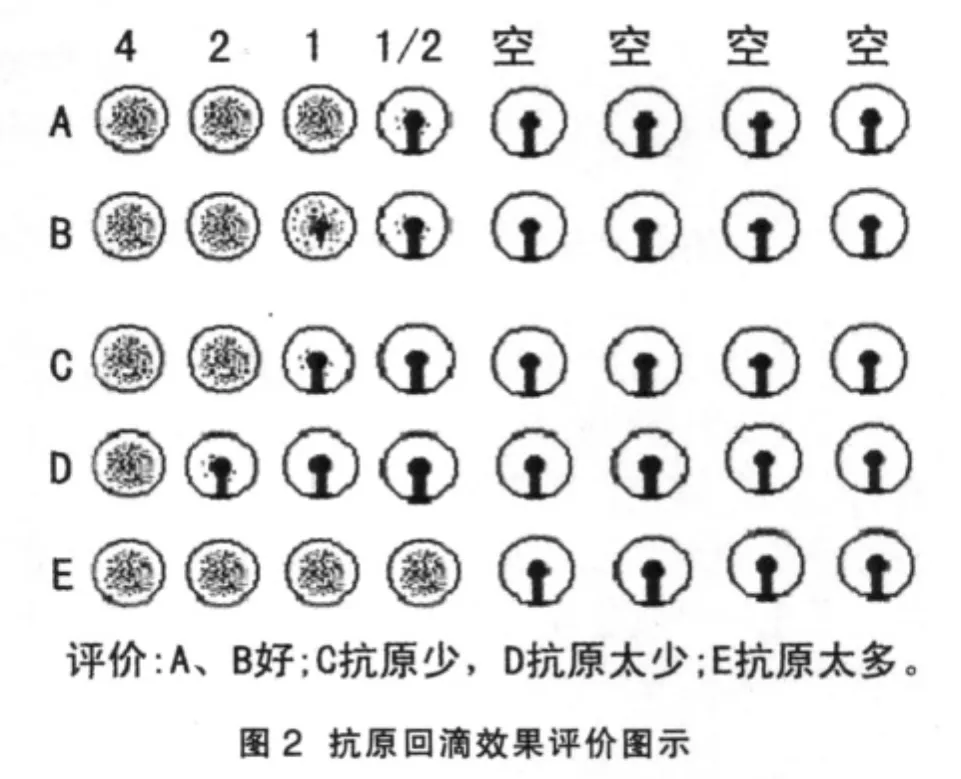
抗原回滴(或称为4单位抗原校正见图2)是适时检测四单位抗原配制是否准确的重要方法[3~4]。抗原回滴的操作一般是:在2排或3排孔中各加25μLPBS,在第1、2列孔中各加25 μL四单位抗原,从第2列孔向第4列孔作倍比稀释,弃去最后25 μL,从第2列孔向最后一孔各补25 μL PBS,然后每孔各加25 μL 1%的鸡红细胞悬液。振荡混匀,静置30分钟后观察结果。从左至右第一列为四单位抗原,第二列为二单位抗原,第三列为一单位抗原,第四列为二分之一单位抗原,第五至第八列为空白对照。抗原回滴是用来评价四单位抗原配制的准确情况,在结果判定前先看抗原回滴的情况。如果一单位抗原的结果为100%凝集则四单位抗原配准确了(如图A排);如果一单位抗原没有达到100%凝集,但达到了85%以上的凝集,二分之一单位抗原流下来一半(不流到底边),也算准确;如果凝集图形如C、D、E排那样,则分别表示抗原偏少、抗原太少和抗原太多。血凝抑制试验成功与否的判断要素:阳性血清不超过标准值的±1个滴度;阴性对照血清在2Log2以下时为100%凝集;空白对照液体清亮,红细胞流淌良好(100%阴性);抗原回滴时结果准确。 □
[1] GB/T 16550-2008,新城疫诊断技术规程(S).
[2] GB/T 18936-2003,高致病性禽流感诊断技术(S).
[3] 常磊,孙娅莉,吴德喜,等.血凝和血凝抑制试验的影响因素[J].中国家禽,2011,(16):67~69.
[4] GB/T 17999.2-2008,SPF鸡微生物学监测第2部分:SPF鸡红细胞凝集抑制试验(S).