甲酸到戊酸减电子、加电子对其分子轨道的影响
姚树文,崔乘幸,侯振雨
(河南科技学院,河南新乡453003)
分子轨道理论是处理双原子分子及多原子分子结构的一种有效的近似方法,是化学键理论的重要内容.它与价键理论不同,价键理论着重于用原子轨道的重组杂化成键研究化学问题,而分子轨道理论则注重于分子轨道的了解,即认为分子中的电子围绕整个分子运动[1].量子化学中以原子轨道线性组合近似来计算分子轨道波函数[2-3],波函数中的cij系数可由将等式代入薛定谔方程以及应用变分原理求得.简单地讲,分子轨道是由原子轨道组合而成.原子轨道波函数各乘以某一系数相加或相减,得到分子轨道波函数.组合时原子轨道对分子轨道的贡献体现在系数上,组合前后轨道总数不变.利用分子轨道理论与价键理论通常只是从一个问题的两个方面去看问题,常常会得到相同的结论[4].
日本化学家福井谦一在1952年提出,分子中也存在象原子中的“价电子”那样活跃的分子轨道,即能量最高的电子占有轨道(最高占据轨道)和能量最低的电子未占有轨道(最低非占据轨道),统称前线分子轨道.分子进行化学反应时,只和前线分子轨道有关,最高占据轨道具有原子轨道在线性组合成分子轨道时(即两个波函数相加得到的分子轨道),能量较低的分子轨道叫成键轨道.成键轨道总是与反键轨道成对出现,其余为非键轨道.成键轨道是由两个原子符号相同的部分相加重叠而成.成键轨道中,核间的电子的几率密度大.电子在成键轨道中可以使两个原子核结合在一起.形成稳定分子,成键轨道有σ成键轨道和π成键轨道(以符号σ和π标记).加电子默认的是alpha轨道加电子,减电子减的是beta轨道电子[5-6].
本文的主要目的是使用量子计算的方法来研究从甲酸到戊酸分别加一个电子或者减一个电子之后的轨道系数变化,并以此来说明中性分子加减一个电子的位置.文章中所有计算均在Gaussian 03程序中进行[7],分子模型的构建在Gaussian View5.0中进行.
1 理论计算过程
在Gaussian View 5.0中构建从甲酸到戊酸的分子模型,每种分子设置-1,0和1三种价态.-1价态为分子得到一个电子的模型,依据量子化学原理,其自选多重度为3;0价态为未得失电子的模型,其自选多重度为1;1价态为失去一个电子的模型,其自选多重度为3.每种分子在相同理论方法和基组条件HF/STO-3G下提交到Gaussian 03程序中进行计算,加入pop=full关键词,在结果中输出不同分子的分子轨道信息.计算结束后,提取各个分子的分子轨道组成,进行分析.
2 结果及分析
2.1 甲酸到丙酸
(1)从甲酸的计算结果文件中提取各个分子轨道的系数,结果见图1、表1.
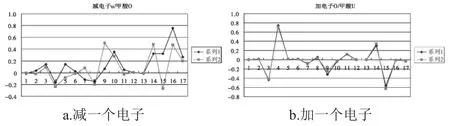
图1 甲酸减或加一个电子后的轨道系数Fig.1 Coefficients of occupied molecular orbitals of the formic acid
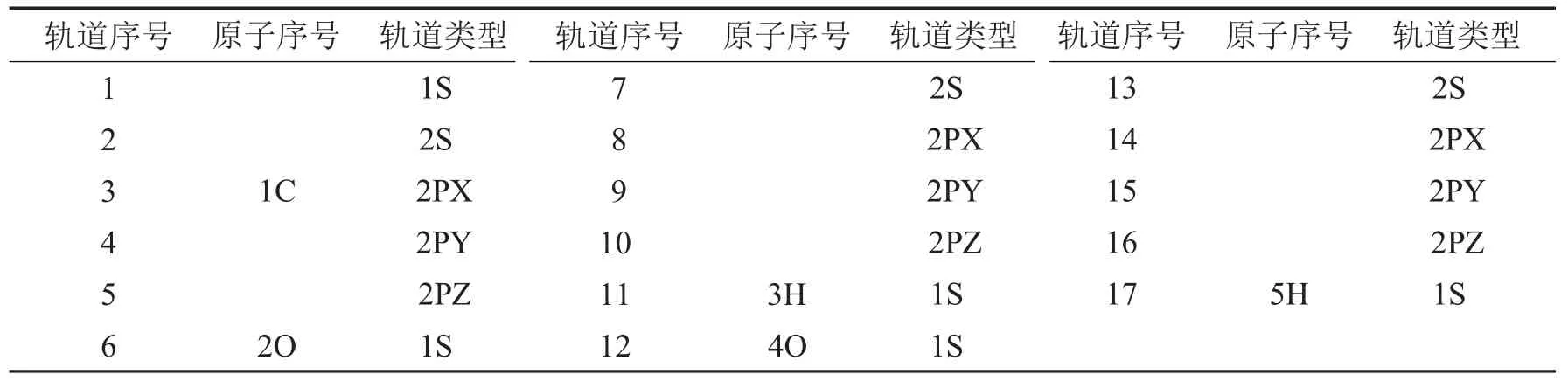
表1 甲酸分子轨道序号及轨道组成Tab.1 The identifying number and the component of the molecular orbitals of formic acid
(2)从乙酸的计算结果文件中提取各个分子轨道的系数,结果见图2、表2.
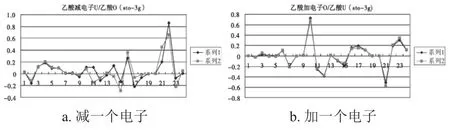
图2 乙酸减或加一个电子后的轨道系数Fig.2 Coefficients of occupied molecular orbitals of the acetic acid
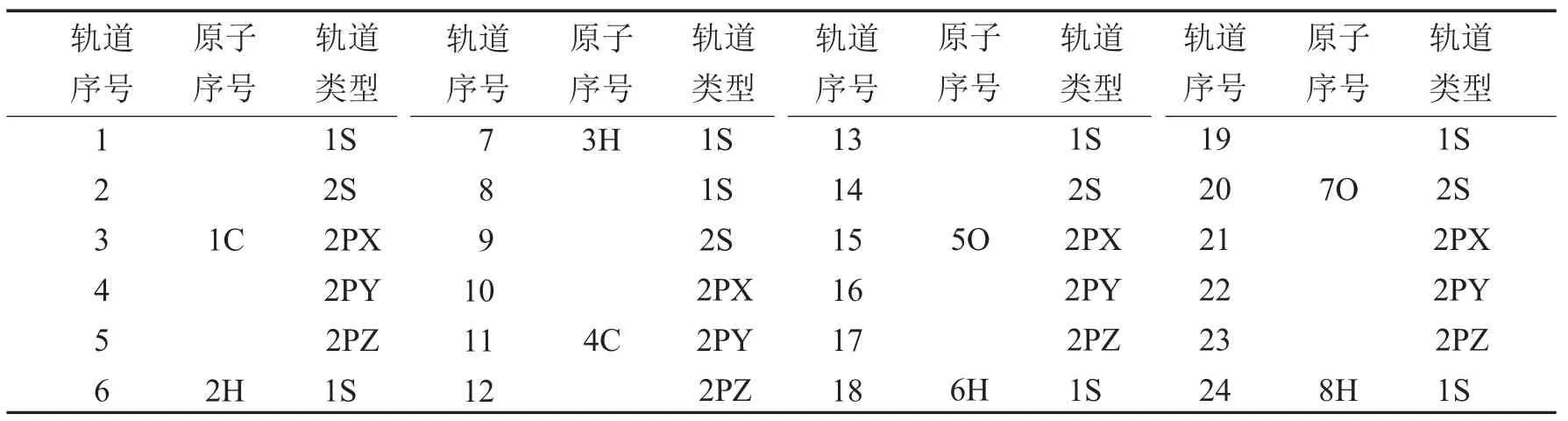
表2 乙酸分子轨道序号及轨道组成Tab.2 The identifying number and the component of the molecular orbitals of acetic acid
(3)丙酸加电子在五号氧原子和七号氧原子附近会出现些差别,主要在2PX、2PY,结果见图3、表3.
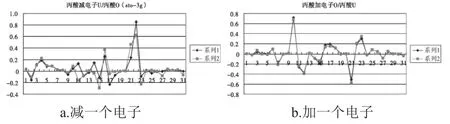
图3 丙酸减或加一个电子后的轨道系数Fig.3 Coefficients of occupied molecular orbitals of the propionic acid
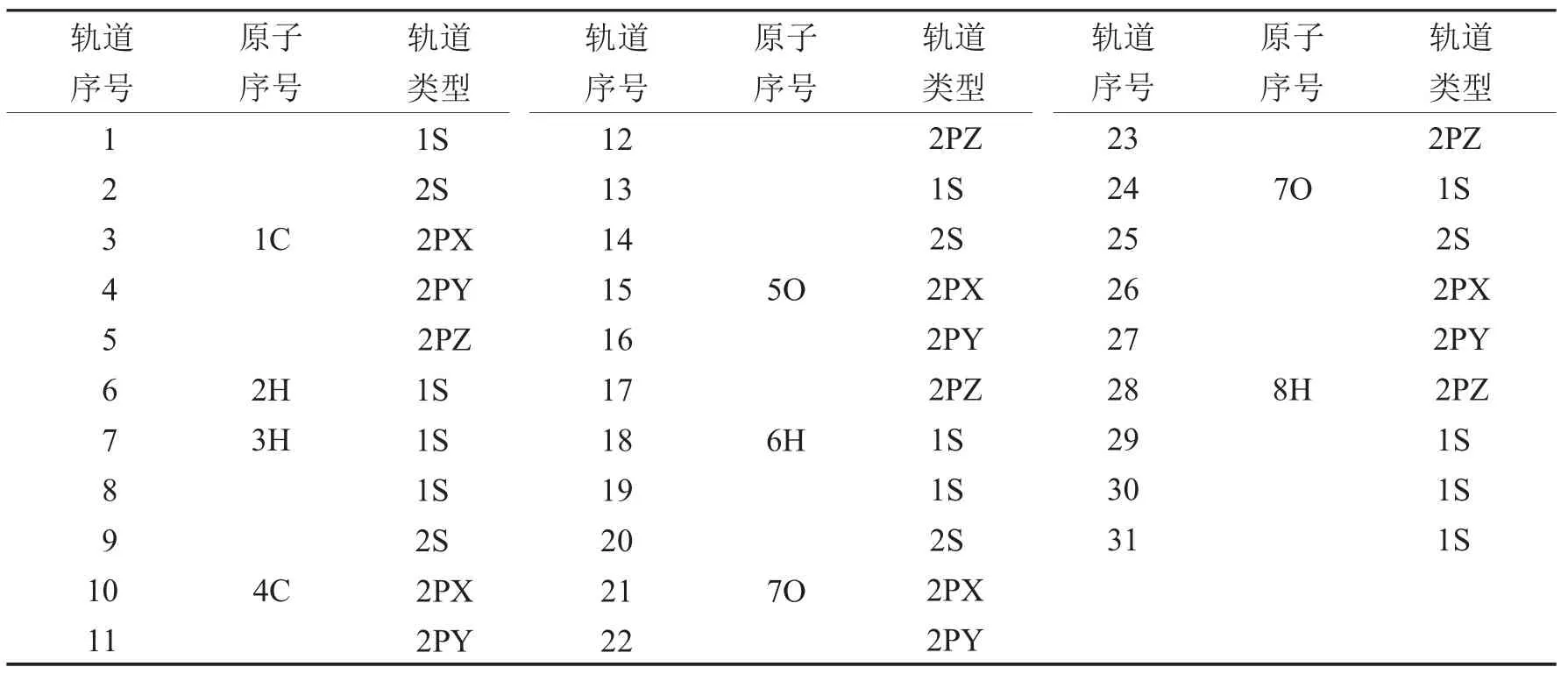
表3 丙酸分子轨道序号及轨道组成Tab.3 The identifying number and the component of the molecular orbitals of propionic acid
由表1~表3及图1~图3的a图可知,从甲酸到丙酸,减一个电子后,甲酸发生变化较大的分子轨道为5号,其对应于1号碳原子的2PZ轨道;7号、9号,对应于2号氧原子的2S和2PY轨道;14号、15号和16号分子轨道,对应于4号氧原子的2PX、2PY和2PZ轨道.这些轨道或者为氧原子的轨道,或者是与氧相连接的原子的轨道.对于乙酸和丙酸可以得到类似的结论.所以从甲酸到丙酸减一个电子应该是从饱和的高位占据轨道上减去的.
由表1~表3及图1~图3的b图可知,从甲酸到丙酸,甲酸加一个电子后,有差别的轨道分布在2号氧原子与4号氧原子的2PY轨道上.乙酸和丙酸加一个电子后,其高位占据轨道与其未加电子之前的低位未占据的轨道曲线基本相似.只是9号,14号,15号,17号,对应的P轨道加电子后会有少许影响,这些轨道都距氧原子较近.由此甲酸到丙酸加电子应该是加到未饱和的低位非占据轨道上.
2.2 丁酸
为了研究更长碳链的变化规律,我们对丁酸和戊酸也进行了研究.从丁酸的计算结果文件中提取各个分子轨道的系数,结果见图4、表4.
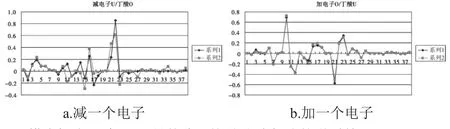
图4 丁酸减或加一个电子后的轨道系数Fig.4 Coefficients of occupied molecular orbitals of the butyric acid
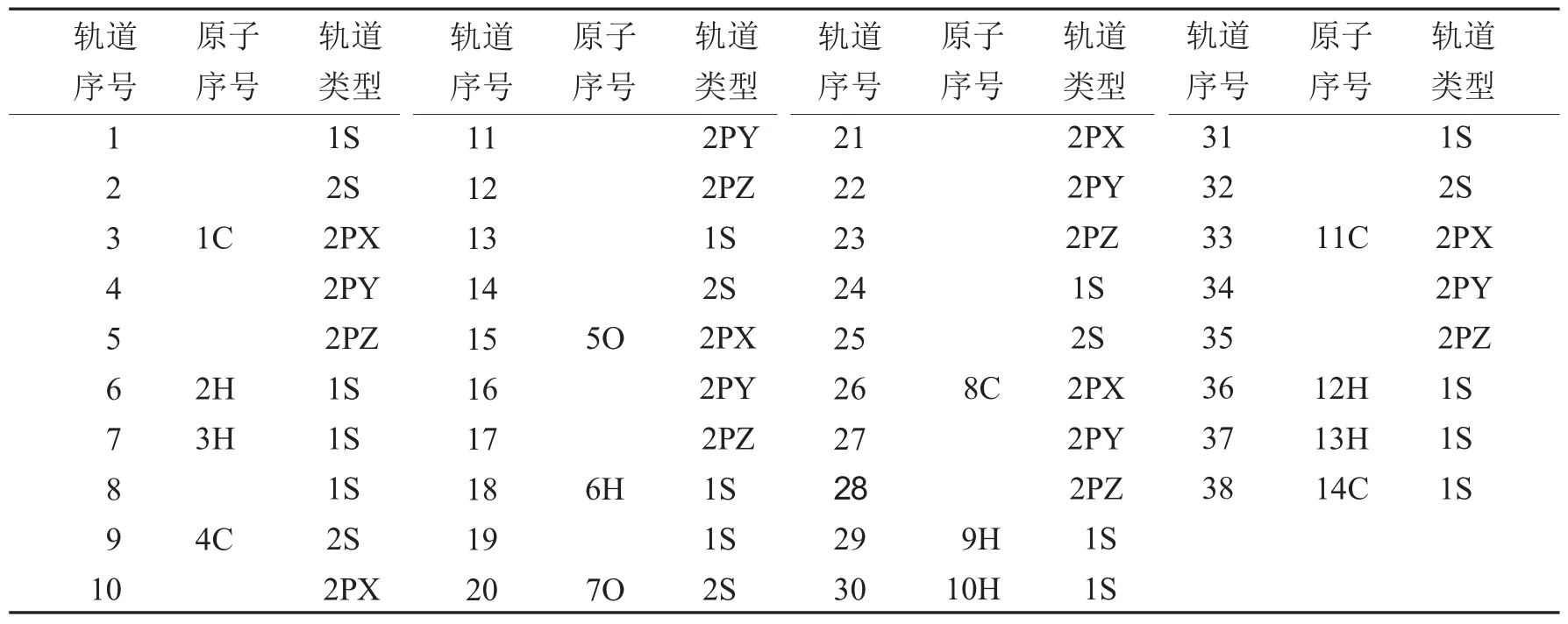
表4 丁酸分子轨道序号及轨道组成Tab.4 The identifying number and the component of the molecular orbitals of butyric acid
由图4及表4我们可以看出,减一个电子后,丁酸其变化较大的分子轨道为11号、14号、17号、22号和23号分子轨道.这几个轨道分布于两个氧原子及与其相连接的碳原子周围.而加一个电子后,其高位占据轨道与其未加电子之前的低位未占据的轨道曲线基本相似.只是17号、21号序列对应的P轨道加电子后会有少许影响,均离氧原子较近,减电子轨道也是大有差别.由此可以得出,丁酸加电子应该是加到未饱和的低位非占据轨道上.即5号氧原子与7号氧原子影响加电子后的轨道分布.
2.3 戊酸
从戊酸的计算结果文件中提取各个分子轨道的系数,结果见图5、表5.
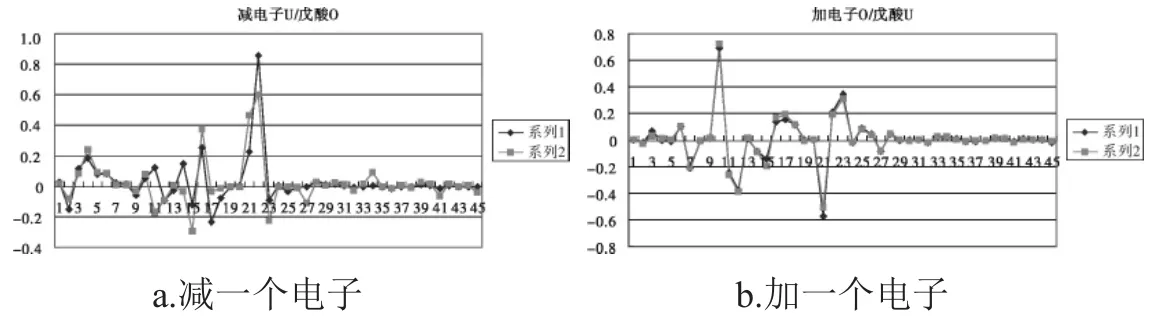
图5 戊酸减或加一个电子后的轨道系数Fig.5 Coefficients of occupied molecular orbitals of the pentanoic acid
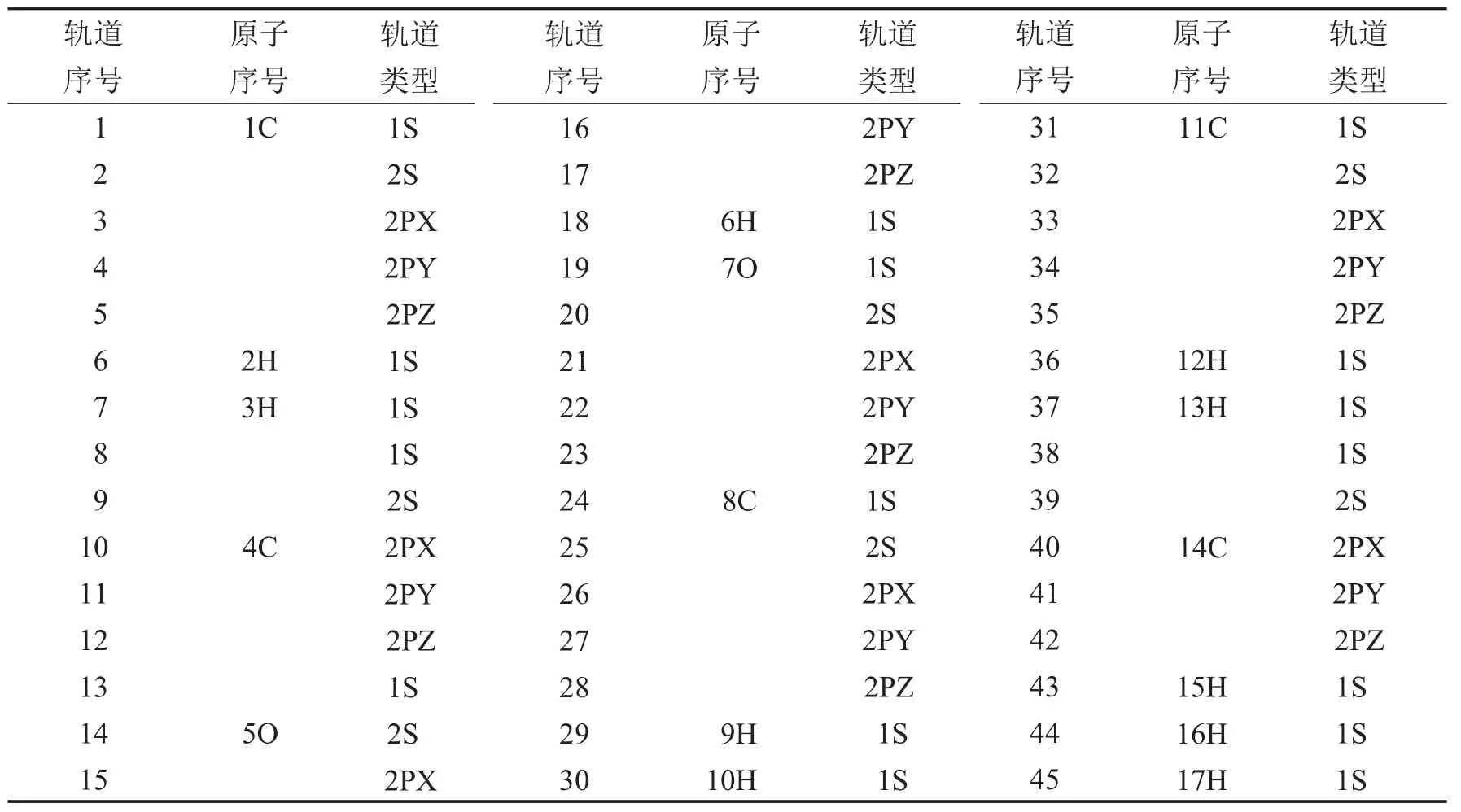
表5 戊酸分子轨道序号及轨道组成Tab.5 The identifying number and the component of the molecular orbitals of pentanoic acid
由图5及表5可以看出,对于戊酸减电子分析中整个曲线观察,基本曲线走势是一样的,但差别还是较大.观察分析知戊酸减电子后在11、14、17、21、22号分子轨道有比较明显得变化.对应原子轨道分别为4号碳原子的2PY,5号碳氧原子2S、2PZ,7号氧原子的2PX、2PY分子轨道.加一个电子后,其高位占据轨道与其未加电子之前的低位未占据的轨道曲线基本相似.只是17号、21号序列对应的P轨道加电子后会有少许影响,均离氧原子较近,在5号氧原子的2PX、2PY、2PZ轨道发生变化.由这两条曲线以及减电子图表分析知戊酸加电子也是加到未饱和的低位非占据轨道上.由此可以推断出对于前五号的脂肪酸类加电子情况符合如下规律:减电子是从最高占据轨道上减去,而加电子加载在最低非占据轨道.
3 结论
本文以甲酸到戊酸为参考体系,利用分子轨道理论,对分子加减电子具体的位置进行了研究.电子总是进入能量低的轨道,此轨道占满后电子进入能量较高的轨道.物质本身的最低非占据轨道与加电子后的最高占据轨道的差别主要发生在所建分子模型的中氧原子的2PX、2PY或2PZ上电子分布的差别,且发现距氧原子较近碳原子轨道分布也会受到一定的细微影响.从甲酸到戊酸,碳原子增多,其差别也会增多,不过一般都是Alpha C与beta C的P轨道受到影响.
[1]唐作华,万家义,毛治华.基础结构化学[M].四川:四川大学出版社,1996.
[2]徐光宪.物质结构[M].北京:高等教育出版社,1959:377.
[3]郭用猷.物质结构[M].北京:高等教育出版社,1985.
[4]杨金田.键级和化合价的分子轨道理论[J].湖州师范学院学报,1990(5):30-35.
[5]Fukui K,Yonezawa T,Shingu H J.Molecular orbital theory of reactivity in aromatic hydrocarbons[J].J.Chem.Phys.,1952,20:722.
[6]Kimura K,Katsumata S,Achiba Y,et al.Handbook of HeI Photoelectron Spectra of Fndamental Organic Molecules[M].Tokyo:Japan Scientific Society,1981.
[7]Frisch MJ,Trucks G W.Gaussian[M].Inc.,Pittsburgh PA,2003.

