钼对小鼠生殖毒性研究
张 才,郝贵增,王亚垒,白 刃,尚泽松,杨自军
(1.河南科技大学动物科技学院,河南洛阳471003;2.安阳工学院生物与食品学院,河南安阳455000;3.沈阳市沈北新区动物卫生管理局,辽宁沈阳110121)
0 前言
钼是动物机体进行正常生命活动不可缺少的必需微量元素之一[1],是动物体内醛氧化酶、亚硫酸氧化酶、黄嘌呤氧化酶等多种酶的活性组分。在人体中,钼缺乏很少见;在动物中,钼缺乏所表现出的症状主要是生长迟缓和生殖障碍[2-3]。与钼缺乏相比,钼中毒更为常见,反刍动物比单胃动物更敏感。1938年,Ferguson首次报道牧草中钼含量过高可使放牧牛产生以剧烈腹泻为特征症状的中毒病,自此人们一直认为钼是有毒物质。中国江西省、陕西省、河南省等地也有钼中毒的报道。直到1953年,Richert等研究证明钼是黄嘌呤氧化酶的组成成分,并与该酶的活性密切相关后,才确认钼是动物营养必需的微量元素。
自然界中钼无处不在,食物和饮水中均能检测出钼。钼在工业生产中的用途十分广泛,电子产品、玻璃、陶瓷、润滑剂的制造,催化剂和颜料的生产,冶金业以及医院化学试剂的使用过程中,都要用到钼[4]。因此,在钼矿附近地区或某些行业中人们可能接触到高浓度的钼。虽然目前还没有关于高钼对人类毒性作用的直接证据,但在最近的研究中发现,血液中钼的浓度与精子密度降低、正常形态数目减少存在相关[3],这一结果与在动物上的研究结果十分接近[5-6]。
为探讨钼暴露对动物的生殖毒性,本文利用毒理学的原理和试验方法,建立小鼠钼暴露模型,通过钼暴露条件下小鼠繁殖试验观察钼对小鼠生殖功能的影响,为探寻高钼对小鼠生殖能力的影响提供基本的试验依据。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
60日龄的清洁级ICR小鼠60只(河南省实验动物中心提供)。
1.1.2 试验日粮配方(质量分数)
玉米27.0%,豆饼16.0%,鱼粉13.0%,钙粉3.0%,骨粉3.0%,维生素0.1%,微量元素0.1%,大米16.0%,食盐0.5%,酵母粉2.3%,麸皮19.0%。
1.1.3 试剂
FSH诊断试剂盒(批号:20081208),雌激素诊断试剂盒(批号:20081106),睾酮诊断试剂盒(批号:20081208)均购自北京泰格科信公司。其他均为普通生化试剂。
1.2 试验方法
1.2.1 试验动物分组与处理
40只雌性和20只雄性小白鼠(60日龄),随机分成4组,每组10只雌性和5只雄性小白鼠,雌雄分笼饲养,自由采食,基础日粮相同,通过在饮水中加入不同剂量的钼(Na2MoO4·2H2O形式)建立试验动物模型:空白对照组、低钼组(100 mg/L)、中钼组(200 mg/L)和高钼组(400 mg/L),4周后雌雄合笼饲养。产仔后从每组仔鼠中随机选取30只雌性小白鼠和15只雄性小白鼠按原分组给予不同剂量的钼,8周后,再从每组中随机选取10只雌性小白鼠和5只雄性小白鼠合笼饲养,测定其产仔数。如此往复,使小鼠繁殖4代,记录分娩率和每胎产仔数。其余小鼠用摘眼球采血法采血后处死,取睾丸和附睾等用于试验指标的测定。
1.2.2 指标测定和方法
小鼠繁殖能力测定:记录每组小鼠的分娩率和每只妊娠小鼠的产仔数。
生精功能检测:(1)睾丸细胞微核的观察:一般采用常规微核实验法[7]。微核率按下式计算:睾丸微核率=(出现微核的睾丸细胞数/检查的睾丸细胞总数)。(2)精子畸形率测定:主要是通过精子的形态观察,计算不正常的精子占总精子数的百分率来判断精液的质量。取小鼠附睾,将其置于1 mL生理盐水中,剪碎,制成精子悬液。经抹片、固定、染色后,将载玻片放在400×的显微镜下进行观察,共记录若干个视野内的精子(每个涂片至少观察200个精子)。下列精子可被视为畸形精子:头部膨大、尾部膨大、双头、双尾、颈部折回、尾部折回、尾部卷曲、断尾、缺头、缺尾等。
1.2.3 血清中性激素水平的测定
采用化学发光免疫分析仪(北京泰格科信MP280 CLIA)测定血清中的性激素水平,具体步骤按说明书进行。
1.3 统计方法
采用SPSS11.5统计软件,计量资料进行单因素方差分析,计数资料进行卡方检验(精确概率法)。
2 结果
2.1 钼对小鼠各代分娩率和产仔数的影响
钼对小鼠各代分娩率和产仔数的影响见表1,F0为第1代,F1为第2代,F2为第3代,F3为第4代。随着小鼠在钼暴露条件下时间的延长,高剂量的钼表现出一定的生殖毒性,F1代小鼠分娩率与其他组相比达到了显著水平(P<0.05),而F2代10只雌鼠全部出现了不孕的现象,小鼠分娩率与其他组相比则达到了极显著水平(P<0.01)。各代小鼠在每胎平均产仔数上差异不显著(P>0.05)。
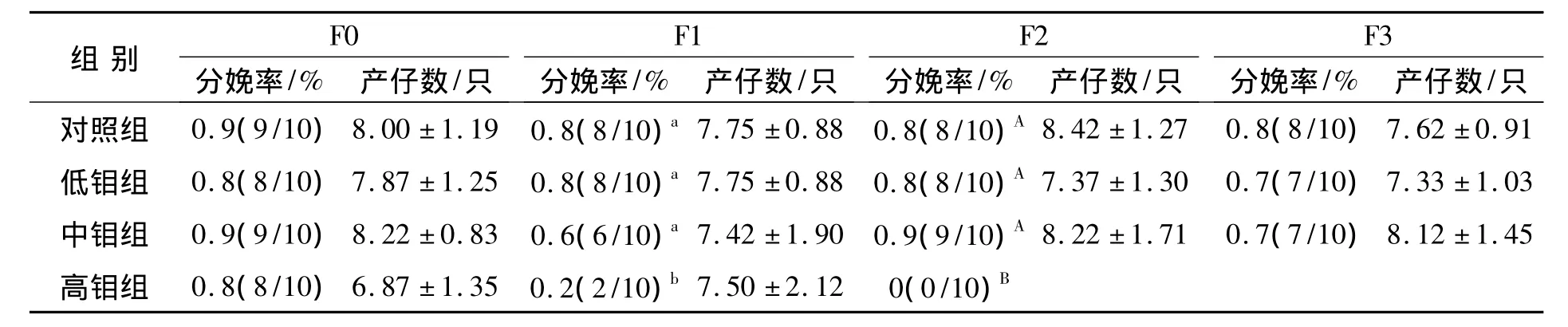
表1 钼对小鼠各代繁殖率和产仔数的影响
2.2 钼对F1代小鼠精液质量的影响
钼对F1代小鼠精液质量的影响见表2,除低钼组外,试验组和对照组相比,F1代小白鼠睾丸细胞微核率有所增高,高钼组小鼠睾丸细胞微核率显著高于对照组(P<0.05)。与对照组相比,随着钼剂量的增加,试验各组小鼠精子畸形率呈上升趋势,至高钼组达到最大值,高钼组与对照组差异显著(P<0.05);试验各组小鼠精子密度逐渐降低,至高钼组达到最小值,高钼组与对照组差异极显著(P<0.01)。
2.3 钼对F1代小鼠生殖激素的影响
钼对F1代小鼠生殖激素的影响见表3,由表3可知:随着钼剂量的增加,雄性小鼠睾酮浓度逐渐降低,至高钼组达到最小值,组间差异显著(P<0.05),钼对雄性小鼠卵泡刺激素的水平影响不明显,而低钼组对雌性小鼠卵泡刺激素有显著的提高作用(P<0.05)。
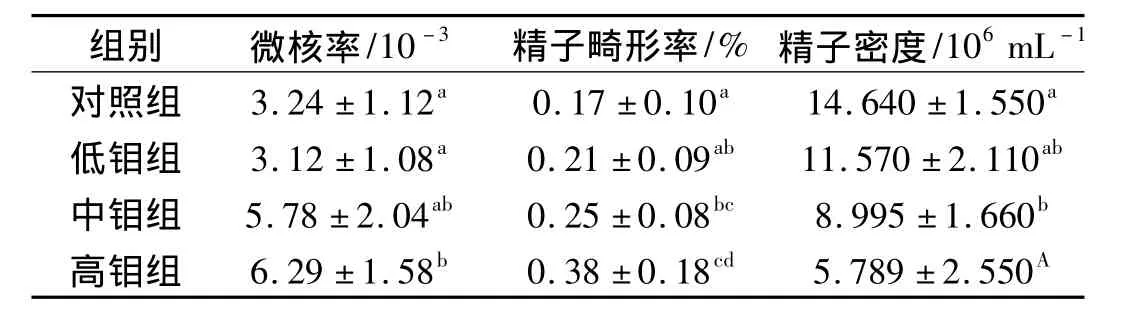
表2 钼对F1代小鼠精液的影响
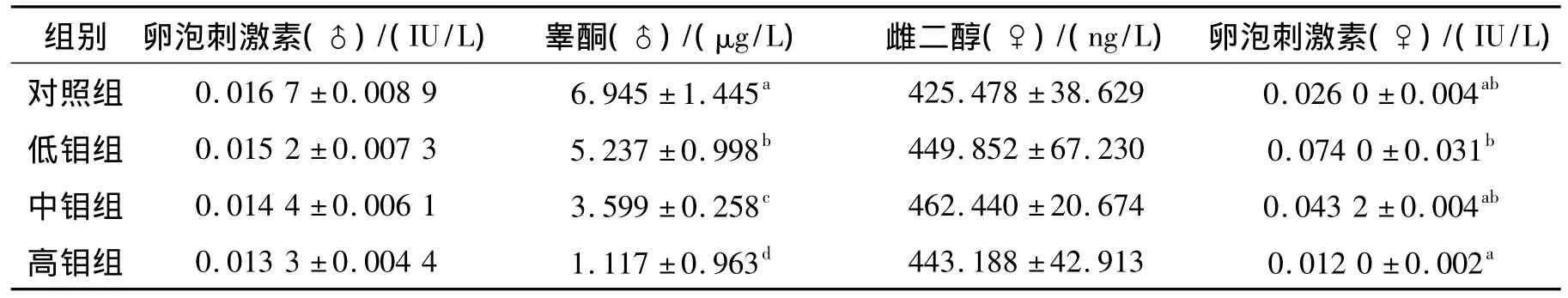
表3 钼对F1代小鼠生殖激素的影响
3 讨论与结论
外源化学物对生殖过程作用的评定主要通过生殖毒性试验来进行。本研究在3代2窝生殖毒性试验的基础上延长了攻毒时间,增加了繁殖代数,这对于研究长期高钼暴露对小鼠的生殖毒性更有借鉴意义。试验结果表明:长期暴露在高钼条件下可导致小鼠后代的繁殖障碍。试验中暴露在400 mg/L饮水条件下的小鼠,当其繁殖到第2窝第3代时,表现出一定繁殖障碍,至第3窝第4代时则出现了全面的繁殖障碍。除了发现高剂量的钼可引起一定的生殖毒性外,文献[9]给小鼠饲喂含10~500 mg/d的钼酸铵饲料232 d,结果观察到了较为明显的中毒体征,文献[10]也观察到40 mg/kg体重饲喂的小鼠可以引起母鼠体重减少,胎鼠体重降低和胎鼠骨骼发育障碍,关节肿胀,变性等中毒体征。这些均未在本试验中观察到,这可能是由于攻毒方式、时间和剂量不同造成的。本试验虽然攻毒时间较长,但攻毒方式为自由饮水,钼的浓度也相对较低,故小鼠实际摄入钼的水平不如前者高。
精子是雄性动物生殖的基础,精子的畸变和数量的降低将极大地降低雄性个体的生殖机能,且具有一定潜在的遗传危害。在试验中发现:随着钼浓度的提高,小鼠睾丸组织细胞的微核率,精子畸形率逐渐提高,高钼组与对照组存在显著差异,同时精子数量逐渐降低。这与文献[5]的研究结果一致。
钼可促进脂质过氧化,且这种促进作用的大小与给钼量(浓度)呈正相关。另外,过量的钼也可抑制超氧化物歧化酶、黄嘌呤氧化酶等相关酶的活性,从而影响细胞的正常代谢[11]。在细胞分裂时细胞代谢异常导致细胞微核率上升,这或许是钼中毒引起小鼠睾丸细胞微核率升高、精子畸形,进而引起精子数量下降的主要原因。
动物生殖系统的发育和功能维持受到下丘脑—垂体—性腺轴的调控,其中生殖激素发挥了十分重要的作用。钼可调控激素水平,文献[12]的研究表明循环血液中睾酮水平与血清钼含量负相关。本试验结果提示高钼不能降低雄性小鼠卵泡刺激素的分泌,但可抑制睾酮的合成,使睾酮水平下降,这可能是由于高钼造成睾丸组织的损伤,进而影响了睾酮的合成。同时,对雌鼠激素水平的检测发现低钼组提高了雌性小鼠卵泡刺激素的水平。提示低浓度的钼能提高雌性小鼠的生殖功能。钼是必需微量元素,其对机体是产生营养作用还是毒性作用的关键是钼的摄入量。
试验表明:高钼暴露具有生殖毒性,长期高钼条件下可导致小鼠分娩率的下降,雄性小鼠精子质量的降低。
[1]杨自军,龙塔,冉林武,等.钼的生物学功能及其在动物生产中的作用[J].河南科技大学学报:自然科学版,2004,24(2):40-42.
[2]Janet A N,Judith R T.Molybdenum Intake Influences Molybdenum Kinetics in Men[J].The American Society for Nutrition J Nutr,2007,137:37-42.
[3]John D M,Mary G R,Bridget P,et al.Cadmium,Lead,and Other Metals in Relation to Semen Quality:Human Evidence for Molybdenum as a Male Reproductive Toxicant[J].Environ Health Perspect,2008,116(11):1473-1479.
[4]CDC.Third National Report on Human Exposure to Environmental Chemicals[R].Washington DC:Centers for Disease Control and Prevention,2005.
[5]Ratna P,Singh S P.Effects of Molybdenum on Fertility of Male Rats[J].BioMetals,2002,15:65-72.
[6]Lyubimov A V,Smith J A,Rousselle S D,et al.The Effects of Tetrathiomolybdate(TTM,NSC-714598)and Copper Supplementation on Fertility and Early Embryonic Development in Rats[J].Reprod Toxicol,2004,19:223-233.
[7]张才,朱重伟,王宏伟,等.钼及钼铜联合对小鼠肝脏、肾脏、睾丸细胞微核率的影响[J].饲料工业,2011,32(11):17-20.
[8]袁志发,周静芋.试验设计与分析[M].北京:高等教育出版社,2000.
[9]Fairhall L T,Dunn R R C,Sharpless N E,et al.The Toxicity of Molybdenum[J].Public Health Bulletin,1945,293(1):36.
[10]孙素玲,刘明明,后家蘅.钼对大鼠致畸和致突变作用的研究[J].癌变.畸变.突变,2007,1(3):250-252.
[11]杨帆,崔恒敏,肖杰.高钼对艾维茵肉鸡法氏囊细胞周期和凋亡影响分析[J].畜牧兽医学报,2010,41(8):1031-1038.
[12]John D M,Sc D,Mary G R,et al.Environmental Exposure to Metals and Male Reproductive Hormones:Circulating Testosterone is Inversely Associated with Blood Molybdenum[J].Fertility and Sterility,2010,27(3):285-289.

