ATG联合环孢素A治疗重型再生障碍性贫血近期疗效分析
杨 岩,王晓萌,林 海,李 薇,石秀敏,孙京男
(吉林大学第一医院血液肿瘤中心,吉林 长春130021)
重型再生障碍性贫血(severe aplastic anemia,SAA)病情凶险,进展快,病死率高,需尽早治疗。异基因造血干细胞移植和免疫抑制剂治疗是目前治疗的两种主要手段,对于年龄大于40岁或是不论年龄大小无HLA匹配的同胞供者,首选免疫抑制剂治疗(immunosuppressive therapy,IST)[1]。T细胞介导的免疫机制异常在再生障碍性贫血 (AA)的发病机制中占有主要地位。抗人胸腺细胞球蛋白(anti-thymocyte globulin,ATG)是一种高效价抗人T淋巴细胞免疫球蛋白制剂,用人体Jurkat细胞系的T淋巴母细胞免疫兔/马获得抗血清经分离而成,是一种抗T淋巴细胞的多克隆抗体溶液,输注后引起T淋巴细胞衰竭,故具有免疫抑制活性。ATG联合环孢素A (cyclosporin A,CsA)被认为是治疗SAA的标准IST方案。本文作者总结2009年12月—2011年5月就诊于吉林大学第一医院血液肿瘤中心,并接受ATG联合CsA治疗的SAA患者15例,观察其治疗后临床表现的改善、外周血象和骨髓象的变化,以及用药期间的不良反应,旨在对联合免疫抑制剂治疗SAA的疗效做出初步评价,并分析影响疗效及预后的相关因素,为临床使用ATG联合CsA治疗SAA提供更多的经验。
1 资料与方法
1.1 临床资料接受ATG联合CsA免疫治疗的SAA患者共15例,其中男性6例,女性9例,年龄6~62岁,中位年龄24岁。诊断均排除阵发性睡眠性血红蛋白尿、骨髓增生异常综合征、急性造血停滞,符合SAA的诊断标准[2],并将其中中性粒细胞绝对值(NE#)<0.2×10 L-1者诊断为极重型再生障碍性贫血(VSAA)。
1.2 治疗方案所有患者明确诊断后,需在无感染,或感染得到控制,体温恢复正常至少5 d后;血红蛋白(Hb)≥80 g·L-1,血小板(PLT)≥20×109L-1;行锁骨下静脉穿刺插管、理发、药浴后进入层流病房,然后接受IST。
1.3 IST方案所有患者均联合应用兔ATG (法国Sanstat公司)和新山地明胶囊(CsA,北京诺华公司)。使用方法:ATG 3 mg·kg-1·d-1,共5 d,缓慢静脉输注,持续12~16 h。为防治急性过敏反应及血清病反应,第1天使用ATG必须做过敏试验。CsA自第16天始用,以3~5 mg·kg-1·d-1剂量起始。服药2周后检测CsA血药浓度,调整用药剂量,使CsA血清谷浓度维持在150~250 μg·L-1,儿童为100~150 μg·L-1,峰浓度200~400 μg·L-1。ATG治疗后1~5 d开始应用粒细胞集落刺激因子(G-CSF,金磊赛强或惠尔血)150~300 μg·d-1;促红细胞生成素(EPO)1万U,隔日1次;白细胞介素11(IL-11) 1.5~3.0 mg·d-1;1~2个月后,视血象恢复情况停用造血生长因子。
1.4 疗效观察①血常规回升时间及幅度;②骨髓造血功能恢复情况;③血制品输注间隔时间。
1.5 疗效判定标准ATG联合CsA治疗4个月后评估疗效,疗效评定采用以下标准[3]:完全治疗反应(CR),部分治疗反应(PR),无治疗反应(NR),CR+PR为治疗有效。治疗后3个月内死亡为早期死亡,纳入治疗相关不良反应分析。
1.6 统计学分析采用SPSS 13.0统计软件进行统计分析,四格表资料采用Fisher 精确概率检验。
2 结 果
2.1 总体疗效随访15例SAA患者,中位随访时间 9个月,其中5例因随访未超过4个月,尚未能进行疗效评价。其余10例患者中,CR 4例(40%),PR 4例(40%),总有效率为80.0%,1例无效(10%),1例(10%)在接受ATG治疗40 d后因严重感染(败血症并发肺部真菌感染)早期死亡。单因素分析结果显示:性别、年龄、疾病严重程度、疾病诊断到接受ATG治疗时间间隔、初诊时网织红细胞计数、治疗并发严重感染及既往肝炎感染史等情况均与疗效无关。见表1。
2.2 血象恢复情况有效病例在ATG联合CsA治疗后1~2个月内临床症状改善;患者外周血象变化:1个月后首先出现白细胞及中性粒细胞绝对值回升,血红蛋白的回升多在2个月以后,血小板回升最慢,但在治疗3~4个月左右血小板数量多可保持稳定状态。ATG治疗后4个月内,治疗有效的8例患者群体血象变化见表2。
2.3 不良反应目前观察到的主要不良反应如下:① 感染。15例患者接受ATG治疗后间歇1个月内,共有6例(40%)发生不同程度的感染,其中上呼吸道感染1例,透壁性腹膜炎并发败血症1例,真菌性肺炎并发败血症2例,败血症2例;②过敏反应。静脉输注ATG期间共有4例发生急性过敏反应,其中1例出现休克,15例患者均完成5 d ATG给药,4例发生血清病反应,过敏反应发生率为53%;③ 心血管系统疾病。共3例出现心律失常;④ 电解质紊乱。共发生4 例,均为低钾、低钠及低钙血症。

表1 10例SAA患者ATG疗效的单因素分析
3 讨 论
德国的一项前瞻性随机研究[4]证实:与单独使用ATG相比,ATG联合CsA能有效提高初次治疗反应率,提高治疗后前3个月内的外周血细胞数值,从而缩短严重全血细胞减少的时间,降低二次使用ATG挽救治疗的可能性,故ATG和CsA被认为是IST的基础用药。ATG联合CsA治疗可发挥各药物的协同作用,同时有效降低不良反应的发生率。目前,对于首次IST治疗后多久判定疗效尚无定论。国外一项多中心研究[5]对初次接受IST患者观察1年以上,仅少数患者治疗反应延迟至4个月后,故建议4个月时应就是否进行解救或替代治疗作出决策。通过观察本组8例有效患者发现:通常在治疗后1~2个月可观察到病情的好转,白细胞首先升高,2~3月逐渐脱离血制品输注,此时血红蛋白与血小板逐渐稳定,并缓慢回升,但也有血红蛋白及血小板恢复较晚者,于ATG治疗4个月后才出现此两系细胞的稳定和回升,这与文献报道[5]一致。有效者应继续服用CsA,并逐渐减量至可维持满意血细胞水平的最小剂量,早期或骤然停用CsA可致病情加重或反复[6]。此外,IST联合重组人粒细胞集落刺激因子(rhG-CSF)的疗效尚未得到证实。有文献[7]报道:在ATG治疗后加用rhG-CSF虽然对患者的总体生存期及无疾病生存期无显著疗效,但能降低感染发生率,减少住院时间,从而提高生存质量。1ST虽取得良好的治疗反应,但仍有约30%的SAA患者接受IST后无效,这类患者感染风险增加,死亡率高。因此如何有效预测IST疗效反应,从而降低治疗的被动性和盲目性成为目前研究的热点。本文作者对10例已到评估时间的患者进行了单因素分析对比,结果显示:性别、年龄、疾病严重程度、疾病诊断到接受ATG治疗时间间隔、初诊时网织红细胞计数、治疗并发严重感染及既往肝炎感染史等情况均与疗效无关,与文献报道不尽相同,可能与本组病例数偏少有关。因此,医务工作者还需要进一步加强基础研究与疗效分析的互相配合,更多地加入到跨地域、多中心的合作中,从而给予规范化治疗,使SAA患者获得最佳疗效。
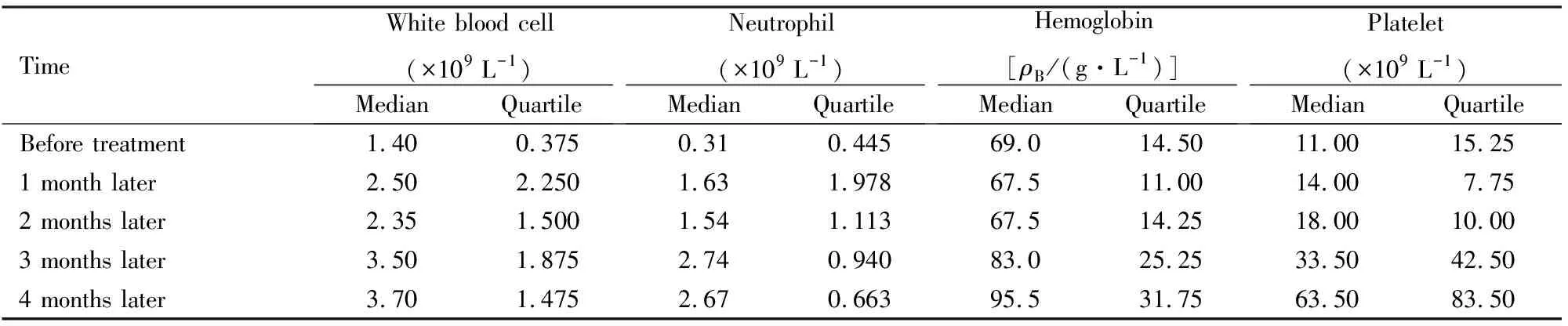
表2 8例治疗有效患者ATG治疗前及治疗后4个月内血象变化
[参考文献]
[1]Young NS,Bacigalupo A,Marsh JC.Aplastic anemia: pathophysiology and treatment[J].Biol Blood Marrow Transplant,2010,16(1):119-125.
[2]中华医学会血液学分会红细胞疾病(贫血)学组.再生障碍性贫血诊断治疗专家共识[J].中华血液学杂志,2010,31(11):790-792.
[3]英国血液病学标准委员会.获得性再生障碍性贫血诊治指南[J].国外医学:输血及血液学分册,2005,28(1):97-107.
[4]Frickhofen N,Rosenfeld SJ.Immunosuppressive therapy of aplastic anaemia with antithymocyte globulin and cyclosporine[J].Semin Haematol,2000,37(1):56-68.
[5]Frickhofen N,Heimpel H,Kaltwasser JP,et al.Antithymocyte globulin with or without cyclosporin A: 11-year follow-up of a randomized trial comparing treatments of aplastic anemia[J].Blood,2003,101(4):1236-1242.
[6]Saracco P,Quarello P,Iori AP,et al.Cyclosporin A response and dependence in children with acquired aplastic anemia:a multicenter retrospective study with long-term observation follow up[J].Br J Haematol,2008,140(2):197-205.
[7]Tichelli A,Schrezenmeier H,Socié G,et al.A randomized controlled study in patients with newly diagnosed severe aplastic anemia receiving antithymocyte globulin (ATG),cyclosporine,with or without G-CSF: a study of the SAA Working Party of the European Group for Blood and Marrow Transplantation[J].Blood,2011,117(17):4434-4441.

