电纺纳米银/碳纳米纤维敷料的制备及抗菌效果评价
徐亚飞,关宏宇,杨姗姗,牛震海,荣兰香,于家傲
(1.吉林大学第一医院二部烧伤外科,吉林 长春 130031;2.东北师范大学化学学院,吉林 长春 130024)
烧伤创面敷料为创面愈合提供最佳的微环境,对于创面愈合起着至关重要的作用。虽然许多伤口敷料已应用于临床实践中,但很少有伤口敷料可以充分满足创面愈合的多项要求。对于良好的烧伤敷料来说,如何防止创面感染、促进创面愈合是其需要解决的关键问题。静电纺丝技术(以下称电纺)制备的纳米纤维支架具有与天然细胞外基质(ECM)相似的形态特点:连续超细纤维、高表面体积比、高孔隙率和可变孔径分布[1],经实验证实其可以刺激细胞合成多种细胞因子和生长因子,促进细胞生长及创面愈合[2]。但单纯的电纺纤维难以具有较好的抑菌能力。选择适当的抗菌药物,与电纺纤维敷料结合可能制造出较理想的烧伤创面敷料。在抗菌药物的选择上,纳米银因其具有较好的抑菌能力,且其耐药性、安全性及过敏性等较好,现已被应用于多种药物及创面敷料中[3-5]。本研究采用聚丙烯腈(polyacrylonitrile,PAN)为前躯体高分子,利用电纺技术及银镜反应制备纳米银/碳纳米纤维复合敷料(以下称复合纤维敷料),观察其体外抑菌能力,旨在进一步探索理想烧伤创面敷料的研制。
1 材料与方法
1.1 碳纤维的制备过程
1.1.1 PAN纳米纤维的制备 首先称取3 g的PAN粉末(Mw=100 000),在磁力搅拌情况下,缓慢加入到N,N-二甲基甲酰胺(DMF)20 mL中,经过大约6 h的搅拌,直至溶液变成澄清透明的溶液。将配制好的纺丝溶液转移到1个带有12号不锈钢针头的20 mL注射器中,1张20 cm×20 cm薄的铝箔纸平铺于一段接地的金属导电板上,不锈钢针头与高压静电电源 (ES30P-5W,大连高电压研究有限公司) 相连接,电源可以产生0~60 RV的直流高压电。在实验过程中,使用15 kV作为纺丝电压,针头和接收板的距离大约15 cm。整个电纺过程在室温条件下操作,纤维丝落到旋转的接收鼓上。见图1。
1.1.2 碳纳米纤维的制备 将制备好的PAN纳米纤维放入管式炉中,经过预氧化、高温热裂解,PAN纤维发生中温碳化和900℃以上的高温碳化,形成网状碳纤维结构。在预氧化过程中,室温以1℃·min-1的速率升到270°C,然后保持2 h。PAN纳米纤维的预氧化过程中腈基聚合形成网结构,这种结构就是热稳定性好的梯形结构,使其在碳化过程中不会熔融。预氧化结束后,进行高温热裂解,在高纯氮气的保护下,从预氧化的最终温度270°C,以5℃·min-1的速率升至900℃,然后在氮气保护下,自然冷却到室温。
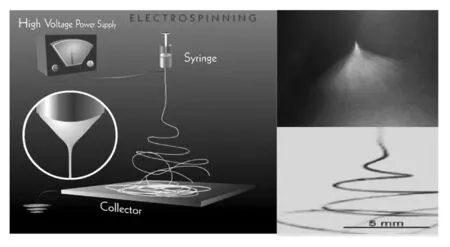
图1 纳米PAN纤维电纺示意图
1.1.3 碳纤维负载纳米银 将制备的碳纳米纤维转移到0.1 mol·L-1Ag(NH3)220 mL+0.4 mol·L-1CH3CHO 1 mL的银镜反应溶液中,在环境温度下,放置24 h后得到复合纤维敷料。
1.2 复合纤维敷料抗菌性实验
1.2.1 标准菌群及主要试剂 金黄色葡萄球菌(ATCC 25923)、大肠埃希菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853);营养琼脂培养,水解酪蛋白琼脂培养基,磷酸缓冲液(PBS,0.03 mol·L-1,pH 7.2)。以上材料均由吉林大学第一医院二部微生物实验室提供。
1.2.2 实验分组 ①复合纤维敷料组;②纳米碳纤维敷料组;③标准庆大霉素纸片组,由吉林大学第一医院二部微生物实验室提供;④优拓(urgotul,SSD)组,Laboratoires Urgo公司生产的烧伤、感染伤口的专用敷料。
1.2.3 实验菌株培养 复苏实验室冻干标准菌株金黄色葡萄球菌 (ATCC 25923)、大肠埃希菌(ATCC 25922)及铜绿假单胞菌(ATCC 27853),接种于普通琼脂培养基平板,37℃培养24 h备用。
1.2.4 抑菌环实验法 将制备好的纳米碳纤维、复合纤维敷料、庆大霉素及优拓抑菌纸片剪裁成直径6 mm大小的圆片,每组9个,采用K-B纸片扩散法进行检测,细菌浓度0.5麦氏单位。检测中使用肉汤培养基,因为此种培养基及pH值固定,琼脂板厚度4 mm,可确保相同菌群检测的可重复性。
1.2.5 观察指标 抑菌环直径>7 mm为有抑菌作用,抑菌环直径≤7 mm时,为无抑菌作用。3次重复实验均有抑菌作用结果为合格。
1.3 统计学分析

2 结 果
2.1 样品的形貌表征
经扫描电镜观察:制备的纯碳纳米纤维的直径约为200 nm,纤维比较直,纤维之间分立的比较好,表面比较光滑(图2A)。通过室温下的银镜反应,纤维的直径有些变粗,约230 nm,并且纤维表面变得粗糙。EDX能谱分析显示:碳纤维的表面覆盖了一层银纳米颗粒(图2B)。

图2 碳纳米纤维(A)和银修饰的碳纳米纤维(B)
2.2 抑菌实验
实验通过K-B纸片扩散法证实:①复合纤维敷料和优拓对金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌标准菌株均有较好的抑菌效果,但低于标准抗菌药物庆大霉素药敏纸片组(其抑菌环直径均>7 mm),同庆大霉素标准纸片组比较差异有统计学意义(P<0.05)。②复合纤维敷料对于金黄色葡萄球菌及铜绿假单胞菌抑菌效果优于优拓,复合纤维敷料对2种细菌抑菌环直径平均值分别为14.12和15.64 mm,优拓抑菌环直径分别为8.36和8.45 mm,组间比较差异有统计学意义(P<0.05);但其对大肠杆菌的抑制效果低于优拓,复合纤维敷料对大肠杆菌抑菌环直径平均值为9.11 mm,优拓抑菌环直径为12.27 mm,组间比较差异有统计学意义(P<0.05)。③碳纳米纤维组在此实验中未显示出具有抑菌能力(其抑菌环直径均<7 mm)。见图3(插页三)和表1。
3 讨 论
ECM的重要特点是由纳米级大小的纤维蛋白构成的纤维多孔网状结构,其对于诱导细胞的正常行为及器官的生长发育十分重要[6]。由于电纺制备的纳米纤维网状结构与天然ECM网状结构相似,并且其高比表面积和高孔隙率能够更加有利于创面的正常代谢,能提供近似的细胞生长微环境,从而使创面敷料具有良好的促进皮肤细胞生长及创面愈合的作用。碳纤维敷料因其具有良好的吸水性,无细胞毒性、无刺激、无致敏及抗炎的特点逐渐应用于烧伤创面[7]。相关实验[8]证实:碳纳米纤维具有较好的组织相容性。纳米银具有较好的抑菌效果,且在耐药性、安全性、过敏性等方面优于传统的磺胺嘧啶银[9]。纳米银敷料比磺胺嘧啶银缺少了磺胺嘧啶的协同作用,其理化性质发生了很大改变,由于纳米银的颗粒非常小,所以使用与磺胺嘧啶银同等量银时,其颗粒接触面扩大,杀菌作用明显增强[9]。纳米银的抗菌机理尚未完全明确,现在研究多认为:一方面银离子破坏细胞膜,造成细胞内液外漏杀伤细菌[10];另一方面通过影响细菌体内的DNA复制使细菌繁殖受到抑制[11]。另外,Shin等[12]研究显示:浓度为1~5 ppm的纳米银有利于外周血单核细胞的贴壁与增殖。

表1 各组的抑菌实验结果
电纺技术在喷头及接收板之间形成强大电场,这样不断喷出的纤维丝因其带电荷分子的不同,造成纤维丝不确定摆动,自发形成层层交叠的纤维膜。在制备过程中纤维直径可通过改变电场电压进行控制。本实验通过电纺技术制备出大小为200~300 nm的PAN纤维,通过电纺本身层层交叠的特点,形成纳米级支架结构。经过高温碳化后,在不破坏其纳米结构的基础上形成具有较好组织相容性的纳米碳纤维,使敷料具有模拟ECM促进创面愈合的能力。通过银镜反应使纳米银负载于碳纤维后,制备出的复合纤维敷料经体外抑菌实验证实:其对铜金黄色葡萄球菌、大肠杆菌及绿假单胞菌均有较好抑制能力,但碳纤维本身不具有抗菌能力,说明复合纤维敷料的抑菌能力为负载的纳米银所致;本实验结果显示:复合纤维敷料对铜绿假单胞菌及金黄色葡萄球菌的抑制效果优于大肠杆菌,这也与陈美婉等[13]的研究结果相似。同时实验中复合纤维敷料与优拓进行对比研究显示:纳米银对大肠杆菌的抑制效果较差,这可能与磺胺药物对大肠杆菌具有较好的抑制作用有关。
本实验中复合纤维敷料的优点:①纳米级纤维支架结构使敷料具有模拟ECM促进创面愈合的能力;②对铜金黄色葡萄球菌、大肠杆菌及绿假单胞菌均具有较好的抑制效果;③因为纳米纤维层层交叠后,敷料空洞明显小于细菌直径,可起到有效隔离外界细菌污染的作用。其缺点:①纤维材料较脆,难以良好地贴合创面;②材料制备复杂,难以大量生产。未来实验需要解决的问题:①本次抑菌实验时间较短,碳/纳米银纤维是否在较长时间内(期望为1周)均具有较好的抑菌效能,尚需大样本长时间的实验研究;②烧伤创面每次换药都会伴随着剧烈的疼痛,碳/纳米银纤维在创面应用中是否具有较好不粘性尚待验证。
综上所述,本研究构建的复合纤维敷料具有类似于ECM的纳米级多孔网状结构,并有较好的抑菌能力,该材料的制备为理想烧伤创面敷料的研究提供了新的思路。
[参考文献]
[1]Kumbar SG,James R,Nukavarapu SP,et a1.Electrospun nanofiber scaffolds:engineering soft tissues[J].Biomed Mater,2008,3(3):1-15.
[2]Meng H,Chen LY,Ye ZY,et a1.The effect of a self-assembling peptide nanofiber scaffold (peptide) when used as a wound dressing for the treatment of deep second degree burns in rats[J].J Biomed Mater Res B Appl Biomater,2009,89(2): 379-391.
[3]何 红,鲁双云,张 逸,等.纳米银仿生敷料研制及使用效果评价[J].中国公共卫生,2008,24(2):212-213.
[4]Lu SY,Gao WJ,Gu HY.Construction,application and biosafety of silver nanocrystalline chitosen wound dressing[J].Burns,2009,34(5):623-628.
[5]黄桂娟,景红霞,夏栋林,等.纳米银猪脱细胞真皮敷料的细胞毒性评估[J].中国组织工程研究与临床康复,2010,14(25):4607-4610.
[6]孟 洁,孔 桦,朱广瑾,等.纳米纤维结构支架及其对再生医学的意义[J].基础医学与临床,2006,26(7):689-693.
[7]李立根,柴家科,郭振荣,等.碳纤维敷料在烧伤创面的应用[J].中华外科杂志,2006,44(15):1047-1049.
[8]Yang L,Zhang LJ,Webster TJ.Carbon nanostructures for orthopedic medical applications[J].Nanomedicine,2011,6(7):1231-1244.
[9]陈 炯,韩春茂,林小玮,等.纳米银敷料在修复Ⅱ度烧伤创面的应用研究[J].中华外科杂志,2006,44(1):50-52.
[10]Amro NA,Kotra LP,Wadu-Mesthrige K,et a1.High-resolution atomic force microscopy studies of theEscherichiacoliouter membrane:structural basis for permeability[J].Langmuir,2000,16(6):2789-2796.
[11]谢小保,李文茹,曾 海,等.纳米银对大肠杆菌的抗茵作用及其机制[J].材料工程,2008(10):106-109.
[12]Shin SH,Ye MK,Kim HS,et al.The effects of nano-silver on the profileration and cytokine expression by peripheral blood mononuclear cells[J].Int Immunopharmacol,2007,7(13):1813-1818.
[13]陈美婉,吴红梅,刘长秀,等.不同纳米银制剂抑菌作用的实验研究[J].中国消毒学杂志,2009,26(2):132-134.

