低剂量氢醌对大鼠骨髓间充质干细胞生物学性状及PARP-1表达的影响
高羽亭,刘林华,黄明元,梁海荣,范洪学,唐焕文
(1.吉林大学公共卫生学院卫生毒理学教研室,吉林 长春 130021;2.广东医学院公共卫生学院劳动卫生与环境卫生教研室,广东 东莞 523808;3.广东医学院公共卫生学院实验中心,广东 东莞 523808)
苯虽被列为确定的人类致癌物已近30年,但其仍是工业生产中重要的化工原料和溶剂。氢醌(HQ)是苯在生物体内重要的中间代谢产物,流行病学及动物实验发现:HQ慢性毒性作用靶器官为骨髓,而骨髓分为造血和基质两大系统[1]。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)作为多种骨髓基质细胞的前体细胞是造血微环境的重要组成部分,是维持造血干细胞特性及归巢到骨髓所必需的[2]。聚腺苷二磷酸核糖聚合酶-1[poly(ADP-ribose)polymerase-1,PARP-1]是DNA损伤引起的细胞早期应激反应的重要因子,参与许多重要的生命活动,如凋亡、转录、DNA修复、细胞死亡、染色体功能、基因组完整性和DNA甲基化等[3]。以往对HQ毒性效应的体外研究多选用肝细胞或动物的单核细胞,这些细胞与人骨髓中细胞的生物学特性有较大差异,不能反映HQ对靶器官的毒性作用,且主要研究高剂量HQ的毒效应[4-5]。本研究采用大鼠BMSCs为研究模型,探讨低剂量HQ对BMSCs生物学性状及PARP-1基因表达的影响,旨在阐明实际接触水平下HQ对骨髓的毒效应,目前国内外无相关报道。
1 材料与方法
1.1 主要试剂
低糖DMEM培养基(Gibco,美国);胎牛血清(四季青,杭州);HQ(Sigma,美国);Annexin V-FITC细胞凋亡检测试剂盒(凯基,南京);Trizol Reagent(Invitrogen,美国);逆转录试剂盒(Fementas,立陶宛);荧光定量聚合酶链反应(PCR)试剂盒(Roche,德国);Cell Counting Kit-8试剂盒(Dojindo,日本)。
1.2 大鼠BMSCs的分离与培养
选用7 d龄Wistar乳鼠(购自南方医科大学动物研究所,SPF级,体质量约8~10 g,合格证号SCXK粤2009-0011),颈椎脱臼法处死,无菌条件下分离股骨,去除骨两端,用5 mL低糖DMEM培养基,冲出骨髓于培养皿内,收集细胞,吹打制成细胞悬液,用200目过滤网过滤为单细胞悬液。以1×105L-1接种于100 mL培养瓶中,37 ℃、5%CO2饱和湿度孵箱培养,约8~9 d细胞接近融合时,以质量分数为0.25%胰蛋白酶消化1~2 min,用血清终止消化。反复吹打瓶壁,制成单细胞悬液,按1.5×104mL-1传代,每次传代严格控制酶的量和消化时间,利用其易脱落的特点纯化。第3代以后的细胞用于转染实验。
1.3 HQ染毒剂量的选择
细胞按1×104/孔的密度接种于96孔板,待细胞贴壁后,用磷酸盐缓冲液(PBS)将HQ配制成系列终浓度(2.5、5.0、10.0、20.0、40.0、80.0、160.0和320.0 μmol·L-1)进行染毒,100 μL/孔,每个剂量设5个复孔,同时设PBS对照组。分别在24、48及72 h后用Cell Counting Kit-8试剂盒检测,以细胞活力在75%以上为原则来选择HQ剂量。
1.4 细胞活力及细胞增殖实验
细胞按1×104/孔的密度接种于96孔板,待细胞贴壁后,用PBS将HQ配制成系列终浓度(2.5、5.0和10.0 μmol·L-1)进行染毒,100 μL/孔,每个剂量设5个复孔,同时设PBS对照组和未染毒正常细胞对照组,即空白组。分别作用24、48和72 h后,每孔加10 μL Cell Counting Kit-8试剂,37 ℃温育1 h,用全自动酶标仪在450 nm波长处测量各孔吸光度(A)值,并计算细胞活力,细胞活力(% )=(A实验组-A空白组) /(APBS组-A空白组)×100%。以A值大小反映细胞增殖能力,A值越大,细胞增殖能力越强。
1.5 Annexin V/碘化丙啶(PI)双标法检测细胞凋亡率
细胞按4×105/孔的密度接种于 6孔板中,待细胞贴壁后,分别给予2.5、5.0及10.0 μmol·L-1HQ进行染毒,同时设PBS对照组。作用48 h后用不含EDTA的胰酶消化,用PBS洗2次,2 000 r·min-1离心5 min,收集(1~5) ×105细胞,加入500 μL结合缓冲液悬浮细胞,加入5 μL Annexin V-FITC混匀后,加入5 μL PI,混匀,室温避光反应5~15 min,1 h内用流式细胞仪检测细胞凋亡率。
1.6 PARP-1基因mRNA表达水平检测
1.6.1 细胞总RNA提取及完整性和纯度鉴定 细胞按4×105/孔的密度接种于 6孔板中,待细胞贴壁后,分别给予2.5、5.0及10.0 μmol·L-1HQ进行染毒,同时设PBS对照组。作用48 h后使用TRIzol试剂抽提细胞总RNA。紫外分光光度计和琼脂糖凝胶电泳检测所得RNA纯度和完整性。质量分数为2%琼脂糖凝胶电泳显示:样品均含有28 S、18 S和5 S 3条条带,其中28 S和18 S条带清晰可见,且两者的亮度比在正常范围内,A260/280均介于1.8~2.0,表明RNA样品的完整性和纯度可用于后续实验。
1.6.2 逆转录合成cDNA 以RNA样品为模板,进行逆转录反应制备cDNA。应用M-MMV逆转录酶,每份取1 μg总RNA进行cDNA合成,取随机引物1 μL,5×buffer 4 μL,RibolockTMRnase Inhibitor 1 μL,10 mmol·L-1dNTP Mix 2 μL,Revertaid M-MulV Reverse Transcriptase 1 μL,DEPC处理水至20 μL,42℃×60 min,70℃×5 min进行逆转录。
1.6.3 引物设计 按照目的基因的GenBank登录号检索得到基因的全长cDNA序列,利用Primer 5.0引物设计软件根据标准荧光定量PCR引物设计原则,设计PAPR-1基因的引物,然后将设计出的引物输入BLAST数据库进行同源性比较,最终得到具有特异性的引物序列。引物序列如下:PAPR-1上游PCR引物,5′-AGACCACGCACAATGCCTATGAC-3′;PARP-1下游引物,5′-GCAGTAGTTCGCACTTTTGGACAC-3′; ACTB上游PCR引物,5′-CAACCGTGAAAAGATGACCCAGAT-3′;ACTB下游PCR引物,5′-GACCAGAGGCATACAGGGACAACA-3′;引物由上海英骏生物公司合成。
1.6.4 PARP-1的实时荧光定量PCR(qRT-PCR)检测 反应体系:3 μL逆转录产物,10 μL Master Mix,浓度为10 μmol·L-1的上游和下游引物各0.4 μL,dH2O 6.2 μL,总共20 μL。反应条件:95℃预变性10 min,95℃变性15 s,58℃退火40 s,共40个循环。融解曲线显示为单峰,且峰形尖锐,说明扩增产物特异性良好,扩增过程中无引物二聚体形成,且DNA产物经琼脂糖凝胶电泳检测显示为单一条带,说明引物符合qRT-PCR检测的标准。采用比较Ct值法,以管家基因ACTB为内参相对定量各实验组样品内目的基因的表达水平,计算公式为:实验组目的基因的相对表达量为2-△△Ct,ΔΔCt=ΔCt实验组-ΔCt对照组,ΔCt=CtPARP-1-CtACTB。每次实验每个样品设有3个平行孔,重复3次。
1.7 统计学分析

2 结 果
2.1 HQ染毒剂量的选择
图1显示:要保证细胞活力在75%以上,染毒剂量不能超过40.0 μmol·L-1。目前国标苯水平为6.0 mg·m-3,在实际生产过程中,很难达到20.0 μmol·L-1的骨髓蓄积量。因此染毒剂量为2.5~10.0 μmol·L-1更符合实际接触水平。
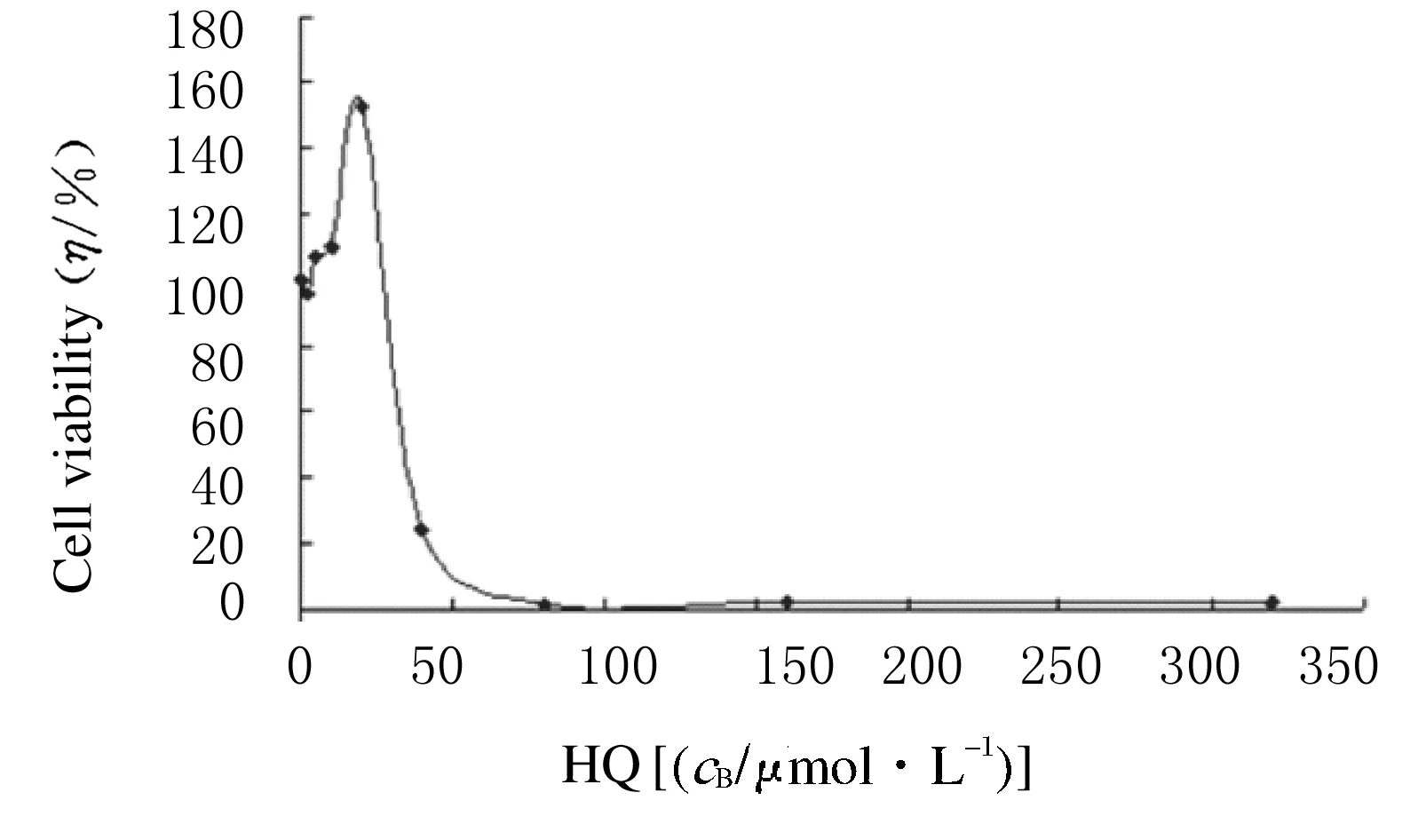
图1 不同剂量HQ作用24 h后BMSCs细胞活力的变化
2.2 HQ作用下BMSCs增殖能力的变化
分别用0、2.5、5.0及10.0 μmol·L-1HQ处理BMSCs,作用24、48及72 h后,各时间点各浓度HQ均可促进细胞增殖,且随着HQ浓度增加细胞增殖能力明显提高(P<0.05)。见表1。
2.3 HQ作用下细胞凋亡率的变化
HQ作用48 h后,与PBS组比较,5.0和10.0 μmol·L-1HQ组细胞早期凋亡率及晚期凋亡率和坏死率均明显降低(P<0.05),且晚期凋亡率和坏死率随着剂量增加而降低。见表2。
2.4 HQ作用下BMSCs中PARP-1基因表达的变化
染毒48 h后,与PBS组(1.00±0.06)比较,2.5、5.0和10.0 μmol·L-1HQ组BMSCs中PARP-1的表达量分别为对照组的(0.92±0.06)、(0.56±0.05)(P<0.05)和(0.45±0.03)倍(P<0.05),呈逐渐下降趋势。
表1 不同剂量HQ作用不同时间后BMSCs增殖能力的变化
表2 不同剂量HQ作用48 h后BMSCs凋亡率的变化
3 讨 论
1960—2003年我国职业人群平均苯接触水平约为51.5 mg·m-3,苯接触浓度在78.8 mg·m-3以内的人群,血中HQ浓度不超过1.1 μmol·L-1。动物实验[6]显示:大鼠接触浓度为1 595 mg·m-3的苯时,血中HQ浓度不超过1.8 μmol·L-1,骨髓中HQ浓度不超过60 μmol·L-1。随着我国职业卫生标准的不断提高,目前苯作业人群骨髓中的HQ已很难达到20 μmol·L-1的蓄积量。因此选择2.5 ~10.0 μmol·L-1作为染毒剂量更符合我国目前苯的职业接触实际水平[7-8]。
间充质干细胞在骨髓中能产生多种骨髓基质细胞,构成造血微环境,并分泌多种造血相关因子及细胞外基质蛋白维持和调节造血功能。研究[9]表明:HQ可通过caspase依赖及非caspase依赖的方式以及与TNFα发生协同作用,促进造血干细胞的凋亡。刘林华等[8]报道:低剂量HQ可促进TK6淋巴母细胞增殖,HQ作用24 h后细胞凋亡率和细胞增殖指数之间的改变趋势相反。本实验结果与该报道一致,各剂量组细胞增殖水平与PBS组比较明显提高,5.0、10.0 μmol·L-1HQ组细胞与PBS组比较,无论是早期凋亡率还是晚期凋亡和坏死率都明显降低,说明低剂量HQ能抑制细胞凋亡,促进细胞的增殖。但凋亡的抑制可延长异常细胞存活,创造了不稳定基因的环境,可促进肿瘤的发生。HQ在体内何时发挥诱导凋亡,何时发生抑制凋亡的作用,可能与其作用的剂量、时间及不同受试细胞有关,与启动不同的血液毒性效应及其血液毒性表现多样性有关。
PARP-1在应对遗传毒性反应过程中发挥重要作用,如参与 DNA 损伤修复、维持基因组稳定性、调节基因转录以及细胞凋亡过程等[10]。在肿瘤的形成过程中,时常伴有PARP-1基因的失活,导致基因突变率增高、基因组稳定性下降和细胞凋亡障碍。苯暴露可导致人类白血病,HQ 是苯的重要代谢产物之一,具有强氧化性,能够引起细胞 DNA 单链断裂,导致肿瘤相关基因失活或激活。本实验结果显示:PARP-1表达量与细胞凋亡的改变趋势相同,与细胞增殖趋势相反,提示PARP-1可能参与HQ诱导的凋亡抑制和细胞增殖。刘林华等[11]研究发现:低剂量HQ处理TK6细胞48 h后,PARP-1蛋白随剂量增加呈下降趋势,并认为PARP-1启动子区的甲基化相关基因MBD2可能在HQ诱导的PARP-1蛋白下调过程中发挥一定作用。Gao等[12]发现:在F32淋巴母细胞中,苯致PARP-1 mRNA 表达水平下降与PARP-1启动子区的高甲基化有关。本实验结果虽提示PARP-1可能参与细胞的增殖和凋亡过程,但进一步的证据以及其表达水平下调的机制还有待深入研究。
[参考文献]
[1]陈长艳,李习艺,郭松超.氢醌对造血干细胞毒效应的研究进展[J].中国卫生工程学,2010,9(1):60-62.
[2]Simón MF,Tatyana VM,Francesca F,et al.Mesenchymal and haematopoietic stem cells form a unique bone marrow niche[J].Nature,2010,466(7308):829-834.
[3]Tao GH,Yang LQ,Gong CM,et al.Effect of PARP-1 deficiency on DNA damage and repair in human bronchial epithelial cells exposed to Benzo(a)pyrene[J].Mol Biol Rep,2009,36(8):2413-2422.
[4]王 强,杨跃新,黄文琪,等.氢醌致细胞凋亡及其机制的离体实验研究[J].工业卫生与职业病,2009,35(3):155-158.
[5]陈 怡,俞 康,吴建波,等.离体培养下氢醌诱导骨髓单个核细胞凋亡的研究[J].中华劳动卫生职业病杂志,2004,22(3):161-164.
[6]Ji Z,Zhang L,Peng V,et al.A comparison of the cytogenetic alterations and global DNA hypomethylation induced by the benzene metabolite,hydroquinone,with those induced by melphalan and etoposide[J].Leukemia,2010,24(5): 986-991.
[7]Kerzic PJ,Liuw S,Panm T,et al.Analysis of hydroquinone and catechol in peripheral blood of benzene-exposed workers[J].Chem Biol Interact,2010,184(1 /2): 182-188.
[8]刘林华,梁小虎,凌晓璇,等.低剂量氢醌对TK6淋巴母细胞生物学性状及miR-221表达影响[J].中国职业医学,2011,38(2):102-105.
[9]Inavat-hussain SH,Mcgussness SM,Johansson R,et al.Caspase-dependent and independent mechanisms in apoptosis induced by hydroquinone and catechol metabolites of remoxipride in HL-60 cells[J].Chem Biol Interaet,2008,128(1):51-63.
[10]Krishnakumar R,Kraus WL.The PARP side of the nucleus: molecular actions,physiological outcomes,and clinical targets [J].Mol Cell,2010,39(1): 8-24.
[11]刘林华,凌晓璇,梁海荣,等.氢醌诱导TK6细胞miR-221表达异常致PARP-1基因下调的机制[J].环境与健康杂志,2011,28(6):485-487.
[12]Gao A,Zuo X,Liu Q,et al.Methylation of PARP-1 promoter involved in the regulation of benzene -induced decrease of PARP-1 mRNA expression [J].Toxicol Lett,2010,195(2011): 114-118.

