Smad2/3/4真核表达质粒的构建及重组蛋白表达
张红艳,王春玉,姚 远,李彦姝,王 迪,李 丰
(1.中国医科大学细胞生物学教研室 卫生部细胞生物学重点实验室 教育部医学细胞生物学重点实验室 辽宁 沈阳 110001;2.辽宁省人民医院消化内科,辽宁 沈阳 110016)
转化生长因子β(TGF-β)超家族是一类作用繁多的细胞因子,参与细胞增殖、分化、细胞外基质改建及胚胎发育等多种细胞活动,并在多种疾病尤其是肿瘤、纤维变性类疾病及自身免疫性疾病的发病中扮演着重要角色[1-2]。TGF-β超家族包括TGF-β、骨形态发生蛋白(BMP)和活化素(activins)等亚类,可以通过激活多个下游信号通路行使其功能,其中Smads信号通路被认为是最关键的。Smads蛋白家族包括8个成员,分为R-Smads,Co-Smad和I-Smads 3类[3]。R-Smads包括Smad1/2/3/5/8,能够与受体结合并被受体磷酸化而激活;Co-Smad指Smad4,能够与活化了的R-Smads结合形成复合体,该复合体可进核结合DNA并与多种转录辅因子共同作用调控基因转录;I-Smads包括Smad6/7,作为R-Smads的竞争性抑制子,负向调控TGF-β通路。TGF-β信号通路受精密的调控,不同的上游配体激活不同的下游分子。TGF-β1属于TGF-β超家族的TGF-β亚类,Smad2/3/4参与该信号通路。Smad2/3/4在细胞质中与多种蛋白相互作用,如SARA[4]和PDK1[5]等。作为TGF-β1通路的重要下游蛋白,Smad2/3/4与某些相互作用蛋白的结合受TGF-β1调控。在TGF-β1作用下,PDK1与Smad2/3/4的结合减弱[5];而Smad2与SARA的结合依赖于TGF-β1刺激[4]。本研究旨在利用基因重组技术构建pcDNA3.1myc-HisA Smad2/3/4真核表达质粒,使用标签抗体建检测Smad2/3/4在细胞中的表达,同时使用标签抗体进行免疫沉淀,质谱分析Smad2/3/4新的相互作用蛋白,进一步探索其生物学功能及在TGF-β信号通路中的功能。
1 材料与方法
1.1 菌株、细胞和质粒大肠杆菌DH5α感受态为本实验室制备;HEK293细胞为本实验室保存;pcDNA3.1myc-HisA载体购自Invitrogen公司,pcDNA3.1-Smad2/3受赠于Sabelle van Seuningen教授,pGEX2T-Smad4受赠于Koichi Shimada教授。
1.2 试 剂PyrobestTMDNA polymerase、dNTP、限制性核酸内切酶EcoRⅠ和KpnⅠ均购自大连 TaKaRa公司;质粒提取及DNA电泳凝胶回收试剂盒购自Promega公司;DNA 和蛋白 marker购自GenScript公司;T4 DNA连接酶购自NEB公司;Myc抗体购自Santa公司;HRP标记的羊抗鼠IgG购自北京中杉金桥公司;引物合成和DNA测序测定由Invitrogen公司完成;Lipofectamine 2000购自Invitrogen公司;DMEM及胎牛血清购自Gibco公司;ECL发光试剂盒购自GE Healthcare 公司;其他试剂均为国产分析纯。
1.3 Smad2/3/4全长基因扩增设计Smad2/3/4扩增的PCR引物,并在引物中加入EcoRⅠ和KpnⅠ2个限制性酶切位点。引物序列见表1。以质粒为模板,利用pyrobest酶,通过PCR扩增,获得Smad2/3/4全长编码序列。

表1 引物序列及酶切位点
1.4 pcDNA3.1myc-HisA-Smad2/3/4表达载体的构建将pcDNA3.1myc-HisA载体和Smad2/3/4 PCR片段用EcoRⅠ和KpnⅠ双酶切后,酶切产物经琼脂糖凝胶电泳分离,凝胶回收纯化产物。回收产物摩尔比按照1∶5(载体∶片段 )比例,利用T4 DNA连接酶,将2个片段常温连接2 h,然后16℃连接过夜,取5 μL连接产物转化到DH5α大肠杆菌感受态细胞中,涂于LB/Amp平板,37℃培养过夜。挑取菌落,接种于含氨苄西林的LB培养基中,37℃振荡过夜。一部分菌液用来保存菌种,另一部分用碱裂解法提取质粒DNA,用EcoRⅠ和KpnⅠ双酶切鉴定外源基因的插入,质粒DNA送Invitrogen公司进行测序分析。
1.5 pcDNA3.1myc-HisA-Smad2/3/4瞬时转染HEK293细胞系HEK293细胞用10%胎牛血清的高糖DMEM高糖培养基培养,细胞铺于6孔板至70% ~ 80%融合,按照Invitrogen公司提供的Lipofectamine 2000转染6孔板的说明书进行操作。
1.6 蛋白质提取与Western blotting鉴定转染24 h后,弃掉培养基,用PBS清洗2次。在细胞中加入60 μL含有蛋白酶抑制剂的RIPA裂解液,用橡皮刮刀将细胞缓慢刮下。收集所有液体至新的离心管中,冰上放置10 min,裂解细胞。13 000 g、4℃离心30 min,将上清转到新的离心管中,取上清5 μL,利用考马斯亮蓝G250染液和0.5 g·L-1BSA,绘制标准曲线,测量595 nm的吸光度(A)值,以结果做直线回归方程:Y = aX + b。测量蛋白样品与对照在595 nm的A值,差值代入标准曲线方程,求出相应蛋白浓度。
将蛋白定量后,取80 μg总蛋白经10% SDS-PAGE凝胶分离,4℃过夜,40 V恒压转移到PVDF膜上,5% 脱脂奶粉封闭1 h。用Flag抗体(1∶1 000稀释)室温孵育2 h,然后TBST洗膜3次,每次10 min。再用辣根过氧化物酶标记的羊抗鼠(1∶5 000稀释)二抗孵育2 h,然后TBST洗膜3次,每次10 min。ECL显影,Western blotting成像系统采集图像。
2 结 果
2.1 PCR扩增Smad2/3/4基因全长以pcDNA3.1-Smad2/3和pGEX2T-Smad4质粒为模板,特异性引物进行PCR扩增Smad2/3/4基因全长。扩增条件为95℃、5 min预变性;95℃、1 min,55℃、1 min,72℃、1 min,进行30个循环;72℃、10 min,温度降至4℃。1%琼脂糖凝胶电泳,溴化乙啶染色后,在紫外灯下观察结果。见图1。
2.2 重组质粒pcDNA3.1myc-HisA-Smad2/3/4的构建及鉴定每个质粒挑取2个克隆,将重组质粒pcDNA3.1myc-HisA-Smad2/3/4用EcoRⅠ和KpnⅠ双酶切后,图2中1和2泳道为Smad2,得到5 400和1 401 bp 的2条带;3和4泳道为Smad3,得到5 400和1 275 bp的2条带;5和6泳道为Smad4,5泳道得到5 400和1 656 bp的2条带,6泳道未得到目的片段。重组质粒的酶切鉴定表明质粒构建成功,经过测序分析,外源系列在NCBI-Blast比对结果与Smad2/3/4编码序列一致。
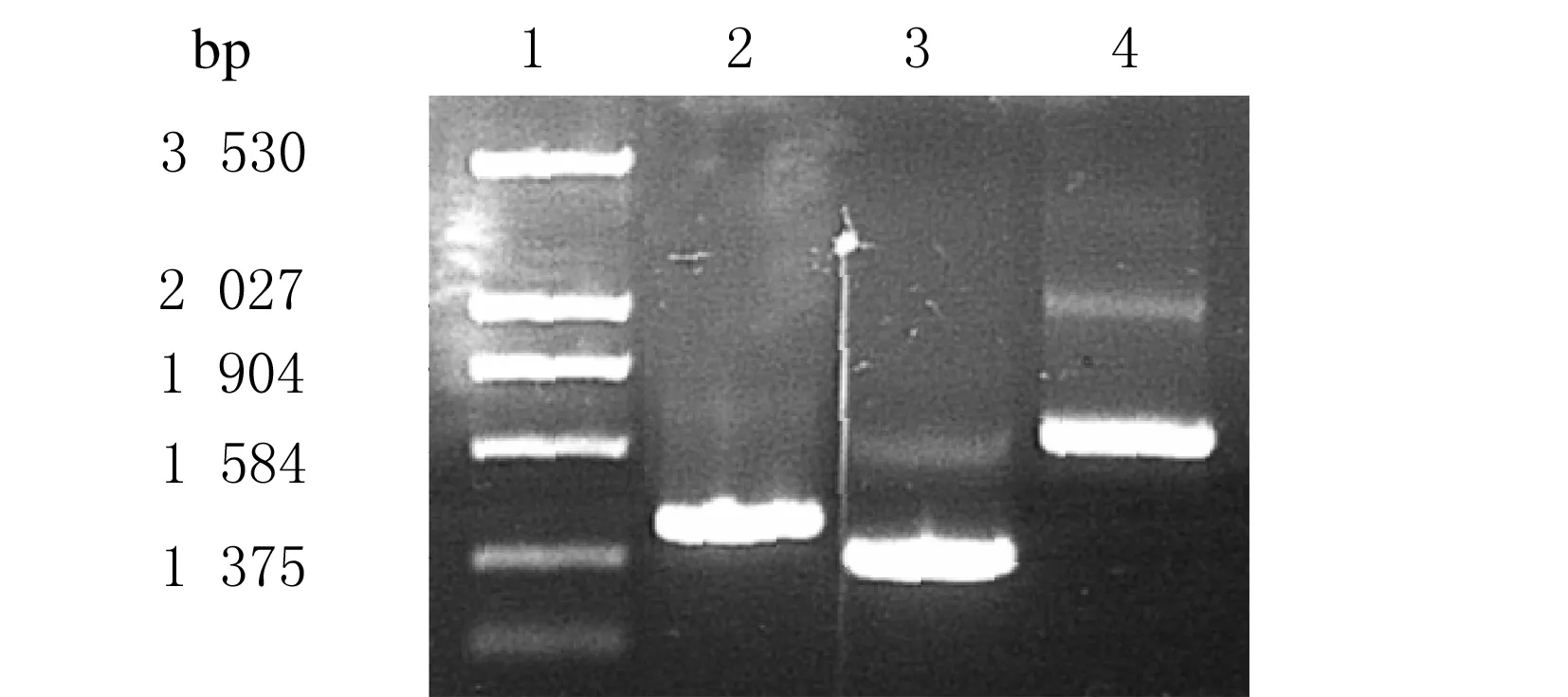
图1 Smad2/3/4基因PCR产物的扩增
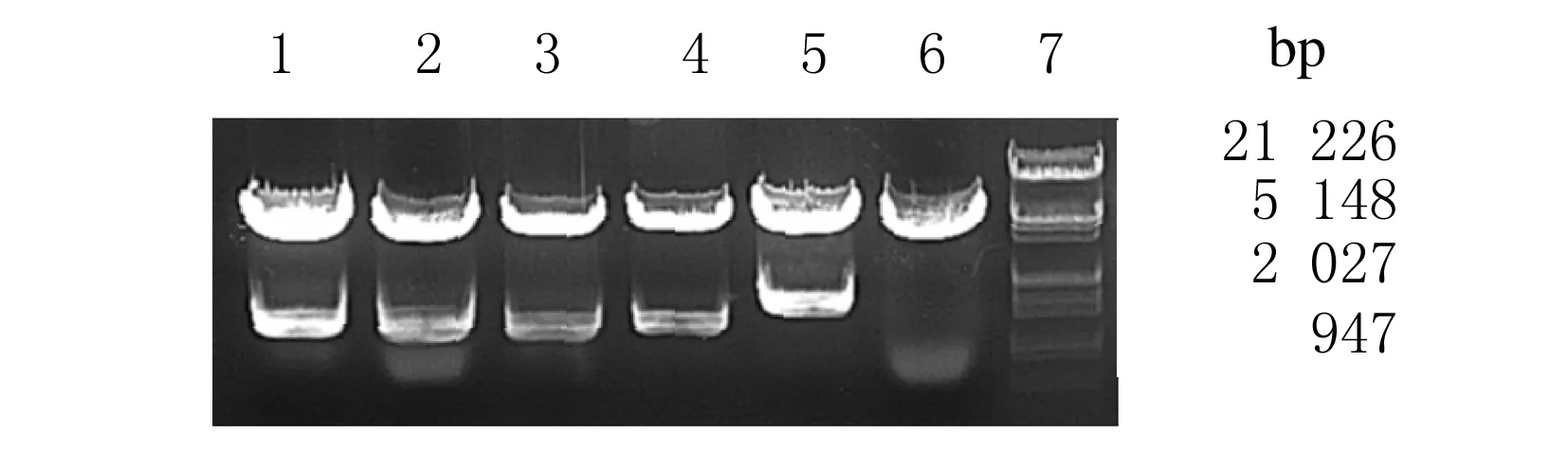
图2 重组质粒pcDNA3.1myc-HisA-Smad2/3/4酶切分析
2.3 Western blotting检测蛋白表达分别将pcDNA3.1myc-HisA空载和pcDNA3.1myc-HisA-Smad2/3/4转染HEK293细胞,24 h后收集细胞,提取蛋白,经SDS-PAGE凝胶电泳,Western blotting检测蛋白表达,转染pcDNA3.1myc-HisA-Smad2/3/4,有一明显条带(图3),空载体对照组未出现反应条带,结果表明构建的真核表达质粒在HEK293细胞中表达。
3 讨 论
TGF-β对上皮细胞生长有抑制作用。在肿瘤早期,可以抑制肿瘤的发生。但是,在肿瘤晚期,TGF-β1的生长抑制作用被限制,并通过引起细胞的上皮向间质转化促进癌细胞迁移和侵袭[6]。一些肿瘤中存在TGF-β信号通路蛋白(如TβRⅡ,Smad4)的突变,从而逃避TGF-β引起的生长抑制。利用细胞系进行研究发现:仅40%的胃癌细胞中存在TGF-β信号通路蛋白的突变,但在外源转入突变蛋白对应的野生型蛋白后,其中75%的细胞仍然不能恢复对TGF-β的反应性,这提示胃癌细胞内存在重要的TGF-β通路抑制因子。有学者[7-8]发现一些TGF-β通路的抑制因子,如在骨髓瘤中CDK2通过磷酸化Smad2的MH1区破坏TGF-β引起的转录调节功能;Cam kinaseⅡ通过磷酸化Smad2/3/4抑制TGF-β/Smads的转录调节功能;PKB通过结合Smad3抑制其转录活性及核转位。但是,还可能存在未被发现的TGF-β通路抑制因子。
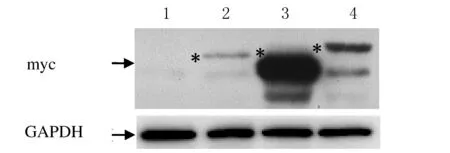
图3 Western blotting检测pcDNA3.1myc-HisA-Smad2/3/4 融合蛋白在HEK293细胞中的表达
经典的Smads信号通路是TGF-β作为配体与相应膜受体结合,进而激活相应下游信号蛋白Smads,行使对应的生物学功能,形成一个严格而精密的信号网络。TGF-β1属于TGF 超家族的TGF 亚类,能够结合并激活细胞膜上的TGF-β受体Ⅱ(TβRⅡ),活化的TβRⅡ进而结合并磷酸化同样位于细胞膜上的TGF-β受体Ⅰ(TβRⅠ,AKL5)。具有活性的受体复合体形成后,细胞质内的Smad2/3 C末端的SSXS序列被TβRⅠ磷酸化,与Smad4形成复合体,进入细胞核并行使基因转录调控功能[9]。
最近有研究表明:虽然经典的Smads作用是由R-Smads与Smad4形成复合体来完成,但也存在不依赖Smad4的情况。在角质细胞中,IKKalpha能够结合Smad2/3并促进Mad1、Mad2等介导TGF-β引起的细胞生长抑制基因的表达,这种促进不依赖于Smad4[10]。在造血干细胞中,核蛋白转录中介因子1γ(TIF1γ)能够与Smad4竞争和Smad2/3的结合,介导TGF-β/Smads引起的不同作用:Smad2/3-TIF1γ介导细胞分化,而Smad2/3-Smad4介导细胞的生长抑制[11]。
目前,肿瘤已经成为威胁人类健康的重要疾病,其发病率逐年上升,但其发生发展的分子机制仍未完全阐明,TGF-β/ Smads 信号转导通路在机体组织中生物学作用广泛,与肿瘤的发生发展密切相关。因此,本实验利用DNA重组技术将Smad2/3/4重组到pcDNA3.1myc-HisA载体中,通过酶切和测序保证扩增片段的正确性,并采用Western blotting方法证实融合蛋白的表达。融合蛋白中含有myc标签,可用于目标蛋白的纯化和检测。
综上所述,本实验成功构建pcDNA3.1myc-HisA- Smad2/3/4真核表达质粒,为进一步研究其在信号转导通路中的作用提供了实验基础。
[参考文献]
[1]Lin X,Chen Y,Meng A,et al.Termination of TGF-beta superfamily signaling through SMAD dephosphorylation--a functional genomic view [J].J Genet Genomics,2007,34(1): 1-9.
[2]Wrighton KH,Lin X,Feng XH.Phospho-control of TGF-beta superfamily signaling [J].Cell Res,2009,19(1): 8-20.
[3]Brown KA,Pietenpol JA,Moses HL.A tale of two proteins: differential roles and regulation of Smad2 and Smad3 in TGF-b signaling [J].J Cell Biochem,2007,101(1):9-33.
[4]Runyan CE,Schnaper HW,Poncelet AC.The role of internalization in transforming growth factor beta1-induced Smad2 association with Smad anchor for receptor activation (SARA) and Smad2-dependent signaling in human mesangial cells [J].J Biol Chem,2005,280(9): 8300-8308.
[5]Seong HA,Jung H,Kim KT,et al.3-phosphoinositide-dependent PDK1 negatively regulates transforming growth factor-beta-induced signaling in a kinase-dependent manner through physical interaction with Smad proteins [J].J Biol Chem,2007,282(16): 12272-12289.
[6]Wakefield LM,Roberts AB.TGF-beta signaling: positive and negative effects on tumorigenesis [J].Curr Opin Genet Dev,2002,12(1): 22-29.
[7]Baughn LB,Di Liberto M,Niesvizky R,et al.CDK2 phosphorylation of Smad2 disrupts TGF-beta transcriptional regulation in resistant primary bone marrow myeloma cells [J].J Immunol,2009,182(4): 1810-1817.
[8]Remy I,Montmarquette A,Michnick SW.PKB/Akt modulates TGF-beta signalling through a direct interaction with Smad3 [J].Nat Cell Biol,2004,6(4): 358-365.
[9]Schmierer B,Hill CS.TGFbeta-SMAD signal transduction: molecular specificity and functional flexibility [J].Nat Rev Mol Cell Biol,2007,8(12): 970-982.
[10]Descargues P,Sil AK,Sano Y,et al.IKKalpha is a critical coregulator of a Smad4-independent TGFbeta-Smad2/3 signaling pathway that controls keratinocyte differentiation [J].Proc Natl Acad Sci USA,2008,105(7): 2487-2492.
[11]He W,Dorn DC,Erdjument-Bromage H,et al.Hematopoiesis controlled by distinct TIF1gamma and Smad4 branches of the TGFbeta pathway [J].Cell,2006,125(5): 929-941.

